 Théorie et pratique des mesures de la pression osmotique par
Théorie et pratique des mesures de la pression osmotique par
posent à propos du calcul de la pression osmotique dont l'importance en biologie pression osmotique en solution. A nouveau cette loi n'est vérifiable que ...
 osmolarite.pdf
osmolarite.pdf
exemple : calcul de la pression osmotique due à une solution de. 10 mM de NaCl à 20°C. n/V = 10 mM. NaCl en solution : se dissocie en Na+ et Cl-. → i = 2.
 osmose_cryometrie_starling [Mode de compatibilité]
osmose_cryometrie_starling [Mode de compatibilité]
La pression osmotique est égale à la différence des pressions osmotiques de chacune des deux solutions opposées à travers la même membrane
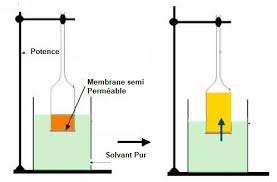
 Travaux pratiques de physiologie végétale
Travaux pratiques de physiologie végétale
de solutions de concentration croissante celle qui en équilibre osmotique - Calculer la pression osmotique du suc vacuolaire en fonction des résultats ...
 Chapitre 2
Chapitre 2
Calcul de la pression osmotique en unités internationale : Pascal (Pa) ✓ La grandeur π = ρgh est appelée la pression osmotique de la solution c'est-à-dire ...
 POLYCOPIE DES TRAVAUX DIRIGES DE PHYSIOLOGIE VEGETALE
POLYCOPIE DES TRAVAUX DIRIGES DE PHYSIOLOGIE VEGETALE
Quelles sont ces deux pressions ? 2. Calculer la pression osmotique exercée à -20°C par une solution de saccharose à. 171g/l. 3.
 Biologie cellulaire. Exercices et méthodes
Biologie cellulaire. Exercices et méthodes
b. La pression osmotique de la solution aqueuse 20 % sera plus grande. □ c. L'eau va passer au travers de la membrane
 Solvants solutés et règles de dilution
Solvants solutés et règles de dilution
Isotonie : solutions qui ont la même pression osmotique (= concentration en ions dissous). Hypotonie : solution avec une concentration en ions.
 Production de la matière organique et flux dénergie
Production de la matière organique et flux dénergie
1- Calculer la concentration molaire et la concentration massique et la concentration en pourcentage (C%) ? 2- Calculer la pression osmotique de la solution ?
 Osmose inverse.pdf
Osmose inverse.pdf
Si on applique une pression sur la solution concentrée la quantité d'eau calculer la pression osmotique théorique de l'eau salée utilisée. • tracer ...
 osmolarite.pdf
osmolarite.pdf
exemple : calcul de la pression osmotique due à une solution de. 10 mM de saccharose à 20°C. n/V = 10 mM saccharose en solution : ne se dissocie pas.
 Untitled
Untitled
exemple : calcul de la différence de pression osmotique d'une solution A contenant 10 M de saccharose et d'une solution B contenant 10 M de NaCl.
 Théorie et pratique des mesures de la pression osmotique par
Théorie et pratique des mesures de la pression osmotique par
n'échappe pas à cette étape analytique et la connaissance des solutions posent à propos du calcul de la pression osmotique dont l'importance en.
 Biologie cellulaire. Exercices et méthodes
Biologie cellulaire. Exercices et méthodes
À 0 ºC la pression osmotique d'une solution benzénique de 7
 TD eau et régulation osmotique
TD eau et régulation osmotique
Calculer la molarité d'une solution aqueuse contenant 585 mg de NaCl par litre différence de pression osmotique entre les deux compartiments.
 Solvants solutés et règles de dilution
Solvants solutés et règles de dilution
Reconstitution de solutions à partir d'une poudre. Calculs de doses choix de solvants Isotonie : solutions qui ont la même pression osmotique (=.
 Chapitre 2
Chapitre 2
En comparant le solvant pur avec la solution présente : Exemple : calcul de la différence de pression osmotique d'une solution A contenant 10 mM de.
 a) Donner la définition de la molarité dune solution. b) Calculer la
a) Donner la définition de la molarité dune solution. b) Calculer la
Calculer la pression oncotique « vraie » à partir de l'équation de van't Hoff. réponse : Concentration molaire en albumine = 45/69 000 = 0652 mM
 (Démonstration cours )
(Démonstration cours )
Le compartiment A renferme une solution d'urée à 174 mg/l et l'autre une pure à la température T=37°C. Calculer la pression osmotique.
 VI-Application de la Pression osmotique:
VI-Application de la Pression osmotique:
Soit une membrane perméable au solvant (l'eau) et séparant deux compartiments dont l'un contient de l'eau pure et l'autre un soluté en solution aqueuse.
 [PDF] Théorie et pratique des mesures de la pression osmotique - Agritrop
[PDF] Théorie et pratique des mesures de la pression osmotique - Agritrop
posent à propos du calcul de la pression osmotique dont l'importance en 1 Enoncé L'abaissement du point de congélation d'une solution étendue et non
 Propriétés des solutions aqueuses et pression osmotique
Propriétés des solutions aqueuses et pression osmotique
Calculer la pression osmotique d'une solution de saccharose de concentration 06 mole par litre à la température de 20°C On a c = 06 mol l-1 ; T = 29315 K
 [PDF] osmolaritepdf - e-fisio
[PDF] osmolaritepdf - e-fisio
exemple : calcul de l'osmolarité et de la pression osmotique d'une solution contenant 10 mM d'urée physique de l'osmolarité osmolarité : 10 x 1 x 1 = 10
 [PDF] TD de BIOPYSIQUE - Exercices corrigés - F2School
[PDF] TD de BIOPYSIQUE - Exercices corrigés - F2School
c) Quelle est la pression osmotique si ce travail est développé en 02 s Corrigé 1 l = 10-3 m3 12 h = 43200 s Pour calculer la pression osmotique
 [PDF] Osmose Pression osmotique
[PDF] Osmose Pression osmotique
Osmose Pression osmotique 1 Situation expérimentale Calcul des flux • Membrane imperméable au soluté T = 0 (mais perméable au solvant)
 [PDF] Chapitre 2 - opsuniv-batna2dz
[PDF] Chapitre 2 - opsuniv-batna2dz
La pression osmotique est par définition la pression qu'il faudrait exercer sur une solution pour l'amener à un état d'équilibre (= absence de flux net) avec
 [PDF] Biologie cellulaire Exercices et méthodes - Dunod
[PDF] Biologie cellulaire Exercices et méthodes - Dunod
1) Quelle solution possède la plus grande pression osmotique ? 2) Quelle solution se dilue au passage de l'eau au travers de la membrane ?
 [PDF] Chapitre 3 : Losmose
[PDF] Chapitre 3 : Losmose
*Étudier la Pression oncotique et équilibre de Sterling ainsi que Énergie Pré-requis : L'étudiant est capable de calculer : *La pression osmotique *La
 [PDF] TD eau et régulation osmotique
[PDF] TD eau et régulation osmotique
La membrane séparant A et B est perméable a l'eau mais pas aux ions (membrane semi- perméable) Calculer la pression osmotique de cette solution en kPa (T° =
Comment calculer la pression osmotique de la solution ?
Pour calculer une pression osmotique, la formule de calcul est basée sur : Posmotique = nRT/V, où Posmotique = kPa = atmosphères. La pression osmotique d'une solution diluée obéit à une relation de même forme que la loi des gaz parfaits.Comment calculer la pression osmotique d'une solution de NaCl ?
Pression, tension osmotique. Pression qui détermine le phénomène d'osmose et qui correspond à la différence des pressions exercées de part et d'autre d'une membrane semi-perméable par deux liquides de concentration différente.C'est quoi la pression osmotique en SVT ?
La pression osmotique naît de la séparation par une membrane* semi-perméable de deux compartiments de concentrations différente. L'eau migre du compartiment le moins concentré vers le plus concentré afin d'« équilibrer » le système pour avoir la même force ionique dans les deux compartiments.
1 Elise Rochais - IFSI 1ère année
Le circuit du médicament
Le circuit du médicament = 4 étapes :
yLa prescription : médecin yLa dispensation : pharmacien yLa préparation : pharmacien/préparateur/IDE yL'administration ͗ IDE 2La préparation des médicaments
Acte de préparation et reconstitution du médicament aǀant l'administration de celui-ci au patient yReconstitution de solutions ă partir d'une poudre yCalculs de doses, choix de solvants yRègles à respecter : yRecommandations de bonne pratiquesElise Rochais - IFSI 1ère année 3
Préparation des médicaments
injectables yMédicament injectable : yDose individuelle le plus souvent adaptée au patient (poids, yDoses unitaires de médicaments standardiséesConditions indispensables :
Elise Rochais - IFSI 1ère année 4
Stérilité et apyrogénicité de la solution PlanPARTIE I : SOLVANTS ET SOLUTES
yGénéralités Ȃ définitions Ȃ rappels yLes différents solvants et solutés yLes contenantsPARTIE II : REGLES DE DILUTION - PREPARATION
5 Elise Rochais - IFSI 1ère année
SOLVANTS ET SOLUTES
PARTIE I
6 Elise Rochais - IFSI 1ère année
Définitions
ySolvant : liquide possédant la propriété de dissoudre certaines substances solution Tout liquide aqueux contenant une ou plusieurs substances médicaments ySolutés massifs : V > 100 mL plusieurs solutés dans un solvantElise Rochais - IFSI 1ère année 7
Généralités
Elise Rochais - IFSI 1ère année 8
Généralités
yIsotonie : solutions qui ont la même pression osmotique (= concentration en ions dissous) yHypotonie : solution avec une concentration en ions inférieure (au sang par exemple) yHypertonie : solution avec une concentration en ions supérieureElise Rochais - IFSI 1ère année 9
Osmose/effet osmotique
une membrane semi-perméable (laisse passer H20, pas les grosses molécules par ex)Elise Rochais - IFSI 1ère année 10
tend à égaliser les concentrations de solution au niveau cellulaireAu niveau cellulaire
Au niveau des globules rouges :
Elise Rochais - IFSI 1ère année 11
Hypotonie
les hématiesEclatement de la
cellule = hémolyseIsotonie Hypertonie
hématies la cellule se collabeConcentration en
hématies identique _ _ _Au niveau cellulaire
Au niveau des globules rouges :
Elise Rochais - IFSI 1ère année 12
Hypotonie
les hématiesEclatement de la
cellule = hémolyseIsotonie Hypertonie
hématies la cellule se collabeConcentration en
hématies identique _ _ _Généralités
yMédicament injectable se présente sous forme de : yPoudre ou lyophilisat à reconstituer y2 étapes successives : yEtape de reconstitution (si poudre ou lyophilisat) yEtape de dilution ySolvants différents, contraintes physico-chimiques différentes yEx : érythromycine lyophilisat : reconstitution uniquement avec eau PPI, dilution possible ensuite dans G5% ou NaCl 0,9%Elise Rochais - IFSI 1ère année 13
Généralités
yVoie IV yPériphérique yCentrale yVoie SC (réhydratation personne âgée,Elise Rochais - IFSI 1ère année 14
Classification des solvants et
solutés yǯ 00 yLes solutés glucosés yLes cristalloïdes yLes solutés alcalinisants yLes colloïdes yLes solutés osmotiquesElise Rochais - IFSI 1ère année 15
Eau pour préparations injectables
Eau PPI : = eau stérile, exempte de pyrogènes (= qui provoque de la fièvre) et de particules Ȉ Hypotonique-> ne pas injecter seule ! Sinon hémolyse médicaments injectables ySolvantEx : Augmentin® :
Poudre remise en solution ds eau PPI
ou dans NaCl 0,9% [Vidal]Elise Rochais - IFSI 1ère année 16
Solutés glucosés
= solutions aqueuses contenant du glucose (dextrose) (% correspond au nombre de grammes de glucose / 100 mL)3 types :
yhypotonique : G2,5% yisotonique : G5% yhypertonique : G10%, 15%, 20%, 30% et 50% Ex : Amikacine® : reconstituer le contenu du flacon avec deNaCl 0,9%, G5% ou G10%.
Elise Rochais - IFSI 1ère année 17
Solutés glucosés
Indications :
ySolutés hypotoniques (G2,5%) : yRéhydratation dans les états hyperosmolaires yPatients diabétiquesAdministration : voie IV lente
y Solutés isotoniques (G5%) : yHydratation yVéhicule pour administration de médicaments injectablesyA"""- ..." ȋδ -"- ""-±"Ȍ
Administration : voie IV
Elise Rochais - IFSI 1ère année 18
Solutés glucosés
ySolutés hypertoniques (G10%, 15%, 20%, 30% et 50%) yHypoglycémie sévère yProphylaxie et traitement de la cétose dans les dénutritions, les diarrhées ou les vomissements yPrévention des déshydratations intra et extra cellulaires yRéhydratation lorsqu'il existe une perte d'eau supérieure à la perte en chlorure de sodium et autres osmoles yVéhicule pour apport thérapeutique en période pré-opératoire, per-opératoire et post-opératoire immédiate yApport calorique glucidiqueEx : 1L de G30% apporte 1200 kcal
Administration : voie IV centrale
Elise Rochais - IFSI 1ère année 19
Solutés glucosés
yEffets indésirables : yDiurèse osmotique, polyurie yDéshydratation yHyperglycémie, hypokaliémie yThrombophlébite yContre-indications : yHypersensibilité, intolérance au glucose ySurcharge hydrique yHyperglycémie, acidose yIRC sévère (G50%) yMises en garde : yDiabète : risque de déséquilibre ySurveillance kaliémie, glycémie, glycosurieElise Rochais - IFSI 1ère année 20
Les cristalloïdes
yTraversent facilement la paroi des vaisseaux yPrincipal utilisé : sérum physiologique yChlorure de sodium, NaCl yA la concentration de 0,9% ysoit 0,9 gramme de NaCl dans 100 mL yOu 9 grammes dans 1 LElise Rochais - IFSI 1ère année 21
1 gramme (g) = 1000 milligrammes (mg)
1 Litre (L) = 1000 millilitres (mL)
Les cristalloïdes
1.Isotoniques :
yNaCl 0,9% (sérum physiologique) : yRéanimation hydroélectrolytique : apport Na et Cl yHydratation, garde veine yPerfusion IV ou administration SC yRinger = Na, K, Ca/Ringer lactate = Na, K, Ca, lactate yDéshydratation yHypovolémie (hémorragies, brûlures...) yAcidose métabolique (pour Ringer lactate)Elise Rochais - IFSI 1ère année 22
Les cristalloïdes
2.Hypertoniques :
yNaCl 7,5% : 75g de Na/L yNaCl 10% (ampoule) : 100g de Na/L yNaCl 20% (ampoule) : 200g de Na/L yCorrection des pertes hydroélectrolytiques avec apport yApport sodique (nutrition parentérale) yPerfusion IV centraleElise Rochais - IFSI 1ère année 23
Les cristalloïdes
yEffets indésirables : yHyperhydratation yContre-indications : ySolutés salés : rétention hydrosodée, insuffisance cardiaque, cirrhose hépatique décompensée, hypernatrémie, hyperchlorémie yRinger (lactate) : hyperhydratation, insuffisance cardiaque, hyperkaliémie, hypercalcémie, alcalose métabolique (Ringer lactate)Elise Rochais - IFSI 1ère année 24
Les polyioniques glucosés
2 formules :
1.Glucose + 4g Na + 2g K (/L)
yGlucidion G5%®, Polyionique G5%®, Bionolyte G5%®,Osmotan
͝ά̾Ȉ Glucidion G10%®, Polyionique
G10%®, Bionolyte G10%®
2.Glucose + 2g Na + 1,5g K + 1g de Ca (/L)
G10%®
Elise Rochais - IFSI 1ère année 25
Les polyioniques glucosés
yIndications : yApports calciques glucidiques yDésordres hydroélectrolytiques yDéshydratation toléré) yEffets indésirables : oedèmes, hyperkaliémieElise Rochais - IFSI 1ère année 26
Les solutés alcalinisants
2 types :
yIsotonique : bicarbonate de sodium 1,4% yHypertonique : ybicarbonate de sodium 4,2% (semi-molaire) ybicarbonate de sodium 8,4% (molaire)Elise Rochais - IFSI 1ère année 27
Les solutés alcalinisants
yIndications : yAcidose métabolique toxiques ex : aspirine) yHyperkaliémie menaçant le pronostic vital (Ĺ entrée intracellulaire de K) yCertaines intoxications (Antidépresseurs tricycliques, salicylés...) acido- basiquesElise Rochais - IFSI 1ère année 28
Les solutés alcalinisants
hypertoniques yEffets indésirables : yHypokaliémie yAlcalose métabolique yHypernatrémie yMises en garde : ySuivi ionogramme (K), gaz du sang, pH yNombreuses incompatibilités physico-chimiques +++Elise Rochais - IFSI 1ère année 29
Les colloïdes
= grosses molécules qui restent dans les vaisseaux pendant un certain temps et attirent l'eau des liquides interstitielsPouvoir de remplissage > cristalloïdes
yColloïdes naturels : Albumine (Médicament Dérivé du Sang) dextransElise Rochais - IFSI 1ère année 30
Les colloïdes
1.Les gélatines : Solutés constitués de molécules
protéiques (gélatines modifiées) Expansion volémique au moins égale au volume perfuséÉlimination rapide
yGélofusine 4%® (gélatine, Na) yPlasmion® (gélatine, Na, Mg, K, lactate, chlorures)Elise Rochais - IFSI 1ère année 31
Les colloïdes
yIndications : yRemplissage vasculaire yTraitement ou prophylaxie des états de chocs hypovolémiques (suite hémorragies, brûlures, grandes déshydratations) et yHypotension au cours des anesthésies yEffets indésirables : yHyperkaliémies, alcalose métabolique (Plasmion®)Elise Rochais - IFSI 1ère année 32
Les colloïdes
ǯhydroxyéthylamidons HEA (glucides naturels modifiés) Expansion volémique rapide, supérieure ou égale au volume perfuséMaintien le volume sanguin pendant 6h
yVoluven®, Restorvol 6%® = HEA + NaCl yPlasmavolume® = HEA, Na, K, Ca, Mg, acétate, chloruresElise Rochais - IFSI 1ère année 33
Les colloïdes
yIndications : remplissage vasculaire (restauration du volume sanguin circulant) yLes spécialités à base d'HEA doivent uniquement être utilisées dans le traitement de l'hypovolémie due à des pertes sanguines aiguës lorsque l'utilisation des cristalloïdes seuls est jugée insuffisante. pour détecter une éventuelle hypersensibilitéElise Rochais - IFSI 1ère année 34
Les colloïdes
yEffets indésirables : y2±...- ǯ"""-± yTroubles respiratoires, cardiovasculaires (hypotension...) y Hypernatrémie, hyperchlorémie (Hyperhes®)Elise Rochais - IFSI 1ère année 35
Les colloïdes
yContre-indications : nombreuses ! yHypersensibilité yIRC ou thérapie d'épuration extrarénale continue yTroubles de la coagulation sévères (hémophilies, maladie de Willebrand)yInsuffisance cardiaque ou hépatique sévère, troubles de la natrémie et de la chlorémie, accouchement
y Hémorragies intracrâniennes yPatients atteints de sepsis yPatients brûlés yPatients déshydratésElise Rochais - IFSI 1ère année 36
Les colloïdes
3.Les dextrans : Solutés constitués de glucose
Expansion volémique rapide, supérieure ou égale au volume perfuséNe sont plus utilisés (mauvaise tolérance)
Indication :
Hypovolémie avec hypotension liée à un état de choc traumatique (dose unique, perfusion IV rapide 2-5min)Elise Rochais - IFSI 1ère année 37
Les solutés osmotiques
yLe mannitol ySolutés hypertoniques à 10% et 20% yIndications : yHypertension intra-oculaire yIR oligo-anurique yDiurèse osmotique dans certaines intoxicationsElise Rochais - IFSI 1ère année 38
Les solutés osmotiques
yEffets indésirables : OAP yContre-indications : yHypersensibilité yHyperosmolarité, déshydratation yMises en garde : pulmonaire ySurveillance bilan hydroélectrolytique, diurèse, TA, fonction rénaleElise Rochais - IFSI 1ère année 39
Les contenants
3 types de contenants :
yAmpoules : verre, polypropylène yFlacons : verre, polyéthylène yPoches : PVCDifférents niveaux de rigidité :
Elise Rochais - IFSI 1ère année 40
Les contenants
yVerre : différents types yType I : verre neutre dans la masse (sodocalcique)ĺ ampoules yType II : verre neutre en surface (borosilicate)ĺ flacons, verrerie industrielle et de laboratoire yType III : verre silico-sodo-calcique normal, verre usuelĺ y(Type IV : ne convient pas au domaine pharmaceutique) yPolychlorure de vinyle = PVC = polymère thermoplastique yPochesElise Rochais - IFSI 1ère année 41
Les contenants
yPolypropylène = PP = polymère thermoplastique appartenant à la famille des polyoléfines yPolyéthylène (basse densité) = PE-LD = polymère thermoplastique appartenant à la famille des polyoléfines yLe plus important polymère de synthèse devant le PP et le PVC yProduits souples : flacons, poches, mais aussi sacs poubelles, flacons de ketchup.Elise Rochais - IFSI 1ère année 42
REGLES DE DILUTION
PARTIE II
43 Elise Rochais - IFSI 1ère année
PlanPARTIE II : REGLES DE DILUTION
yDéfinitions yUnités yCalculs de dose yDilution, débit yIncompatibilités physico-chimiques yRègles de bonnes pratiques de préparation et recommandationsElise Rochais - IFSI 1ère année 44
Définitions
yPosologie : quantité de médicament à administrer par unité de temps. Dose de médicament nécessaire pour yDose : quantité de médicament prescrite et administrée à chaque prise yEffet : concentration adéquate de médicament pendant un temps suffisant contenue dans une unité galénique45 Elise Rochais - IFSI 1ère année
Définitions
de volume Expression en unité de masse pour un volume donné (mg/mL, g/L) Parfois en % : % = x grammes dans 100mL => m/v : nombre de grammes dans 100 mL de produit fini.Ex : KCl 20%, ampoule de 10 ml ߮
46 Elise Rochais - IFSI 1ère année
Définitions
connue et supérieure à celle souhaitée. yPar ajout de solvant (S1 ->S2) avec du solvant pour conserver le même volume (S1 -> S3)Elise Rochais - IFSI 1ère année 47
S1 S2 S3C1 = Q1/V1
C2 = Q2/V2
Et Q2 =Q1
C3 = Q3/V3
Et V3 = V1
Unités
yMasse (ou poids) : unité internationale = le kgUtilisation du gramme (g) en thérapeutique :
yTemps : unité de base = la seconde (s)1h=60min=60x60=3600s
yVolume : unité internationale = le m3 (1 m3 = 1000 litres),1 cm3 (cc) = 1 mL
yLa capacité : en litres (L)Elise Rochais - IFSI 1ère année 48
g dg cg mg Ɋ (ou mcg)1 0 0 0 000
L dL cL mL (ou cc) Ɋ
1 0 0 0 000
Autres unités
yUnités internationales : UI (activité enzymatique) ATTENTION : héparines, équivalence 1 mg = 100 UI ? NONyConcentration par mL différente selon les spécialités, de 20 UI/ mL (héparine de rinçage) à 25 000 UI/mL
yCuillères : yÀ café : 5 mL yÀ dessert : 10 mL yÀ soupe : 15 mLElise Rochais - IFSI 1ère année 49
Ex : héparines
yLOVENOX 4000 UI anti-Xa/0,4 ml sol inj seringue préremplie : Solution injectable SC et intravasculaire à 2000 UI anti-Xa/0,2 ml (correspondant à 20 mg/0,2 ml) et à 4000 UI anti-Xa/0,4 ml (correspondant à 40 mg/0,4 ml) yFRAXODI 11 400 UI AXa/0,6 ml sol inj SCquotesdbs_dbs43.pdfusesText_43[PDF] calcul pression osmotique nacl
[PDF] osmose pomme de terre
[PDF] structure en coque architecture
[PDF] structure ? ossature
[PDF] construction de maison ? ossature de bois livre
[PDF] construction de maison ? ossature de bois
[PDF] maison ossature bois canada
[PDF] portée des solives de plancher
[PDF] coupe de mur maison ossature bois
[PDF] assemblage ossature bois
[PDF] ostinato mélodique exemple
[PDF] chanson connue avec ostinato
[PDF] ostinato musique classique
[PDF] culture en placard pdf
