 Théorie et pratique des mesures de la pression osmotique par
Théorie et pratique des mesures de la pression osmotique par
posent à propos du calcul de la pression osmotique dont l'importance en biologie pression osmotique en solution. A nouveau cette loi n'est vérifiable que ...
 osmolarite.pdf
osmolarite.pdf
exemple : calcul de la pression osmotique due à une solution de. 10 mM de NaCl à 20°C. n/V = 10 mM. NaCl en solution : se dissocie en Na+ et Cl-. → i = 2.
 osmose_cryometrie_starling [Mode de compatibilité]
osmose_cryometrie_starling [Mode de compatibilité]
La pression osmotique est égale à la différence des pressions osmotiques de chacune des deux solutions opposées à travers la même membrane
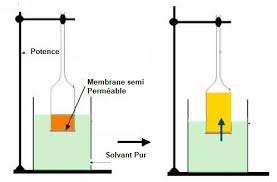
 Travaux pratiques de physiologie végétale
Travaux pratiques de physiologie végétale
de solutions de concentration croissante celle qui en équilibre osmotique - Calculer la pression osmotique du suc vacuolaire en fonction des résultats ...
 Chapitre 2
Chapitre 2
Calcul de la pression osmotique en unités internationale : Pascal (Pa) ✓ La grandeur π = ρgh est appelée la pression osmotique de la solution c'est-à-dire ...
 POLYCOPIE DES TRAVAUX DIRIGES DE PHYSIOLOGIE VEGETALE
POLYCOPIE DES TRAVAUX DIRIGES DE PHYSIOLOGIE VEGETALE
Quelles sont ces deux pressions ? 2. Calculer la pression osmotique exercée à -20°C par une solution de saccharose à. 171g/l. 3.
 Biologie cellulaire. Exercices et méthodes
Biologie cellulaire. Exercices et méthodes
b. La pression osmotique de la solution aqueuse 20 % sera plus grande. □ c. L'eau va passer au travers de la membrane
 Solvants solutés et règles de dilution
Solvants solutés et règles de dilution
Isotonie : solutions qui ont la même pression osmotique (= concentration en ions dissous). Hypotonie : solution avec une concentration en ions.
 Production de la matière organique et flux dénergie
Production de la matière organique et flux dénergie
1- Calculer la concentration molaire et la concentration massique et la concentration en pourcentage (C%) ? 2- Calculer la pression osmotique de la solution ?
 Osmose inverse.pdf
Osmose inverse.pdf
Si on applique une pression sur la solution concentrée la quantité d'eau calculer la pression osmotique théorique de l'eau salée utilisée. • tracer ...
 osmolarite.pdf
osmolarite.pdf
exemple : calcul de la pression osmotique due à une solution de. 10 mM de saccharose à 20°C. n/V = 10 mM saccharose en solution : ne se dissocie pas.
 Untitled
Untitled
exemple : calcul de la différence de pression osmotique d'une solution A contenant 10 M de saccharose et d'une solution B contenant 10 M de NaCl.
 Théorie et pratique des mesures de la pression osmotique par
Théorie et pratique des mesures de la pression osmotique par
n'échappe pas à cette étape analytique et la connaissance des solutions posent à propos du calcul de la pression osmotique dont l'importance en.
 Biologie cellulaire. Exercices et méthodes
Biologie cellulaire. Exercices et méthodes
À 0 ºC la pression osmotique d'une solution benzénique de 7
 TD eau et régulation osmotique
TD eau et régulation osmotique
Calculer la molarité d'une solution aqueuse contenant 585 mg de NaCl par litre différence de pression osmotique entre les deux compartiments.
 Solvants solutés et règles de dilution
Solvants solutés et règles de dilution
Reconstitution de solutions à partir d'une poudre. Calculs de doses choix de solvants Isotonie : solutions qui ont la même pression osmotique (=.
 Chapitre 2
Chapitre 2
En comparant le solvant pur avec la solution présente : Exemple : calcul de la différence de pression osmotique d'une solution A contenant 10 mM de.
 a) Donner la définition de la molarité dune solution. b) Calculer la
a) Donner la définition de la molarité dune solution. b) Calculer la
Calculer la pression oncotique « vraie » à partir de l'équation de van't Hoff. réponse : Concentration molaire en albumine = 45/69 000 = 0652 mM
 (Démonstration cours )
(Démonstration cours )
Le compartiment A renferme une solution d'urée à 174 mg/l et l'autre une pure à la température T=37°C. Calculer la pression osmotique.
 VI-Application de la Pression osmotique:
VI-Application de la Pression osmotique:
Soit une membrane perméable au solvant (l'eau) et séparant deux compartiments dont l'un contient de l'eau pure et l'autre un soluté en solution aqueuse.
 [PDF] Théorie et pratique des mesures de la pression osmotique - Agritrop
[PDF] Théorie et pratique des mesures de la pression osmotique - Agritrop
posent à propos du calcul de la pression osmotique dont l'importance en 1 Enoncé L'abaissement du point de congélation d'une solution étendue et non
 Propriétés des solutions aqueuses et pression osmotique
Propriétés des solutions aqueuses et pression osmotique
Calculer la pression osmotique d'une solution de saccharose de concentration 06 mole par litre à la température de 20°C On a c = 06 mol l-1 ; T = 29315 K
 [PDF] osmolaritepdf - e-fisio
[PDF] osmolaritepdf - e-fisio
exemple : calcul de l'osmolarité et de la pression osmotique d'une solution contenant 10 mM d'urée physique de l'osmolarité osmolarité : 10 x 1 x 1 = 10
 [PDF] TD de BIOPYSIQUE - Exercices corrigés - F2School
[PDF] TD de BIOPYSIQUE - Exercices corrigés - F2School
c) Quelle est la pression osmotique si ce travail est développé en 02 s Corrigé 1 l = 10-3 m3 12 h = 43200 s Pour calculer la pression osmotique
 [PDF] Osmose Pression osmotique
[PDF] Osmose Pression osmotique
Osmose Pression osmotique 1 Situation expérimentale Calcul des flux • Membrane imperméable au soluté T = 0 (mais perméable au solvant)
 [PDF] Chapitre 2 - opsuniv-batna2dz
[PDF] Chapitre 2 - opsuniv-batna2dz
La pression osmotique est par définition la pression qu'il faudrait exercer sur une solution pour l'amener à un état d'équilibre (= absence de flux net) avec
 [PDF] Biologie cellulaire Exercices et méthodes - Dunod
[PDF] Biologie cellulaire Exercices et méthodes - Dunod
1) Quelle solution possède la plus grande pression osmotique ? 2) Quelle solution se dilue au passage de l'eau au travers de la membrane ?
 [PDF] Chapitre 3 : Losmose
[PDF] Chapitre 3 : Losmose
*Étudier la Pression oncotique et équilibre de Sterling ainsi que Énergie Pré-requis : L'étudiant est capable de calculer : *La pression osmotique *La
 [PDF] TD eau et régulation osmotique
[PDF] TD eau et régulation osmotique
La membrane séparant A et B est perméable a l'eau mais pas aux ions (membrane semi- perméable) Calculer la pression osmotique de cette solution en kPa (T° =
Comment calculer la pression osmotique de la solution ?
Pour calculer une pression osmotique, la formule de calcul est basée sur : Posmotique = nRT/V, où Posmotique = kPa = atmosphères. La pression osmotique d'une solution diluée obéit à une relation de même forme que la loi des gaz parfaits.Comment calculer la pression osmotique d'une solution de NaCl ?
Pression, tension osmotique. Pression qui détermine le phénomène d'osmose et qui correspond à la différence des pressions exercées de part et d'autre d'une membrane semi-perméable par deux liquides de concentration différente.C'est quoi la pression osmotique en SVT ?
La pression osmotique naît de la séparation par une membrane* semi-perméable de deux compartiments de concentrations différente. L'eau migre du compartiment le moins concentré vers le plus concentré afin d'« équilibrer » le système pour avoir la même force ionique dans les deux compartiments.
QCM Chapitre 1
1. Le camphre pur fond à 179 ºC. Un mélange contenant 5,0 g de camphre et 0,312 g
de caproate de n-décyle (C 20 H 40O 2 ) fond à 171 ºC. Enfin, un mélange contenant
5,0 g de camphre et 0,193 g de cholestérol fond à 175 ºC. Sur la base de ces
informations, on peut affirmer que : a. Les lois colligatives ne s"appliquent pas car nous ne sommes pas en présence de solutions aqueuses diluées. b. La masse molaire du cholestérol est de 309,40 g∙mol -1 c. Si on dissout 0,156 g de cholestérol dans 200 g de benzène, on observera une élévation de la température d"ébullition de 5 ºC. d. À 0 ºC, la pression osmotique d"une solution benzénique de 7,5 g de cholestérol par litre de solution est de 330 mmHg. e. Il manque une donnée pour déterminer la pression de vapeur au-d essus de la solu- tion préparée au point c) à 80,1 ºC. 2. -1 en glucose C 6 H 12 O 6 est séparée par une membrane semi-perméable d'une solution aqueuse d'urée CO(NH 2 2 -1 Aucun des deux solutés ne se dissocie en solution.1) Quelle solution possède la plus grande pression osmotique ?
2) Quelle solution se dilue au passage de l'eau au travers de la membrane ?
3) Sur le compartiment contenant quelle substance faudra-t-il exercer une pression
si on veut empêcher l'eau de passer d'un compartiment à l'autre ? a. 1) solution d"urée - 2) solution de glucose - 3) celui contenant le glucose b. 1) solution d"urée - 2) solution de glucose - 3) celui contenant l"urée c. 1) solution de glucose - 2) solution d"urée - 3) celui contenant l"urée d. 1) solution d"urée - 2) solution d"urée - 3) cel ui contenant l"urée e. 1) solution de glucose - 2) solution de glucose - 3) celui c ontenant le glucose3. On place une solution d'albumine bovine 0,1 % en masse dans un osmomètre muni d'une membrane semi-perméable. Celui-ci est alors plongé dans un bécher
contenant une solution aqueuse de la même protéine 2,0 % en masse. Laquelle des propositions suivantes est correcte ? a. Le liquide va descendre dans l"osmomètre. b. La pression osmotique de la solution aqueuse 2,0 % sera plus grand e. c. L"eau va passer au travers de la membrane semi-perméable de l" osmomètre vers le bécher. d. La concentration en albumine bovine dans le bécher va diminuer. e. Toutes ces propositions sont correctes. 24. À 25
oC, l'iodate d'hydrogène HIO
3 se dissocie à 61 % en solution aqueuse pour donner des ions H et IO 3- . Laquelle des propositions suivantes est correcte ? a. L"abaissement cryoscopique de 100 g de solution aqueuse d"iodate d"hydrogène1,0 mol∙L
-1 est double de celui de 100 g de solution aqueuse de glucose (C 6 H 12 O 61,0 mol∙L
-1 b. La température d"ébullition normale d"une solution aqueus e d"iodate d"hydrogène est inférieure à 100 ºC. c. La pression de vapeur d"une solution aqueuse d"iodate d"hydr ogène est supérieureà celle de l"eau pure.
d. Une solution aqueuse d"iodate d"hydrogène congèle au-dess us de 0 ºC, sous 1 atm. e. Aucune de ces propositions n"est correcte.5. La sulfanilamide (C
6 H 8 N 2 O 2 S) est un composé non volatil utilisé pour la première fois durant la seconde guerre mondiale par les Alliés pour ses propriétés antibactériennes. Une solution, obtenue en dissolvant 1,50 g de sulfanilamide dans 15,0 g d'acétone (C 3 H 6 -3 . En admettant que la solution obtenue soit une solution idéale, laquelle des propositions suivantes est fausse ? a. À 56,2 ºC, la pression de vapeur de la solution vaut 0,967 a tm. b. À 56,2 ºC, la tension de vapeur au-dessus de la solution a la même valeur numérique
que la fraction molaire du solvant. c. La température d"ébullition de la solution vaut 57,2 º C. d. La température de congélation de la solution vaut -93,9 º C. e. À 0 ºC, la pression osmotique de la solution vaut 9,47∙10 5 Pa. © Dunod. Toute reproduction non autorisée est un délit. 31. d. Tout d"abord, les lois colligatives s"appliquent à toutes solu
tions constituées d"un solvant et d"un soluté non volatilLa proposition a) est fausse.
Grâce à l"abaissement de la température de congélation ré sultant de l"ajout de caproate de -décyle (C 20 H 40O 2 , composé non dissociable = 1) dans le camphre ( cong = 179 ºC - 171 ºC = 8 ºC), calculons la constante cryoscopique de ce solvant : T cong =iK cryos m C 20 H 40
O 2 =iK cryos n C 20 H 40
O 2 m camphre T cong iK cryos m C 20 H 40
O 2 M C 20 H 40
O 2 m camphre K cryos T cong M C 20 H 40
O 2 m camphre im C 20 H 40
O 2 =8 °C312,60gmol 1 510
3 kg
10,312g
K cryos40,08 Ckgmol
1 Maintenant, avec cette valeur et l"abaissement de la température d e congélation : cong = 179 ºC - 175 ºC = 4 ºC) de la solution de cholestérol dans le camphre, nous pouvons calculer la masse molaire du cholestérol (composé non dissociable = 1) : T cong =iK cryos m cholestérol =iK cryos m cholestérol M cholestérol m camphre M cholestérol iK cryos m cholestérol T cong m camphre M cholestérol =140,08 °Ckgmol 10,193g
4 °C510
3 kg =386,77gmol 1La proposition b) est fausse.
Si on dissout du cholestérol dans du benzène (propriétés ph ysiques, voir table 4 des tables de constantes), la température d"ébullition de la solution proposée au point c) vaudra :
T éb =iK éb m cholestérol =iK éb m cholestérol M cholestérol m benzène T éb =1×2,53 °Ckgmol 1×0,156g
386,77gmol
1×20010
3 kg =5,110 3 °CLa proposition c) est fausse.
La pression osmotique de la solution proposée au point d) vaudra, qu ant à elle : =iC cholestérolRT=iConcentrationmassique
cholestérol M cholestérol RT =17,5gL 1386,77gmol
10,082Latmmol
1 K 1273,15K
=0,434atm=330,1mmHg La proposition d) est correcte. La pression de vapeur au-dessus de la solution préparée au point c ) est donnée par la loi de Raoult : solution solvant solvant © Dunod. Toute reproduction non autorisée est un délit. 4P º
solvantest la pression de vapeur du benzène à 80,1 ºC (c"est-à-dire sa température d"ébullition
normale , voir table 4 des tables de constantes) P benzène = 1 atm x solvant =x benzène n benzène n benzène +n cholestérol Grâce aux masses de benzène et de cholestérol, nous pouvons cal culer les quantités de matière n ) de chacun et ensuite la fraction molaire en benzène. x benzène =m benzène M benzène m benzène M benzène +m cholestérol M cholestérolLa proposition e) est fausse.
2. La solution aqueuse 0,020 mol . L
-1 en glucose et la solution aqueuse d"urée 0,050 mol . L -1 sont toutes deux composées d"un soluté non dissociable i = 1. (1) La pression osmotique s"exprime comme suit : = i . C . R . T.Comme le facteur
i , la constante Rquotesdbs_dbs12.pdfusesText_18[PDF] calcul pression osmotique nacl
[PDF] osmose pomme de terre
[PDF] structure en coque architecture
[PDF] structure ? ossature
[PDF] construction de maison ? ossature de bois livre
[PDF] construction de maison ? ossature de bois
[PDF] maison ossature bois canada
[PDF] portée des solives de plancher
[PDF] coupe de mur maison ossature bois
[PDF] assemblage ossature bois
[PDF] ostinato mélodique exemple
[PDF] chanson connue avec ostinato
[PDF] ostinato musique classique
[PDF] culture en placard pdf
