 Propriétés physico- chimiques des oses
Propriétés physico- chimiques des oses
II.Propriétées chimiques : II.1) Stabilité chimique : a)En milieu acide : En milieu acide dilué les oses sont stables
![[PDF] Propriétés physico-chimiques des oses [PDF] Propriétés physico-chimiques des oses](https://pdfprof.com/PDFV2/GoBo/Images32/18_25674_3_.png) [PDF] Propriétés physico-chimiques des oses
[PDF] Propriétés physico-chimiques des oses
B-PROPRIETES CHIMIQUES: Une partie importante de leur propriété chimique est celle des fonctions carbonylés et des alcools. I/STABILISATION CHIMIQUE DES OSES.
 Structure et propriétés des glucides
Structure et propriétés des glucides
Aug 19 2020 b- Propriétés chimiques des oses b-1 – Propriétés dues à la fonction ... oses
 Propriétés physico- chimiques des oses
Propriétés physico- chimiques des oses
I.Propriétées physiques des oses : 1) solubilité : Riches en groupement hydroxyle (OH) propriétés polaires capables de multiples liaisons hydrogènes :.
 Propriétés physico- chimiques des oses
Propriétés physico- chimiques des oses
II.Propriétées chimiques : II.1) Stabilité chimique : a)En milieu acide : En milieu acide dilué les oses sont stables
 Diapositive 1
Diapositive 1
➢Principales propriétés des oses. ➢Propriétés Deux isomères optiques possèdent les mêmes propriétés chimiques et beaucoup de propriétés physiques (point.
 Structure des oses
Structure des oses
Le D-glycéraldéhyde α= +14 °. Le L-glycéraldéhyde α= -14°. Ces deux composés ont des propriétés physiques et chimiques identiques à l'exception de leur action.
 BIOCHIMIE STRUCTURALE GLUCIDES
BIOCHIMIE STRUCTURALE GLUCIDES
PROPRIETES CHIMIQUES. Les propriétés chimiques des oses sont caractéristiques des groupements hydroxyles et des groupements carbonyles. 1. Propriétés dues à
 Propriétés physico-chimiques des oses
Propriétés physico-chimiques des oses
- Citer les propriétés chimiques des oses dues à la présence des fonctions Propriétés physico-chimiques des oses. Année universitaire : 2022/2023. Dr BENSAAD.
 Les glucides
Les glucides
Deux énantiomères ont les mêmes propriétés chimiques et physiques mais la présence de un ou de plusieurs C* confère aux glycéraldéhydes (et aux autres oses)
 LES GLUCIDES
LES GLUCIDES
PROPRIETES DES OSES. I . PROPRIETES PHYSIQUES DES OSES. Les oses sont des molécules très riches en groupement hydroxyle ce qui leur confère des propriétés
 Propriétés physico- chimiques des oses
Propriétés physico- chimiques des oses
Propriétés physico- chimiques des oses. Dr. BENSAAD.S. Année universitaire : 2021/2022. Objectifs du cours : - Citer les propriétés physiques des oses.
 Propriétés physico-chimiques des oses
Propriétés physico-chimiques des oses
A-PROPRIETES PHYSIQUES: 1- Solubilité et cristallisation. *Les oses sont solubles dans l'eau car présentent plusieurs groupes OH.
 BIOCHIMIE STRUCTURALE & METABOLIQUE GLUCIDES
BIOCHIMIE STRUCTURALE & METABOLIQUE GLUCIDES
I.3 Propriétés optiques. I.4 Phénomène de mutarotation. II. PROPRIETES CHIMIQUES DES OSES. II.1 Stabilité chimique des oses. II.2 Propriétés dues à la
 I. Les Glucides
I. Les Glucides
Les oses : appelés aussi sucres simples ou monosaccharides ont comme formule Les propriétés chimiques des oses sont caractéristiques des groupements ...
 Les glucides COURS DE BIOCHIMIE
Les glucides COURS DE BIOCHIMIE
Propriétés physicochimiques des oses … Propriétés chimiques des oses… ... Vu que les oses portent la même formule chimique la distinction entre les ...
 COURS DE BIOCHIMIE STRUCTURALE
COURS DE BIOCHIMIE STRUCTURALE
Enfin les propriétés des glucides et des lipides font chacun l'objet d'un chapitre spécifique. Page 7. Chapitre 1 : les liaisons chimiques. La liaison chimique
 Les Glucides
Les Glucides
hétéroside : son hydrolyse libère des oses et des composés non glucidiques Les propriétés chimiques et physiques des énantiomères sont en général ...
 LES GLUCIDES
LES GLUCIDES
Les oses qui possèdent une fonction aldéhyde sont appelés des aldoses et ceux Les 2 énantiomères ont des propriétés physiques et chimiques identiques ...
 Biochimie structurale
Biochimie structurale
propriété physique : le pouvoir rotatoire. La propriété de pouvoir rotatoire des oses permet le dosage ... Filiation chimique des oses selon Fischer.
 [PDF] Propriétés physico-chimiques des oses
[PDF] Propriétés physico-chimiques des oses
A-PROPRIETES PHYSIQUES: 1- Solubilité et cristallisation *Les oses sont solubles dans l'eau car présentent plusieurs groupes OH
 [PDF] Propriétés physicochimiques des oses
[PDF] Propriétés physicochimiques des oses
propriétés chimiques dues à la présence des fonctions alcools : 1- Formation d'esters: • L'estérification est une réaction entre un acide et un alcool •
 [PDF] BIOCHIMIE STRUCTURALE & METABOLIQUE GLUCIDES
[PDF] BIOCHIMIE STRUCTURALE & METABOLIQUE GLUCIDES
Leurs propriétés chimiques sont caractéristiques des groupements hydroxyles alcooliques et des groupements carbonyles II 1 Stabilité chimique des oses En
 [PDF] LES GLUCIDES
[PDF] LES GLUCIDES
1 BTS BIAC 2ème année LES GLUCIDES Sous chapitre 1 STRUCTURE DES OSES Les 2 énantiomères ont des propriétés physiques et chimiques identiques
 [PDF] Structure et propriétés des glucides
[PDF] Structure et propriétés des glucides
19 août 2020 · b- Propriétés chimiques des oses b-1 – Propriétés dues à la fonction carbonyle b 1 1– Réduction des oses : obtention d'alditols (ositols)
 Propriétés des oses - FSM
Propriétés des oses - FSM
Les propriétés physiques et chimiques des oses reposent sur trois Bases structurales (1D - 1) qui sont : la polarité du carbonyle;; l'acidité de l'hydrogène
 [PDF] I Les Glucides
[PDF] I Les Glucides
2 2 1 Holosides : leur hydrolyse ne libère que des oses Les propriétés chimiques des oses sont caractéristiques des groupements hydroxyles alcooliques
 [PDF] • COURS DES GLUCIDES - Faculté des Sciences de Rabat
[PDF] • COURS DES GLUCIDES - Faculté des Sciences de Rabat
I - Les oses : (Monosaccharides) : 1- Plan de base des oses 2- Appellation des oses 3- Dissimétrie moléculaire-pouvoir rotatoire 4- Diversité des oses
 [PDF] 1 biochimie structurale 13- les glucides
[PDF] 1 biochimie structurale 13- les glucides
Les isomères de fonction possèdent des groupes fonctionnels différents donc des propriétés physiques et chimiques différentes Les oses les plus simples
Quelles sont les propriétés des oses ?
Les oses sont des molécules très riches en groupement hydroxyle ce qui leur confère des propriétés polaires capables de multiples liaisons hydrogène : - avec l'eau : ce sont des molécules très hydrosolubles (et solubilité variable dans les solvants organiques), - avec d'autres biomolécules comme les protéines.Quelles sont les propriétés chimiques du glucose ?
Propriétés chimiques
La formule brute du glucose est C6H1206, il s'agit d'un ose et plus précisément d'un aldohexose très soluble dans l'eau. En effet, il contient une fonction aldéhyde et six atomes de carbone. La masse molaire du glucose est de 180,1559 g/mol.Comment reconnaître un ose ?
Un ose (ou monosaccharide) est un monomère de glucide. Les oses poss?nt au moins trois atomes de carbone : ce sont des polyhydroxyaldéhydes ou des polyhydroxycétones. Les monosaccharides ne sont pas hydrolysables, mais les polysaccharides sont très solubles dans l'eau et poss?nt généralement un pouvoir sucrant.- Les oses, monoses, monosaccharides ou encore sucres simples, sont des molécules constituées de seulement trois types d'atomes (C, H et O). Ils poss?nt un squelette carboné, généralement linéaire, comportant de 3 à 6 carbones pour les oses les plus représentatifs, quelquefois 7, voire 8 carbones.
I - Les oses : (Monosaccharides) :
1- Plan de base des oses
2- Appellation des oses
3- Dissimétrie moléculaire-pouvoir rotatoire
4- Diversité des oses
5- Filiation des oses
6- Formule complète et simplifiée
7- Filiation des D-aldoses
8- Filiation des D-cétoses
9- Structure cyclique des oses
10- Conformation spatiale des oses
11- Propriété des oses
12- Oses d'intérêt biologique
II- Les oligosides : (oligosaccharides)
1 - Liaison O-glycosidique
2 - Diversité d'enchaînements
3 - Conventions d'écriture
4 - Analyse structurale des oligosaccharides
5 - Etudes de quelques oligosides
IV- Polysaccharides
A- les homopolysaccharides:
1- Polysaccharides de réserve
2- Polysaccharides de structure
B- les héteropolysaccharides:
C- Exemples de polysaccharides
V- Hétérosides
Les GlucidesI- Introduction :
Ce sont les molécules les plus abondantes à la surface du globe. La majeure partie des glucides de la planète est produite par la photosynthèse. Les glucides peuvent être oxydés pour produire de l'énergie dans les processus métaboliques. Chez les animaux et les plantes, des polymères glucidiques (glycogène, amidon) servent de réservoir energétique.D'autres polymères (cellulose, chitine...) sont aussi trouvés dans les parois cellulaires (rôle
de protection)Des dérivés de glucides se retrouvent dans un grand nombre de molécules biologiques
comme les acides nucléiques, ADN et ARN. Les sucres sont utilisés dans l'industrie alimentaire et les biotechnologies Les sucres interviennent dans les interactions entre les cellules d'un même organisme Les sucres sont utilisées par des microorganismes pour infecter les organismes hôtesGlucides
oses osides(Monosaccharides)Unités simples non hydrolysables +dérivésd'oses = (CH 2O)n * n-1 fonctions alcools * 1 fonction carbonyle * n atomes de carbone1 fonction aldéhyde sur C1Aldoses1 fonction cétone sur C2Cetoses
Holosides
Héterosideshydrolyse
hydrolyse1 ou plusieurs
polyosides (polysaccharides)X unités > 10
X= 2 (diholoside)
X= 3 (tiholoside)
X= 4 (tetraholoside)
Etc.....
Homopolyosides
(1 seul type d'oses)Hétéropolyosides
(Pls types d'oses)Fraction glucidique
Fraction non glucidique
= aglyconeO-Héterosides
N-Héterosides
S-Héterosides
Classification des Glucides
II- Les oses :
1 - Plan de base des osesLes oses, monosaccharidesou encore sucres simples, possèdent un squelette
carboné linéaire, comportant 3 à 6 C(quelquefois 7, voire 8 carbones). On distingue deux familles d'oses, définies par les deux fonctions du carbonyle Un aldéhyde caractérise un aldose et une cétone caractérise un cétose. CHO CH 2OHC[H OH]
nALDOSECH
2OH CH2OHC[H OH]
n COCETOSEFonction carbonyle
Alcool primaire
Alcool primaireAlcool secondaire
Les oses peuvent être classés de deux manières:+ par le nombre de carbones de leur squelette (3 : trioses, 4 : tétroses, 5 pentoses, 6
hexoses etc...) + par la nature de la fonction du carbonyle (aldéhyde = aldoses, cétone = cétoses). Les deux classifications peuvent être combinées: * aldotétrose (aldose à 4 carbones) * cétopentose (cétose à 5 carbones)2- Appellation des oses
3- Dissimétrie moléculaire-pouvoir rotatoire
a - Chiralité : Le carbone 2 est lié à quatre substituants différents: C'est un carbone asymétrique.(C*) C'est un centre de chiralité= aucun élément de symétrie. La molécule est dite chirale(non superposable à sa propre image dans un miroir).Elle présente une activité optique: une solution de glycéraldéhyde fait "tourner" le plan de
polarisation de lumière qui la traverse.Exemple du glycéraldéhyde
Miroire
1 2 312 3 1 2 31
2 3 b - Pouvoir rotatoire spécifique, Loi de Biot :
Source
lumière OeilRotation du plan
de polarisationPolarisation de la lumièreSubstance
activeLumière
sortanteLumière
incidenteToute molécule chirale possède la particularité d'être optiquement active ou douée de pouvoir rotatoire :
Traversée par un faisceau de lumière polarisée plan, elle provoque la rotation du plan de polarisation de la lumière.
L'angle αde rotation est donné par la loi de Biot : α α α α = [αααα] l C
[αααα] est le pouvoir rotatoire spécifique de la substance étudiée, l est la longueur de la cuve polarimétrique
et C la concentration de la solution étudiée.* Lorsque la rotation est vers la droite le composéest dit dextrogyre et son pouvoir rotatoire est positif
* Lorsque la rotation est vers la gauche le composéest dit levogyre et son pouvoir rotatoire est négatif
NB :Le pouvoir rotatoire d'un mélange de substances est la somme des pouvoirs rotatoires de chaque substance.
ααα= ΣΣΣΣ[ααααi l Ci] c - Convention de FISCHER- Projection de FISCHER CH 2OHC HOHCHO1
2 3 CHO CH 2OHCH OH1
2 3 CHO CH 2OHCHO H1
2 3Miroire
Aldotriose (molécule chirale)
C2 est asymétriquec.1- Cas du glycéraldéhyde Les carbones C1, C2 et C3 sont dans le plan vertical et l'angle C1 C2 C3 a le sommet pointé vers l'observateurPerspective
Appartenance à la série D ou L
L'appartenance à la série D ou L pour un ose à n C est déterminé par la configuration du Cn-1.
NB:pour un ose donné, les formes D et L sont appelées énantiomères Ils ont les même propriétés chimiques mais le pouvoir rotatoire est différent. CH 2OHC HOHCHO1
2 3 CHO CH 2OHCH OH1
2 3D-glycéraldéhyde L- glycéraldéhyde
c.2 - L'érythroseLes carbones C2 et C3 sont
asymétriques -> 2 centres de chiralitéCHOCH 2OH CH OHD- ErythroseCH OH1
2 3 4Aldotetrose (molécule chirale)
C2 et C3 sont asymétriques
CHO CH 2OH CHOHL-ErythroseC
HOH 1 2 3 4 c.3- Cas de la dihydroxyacétone CH 2OH C O 1 2CH 2OH 3Cétotriose (molécule
achiraleAucun carbone asymétrique
La dihydroxyacétone n'a pas d'activité optiquePas de pouvoir rotatoire
donc son image dans un miroir est elle mêmeCétotetriose (molécule chirale)
C3 carbone asymétrique
CH 2OH C O 1 2CH OH3
CHOH3 CH 2OH C O 1 2 CH 2OH 4 CH 2OH 4Le carbone C3 est asymétrique
-> 1 centre de chiralitéc.4- L'érythrulose Les deux molécules ont des activités optiques contraires, déviant le plan de polarisation de la lumière d'une même valeur d'angle, mais dans les deux directions opposées4- Diversité des oses
a - Configuration absolueTout carbone asymétrique (C*) est définit par sa configuration absoluequi décrit l'arrangement
dans l'espacedes atomes ou groupes fonctionnels auxquels il est lié (ses substituants). Pour le glycéraldéhyde, deux configurations absolues sont possibles (1C*). On adeux molécules différentes de glycéraldéhyde non superposables l'une à l'autre. Ce sont deux formes stéréoisomèresdu glycéraldéhyde cette stéréoisomérie est appelée énantiomérie. CH 2OHC HOHCHO1
2 3 CHO CH 2OHCH OH1
2 3D-glycéraldéhyde L- glycéraldéhyde
La diversité des oses provient des différentes configurations absolues des carbones asymétriques
NB : Un mélange équimoléculaire des deux énantiomères d'une même molécule est appelé :
mélange racémique (n'a pas d'activité optique). * Chaque carbone asymétrique peut exister sous deux états structurauxdistincts (deux configurations absolues), * Le nombre ndes structures moléculaires possibles avec x carbones asymétriques suit une progression géométrique telle que : n = 2 x* Ces structures moléculaires sont appelées stéréoisomères.La configuration absolue, Rou S, de chacun des
carbones asymétriques est déterminée selon la convention de Cahn, Ingold et Prelog. (Cf. cours chimie organique)Dans cette nomenclature, le D-glycéraldéhyde est le 2R-triose, et le L-glycéraldéhyde est le 2S-
triose. Le D-(+)-glucose est le 2R,3S,4R,5R-hexose.La nomenclature R/S est très précise mais peu parlante, surtout lorsqu'on en arrive à un
nombre élevé de carbones. C'est pourquoi elle est assez peu utilisée en biochimie. CH 2OHC HOHCHO1
2 3 CHO CH 2OHCH OH1
2 3D-glycéraldéhyde L- glycéraldéhyde
a.1 - Nomenclature R/SCahnsim.swf
La grande majorité des oses naturels appartient à la série D de Fischer, mais des oses de série L
existent également.Tout aldose dérive théoriquement d'un glycéraldéhyde par une ou plusieurs étapes d'insertion d'un
chaînon asymétrique H-C-OH, selon le principe dit de la filiation des oses(voirSynthèse de Kiliani-
Fischer
Attention !
La série D ou L de Fischer ne préjuge en rien du caractère dextrogyre (+) ou lévogyre (-)
de la molécule. Ainsi, le D-(+)-glucose est bien dextrogyre (= +52), mais le D-(-)-
fructose, lui, est fortement lévogyre (= -92,4). C'est d'ailleurs de là que leur viennent
leurs anciens noms de dextrose et de lévulose, respectivement.L'activité optique d'une molécule est la somme algébriquedes activités optiques des C*qui la composent.a.2 - Filiation et série de Fischer
* L'ose appartient à la série Dde Fischer si sur le carbone n-1 le OH est à droite sur la projection
de Fischer.* L'ose appartient à la série Lsi sur le carbone n-1OH est à gauche sur la projection de Fischer.
la série de Fischer est indiquée par un D-ou un L-placé devant le nom de l'ose.Deux carbones asymétriques adjacents ayant la même configuration absolue, R ou S,forment un couple érythro, tandis qu'ils
forment un couple thréosi leurs configurations absolues sont opposées.Il existe un nom communpour chaque
combinaison de configurations.Ex : le riboseest un aldopentose dont les trois carbones asymétriques ont la même configuration absolue: ils sont érythro deux à deux. b - Configuration relative des oses La configuration relative d'une molécule décrit globalement les configurations absolues des C*. Elle permet d'attribuer un nom commun à la molécule. CHO CH 2OHCH OHCH OH1
2 3 4 CHO CH 2OHCH OHC HHO
1 2 3 4D-érythrose D-thréose
CHO CH 2OH1CH OH3CH OH4
5D-Ribose
CH OH2
CHO CH 2OH1CHOH3CHOH4
5L-Ribose
CHOH2Epimérie:
Deux épimèressont deux isomères ne différant que par la configuration absolue d'un seul C*.
Le D-glucose et le
D-galactose sont épimères
au niveau du carbone 4.c - Cas d'isomérie CHO CH 2OH1CH OH4
6CH OH2CH OH5CHOH3
CHO CH 2OH6CH OH2CH OH5CHOH3CHOH4
D-glucose D-galactose
1 Enantiomérie :Deux isomères différant par la configuration absolue de tous leurs carbones asymétriques sont images l'un de l'autre dans un miroir sont appelés énantiomères. CHO CH 2OH1CH OH4
6CH OH2CH OH5CHOH3
D-glucose
CHO CH 2OH1C HOH4
6C HOH2C HOH5CHOH3
L-glucose
Diastéréoisomèrie:La différence porte sur un nombre de C* compris entre 1 et leur nombre total x de C*.
Diastéréoisomères
Le D-glucose et le D-gulose sont
diastéréoisomères car ils diffèrent par les configurations de 2 sur4 de leurs C*.
CHO CH 2OH1CH OH4
6CH OH2CH OH5CHOH3
D-glucose
CHO CH 2OH1CH OH4
6CH OH2CH OH5CHOH3D-gulose
5 - Filiation des oses
a- Synthèse cyanhydrique de Kiliani Ficher (sucre à n CSucre à n+1C) C CH 2OHCH OHCH OH1
2 3 4 HO NHCOse à 4 carbones
AldotetroseCCH
2OHCH OHCH OH3
4 5 NCH OH21
C CH 2OHCH OHCH OH3
4 5 N CHO H21
2 cyanhydrines épimères (5C)
Etape 1
50% 50%
Etape 2
C CH 2OHCH OHCH OH3
4 5 NCH OH21
H2 C CH 2OHCH OHCH OH3
4 5CH OH21
NH H H2O NH 3 C CH 2OHCH OHCH OH3
4 5CH OH21
O H cyanhydrine imineT°, P
Synthèse cyanhydrique de Kiliani Ficher
Ose à 5 carbones
Aldopentose
b- Dégradation de WÖHL-ZEMPLEN (sucre à n CSucre à n-1C) C CH 2OHCH OHCH OH
HOOse à 4 carbones
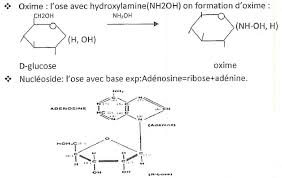
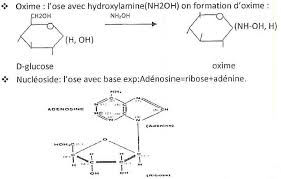
AldotetroseH2N
OH+Hydroxylamine
Oxime OH CH 2OHCH OHCH OHCN
quotesdbs_dbs12.pdfusesText_18[PDF] maps belgique
[PDF] métabolisme du glucose pdf
[PDF] bilan glycolyse
[PDF] glycolyse schéma
[PDF] glucose oxydé
[PDF] oxydation glucose en acide gluconique
[PDF] mdm android gratuit
[PDF] http scholar google fr
[PDF] sucre et electrons
[PDF] telecharger google scholar
[PDF] google scholar traduction
[PDF] google scholar citations
[PDF] scholar traduction
[PDF] valeur cible excel
