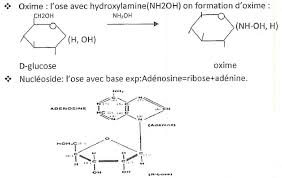
 Propriétés physico- chimiques des oses
Propriétés physico- chimiques des oses
II.Propriétées chimiques : II.1) Stabilité chimique : a)En milieu acide : En milieu acide dilué les oses sont stables
![[PDF] Propriétés physico-chimiques des oses [PDF] Propriétés physico-chimiques des oses](https://pdfprof.com/PDFV2/GoBo/Images32/18_25674_3_.png) [PDF] Propriétés physico-chimiques des oses
[PDF] Propriétés physico-chimiques des oses
B-PROPRIETES CHIMIQUES: Une partie importante de leur propriété chimique est celle des fonctions carbonylés et des alcools. I/STABILISATION CHIMIQUE DES OSES.
 Structure et propriétés des glucides
Structure et propriétés des glucides
Aug 19 2020 b- Propriétés chimiques des oses b-1 – Propriétés dues à la fonction ... oses
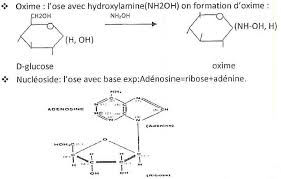 Propriétés physico- chimiques des oses
Propriétés physico- chimiques des oses
I.Propriétées physiques des oses : 1) solubilité : Riches en groupement hydroxyle (OH) propriétés polaires capables de multiples liaisons hydrogènes :.
 Propriétés physico- chimiques des oses
Propriétés physico- chimiques des oses
II.Propriétées chimiques : II.1) Stabilité chimique : a)En milieu acide : En milieu acide dilué les oses sont stables
 Diapositive 1
Diapositive 1
➢Principales propriétés des oses. ➢Propriétés Deux isomères optiques possèdent les mêmes propriétés chimiques et beaucoup de propriétés physiques (point.
 Structure des oses
Structure des oses
Le D-glycéraldéhyde α= +14 °. Le L-glycéraldéhyde α= -14°. Ces deux composés ont des propriétés physiques et chimiques identiques à l'exception de leur action.
 BIOCHIMIE STRUCTURALE GLUCIDES
BIOCHIMIE STRUCTURALE GLUCIDES
PROPRIETES CHIMIQUES. Les propriétés chimiques des oses sont caractéristiques des groupements hydroxyles et des groupements carbonyles. 1. Propriétés dues à
 Propriétés physico-chimiques des oses
Propriétés physico-chimiques des oses
- Citer les propriétés chimiques des oses dues à la présence des fonctions Propriétés physico-chimiques des oses. Année universitaire : 2022/2023. Dr BENSAAD.
 Les glucides
Les glucides
Deux énantiomères ont les mêmes propriétés chimiques et physiques mais la présence de un ou de plusieurs C* confère aux glycéraldéhydes (et aux autres oses)
 LES GLUCIDES
LES GLUCIDES
PROPRIETES DES OSES. I . PROPRIETES PHYSIQUES DES OSES. Les oses sont des molécules très riches en groupement hydroxyle ce qui leur confère des propriétés
 Propriétés physico- chimiques des oses
Propriétés physico- chimiques des oses
Propriétés physico- chimiques des oses. Dr. BENSAAD.S. Année universitaire : 2021/2022. Objectifs du cours : - Citer les propriétés physiques des oses.
 Propriétés physico-chimiques des oses
Propriétés physico-chimiques des oses
A-PROPRIETES PHYSIQUES: 1- Solubilité et cristallisation. *Les oses sont solubles dans l'eau car présentent plusieurs groupes OH.
 BIOCHIMIE STRUCTURALE & METABOLIQUE GLUCIDES
BIOCHIMIE STRUCTURALE & METABOLIQUE GLUCIDES
I.3 Propriétés optiques. I.4 Phénomène de mutarotation. II. PROPRIETES CHIMIQUES DES OSES. II.1 Stabilité chimique des oses. II.2 Propriétés dues à la
 I. Les Glucides
I. Les Glucides
Les oses : appelés aussi sucres simples ou monosaccharides ont comme formule Les propriétés chimiques des oses sont caractéristiques des groupements ...
 Les glucides COURS DE BIOCHIMIE
Les glucides COURS DE BIOCHIMIE
Propriétés physicochimiques des oses … Propriétés chimiques des oses… ... Vu que les oses portent la même formule chimique la distinction entre les ...
 COURS DE BIOCHIMIE STRUCTURALE
COURS DE BIOCHIMIE STRUCTURALE
Enfin les propriétés des glucides et des lipides font chacun l'objet d'un chapitre spécifique. Page 7. Chapitre 1 : les liaisons chimiques. La liaison chimique
 Les Glucides
Les Glucides
hétéroside : son hydrolyse libère des oses et des composés non glucidiques Les propriétés chimiques et physiques des énantiomères sont en général ...
 LES GLUCIDES
LES GLUCIDES
Les oses qui possèdent une fonction aldéhyde sont appelés des aldoses et ceux Les 2 énantiomères ont des propriétés physiques et chimiques identiques ...
 Biochimie structurale
Biochimie structurale
propriété physique : le pouvoir rotatoire. La propriété de pouvoir rotatoire des oses permet le dosage ... Filiation chimique des oses selon Fischer.
 [PDF] Propriétés physico-chimiques des oses
[PDF] Propriétés physico-chimiques des oses
A-PROPRIETES PHYSIQUES: 1- Solubilité et cristallisation *Les oses sont solubles dans l'eau car présentent plusieurs groupes OH
 [PDF] Propriétés physicochimiques des oses
[PDF] Propriétés physicochimiques des oses
propriétés chimiques dues à la présence des fonctions alcools : 1- Formation d'esters: • L'estérification est une réaction entre un acide et un alcool •
 [PDF] BIOCHIMIE STRUCTURALE & METABOLIQUE GLUCIDES
[PDF] BIOCHIMIE STRUCTURALE & METABOLIQUE GLUCIDES
Leurs propriétés chimiques sont caractéristiques des groupements hydroxyles alcooliques et des groupements carbonyles II 1 Stabilité chimique des oses En
 [PDF] LES GLUCIDES
[PDF] LES GLUCIDES
1 BTS BIAC 2ème année LES GLUCIDES Sous chapitre 1 STRUCTURE DES OSES Les 2 énantiomères ont des propriétés physiques et chimiques identiques
 [PDF] Structure et propriétés des glucides
[PDF] Structure et propriétés des glucides
19 août 2020 · b- Propriétés chimiques des oses b-1 – Propriétés dues à la fonction carbonyle b 1 1– Réduction des oses : obtention d'alditols (ositols)
 Propriétés des oses - FSM
Propriétés des oses - FSM
Les propriétés physiques et chimiques des oses reposent sur trois Bases structurales (1D - 1) qui sont : la polarité du carbonyle;; l'acidité de l'hydrogène
 [PDF] I Les Glucides
[PDF] I Les Glucides
2 2 1 Holosides : leur hydrolyse ne libère que des oses Les propriétés chimiques des oses sont caractéristiques des groupements hydroxyles alcooliques
 [PDF] • COURS DES GLUCIDES - Faculté des Sciences de Rabat
[PDF] • COURS DES GLUCIDES - Faculté des Sciences de Rabat
I - Les oses : (Monosaccharides) : 1- Plan de base des oses 2- Appellation des oses 3- Dissimétrie moléculaire-pouvoir rotatoire 4- Diversité des oses
 [PDF] 1 biochimie structurale 13- les glucides
[PDF] 1 biochimie structurale 13- les glucides
Les isomères de fonction possèdent des groupes fonctionnels différents donc des propriétés physiques et chimiques différentes Les oses les plus simples
Quelles sont les propriétés des oses ?
Les oses sont des molécules très riches en groupement hydroxyle ce qui leur confère des propriétés polaires capables de multiples liaisons hydrogène : - avec l'eau : ce sont des molécules très hydrosolubles (et solubilité variable dans les solvants organiques), - avec d'autres biomolécules comme les protéines.Quelles sont les propriétés chimiques du glucose ?
Propriétés chimiques
La formule brute du glucose est C6H1206, il s'agit d'un ose et plus précisément d'un aldohexose très soluble dans l'eau. En effet, il contient une fonction aldéhyde et six atomes de carbone. La masse molaire du glucose est de 180,1559 g/mol.Comment reconnaître un ose ?
Un ose (ou monosaccharide) est un monomère de glucide. Les oses poss?nt au moins trois atomes de carbone : ce sont des polyhydroxyaldéhydes ou des polyhydroxycétones. Les monosaccharides ne sont pas hydrolysables, mais les polysaccharides sont très solubles dans l'eau et poss?nt généralement un pouvoir sucrant.- Les oses, monoses, monosaccharides ou encore sucres simples, sont des molécules constituées de seulement trois types d'atomes (C, H et O). Ils poss?nt un squelette carboné, généralement linéaire, comportant de 3 à 6 carbones pour les oses les plus représentatifs, quelquefois 7, voire 8 carbones.
1. BIOCHIMIE STRUCTURALE
1.3- LES GLUCIDES
Groupe de composés aux fonctions très importantes :• Rôle énergétique : glucose (forme d'énergie di rectement utilisa ble par les cellules), amidon
(forme de stockage du glucose chez les végétaux), glycogène (forme de stockage du glucose chez les
animaux)...• Rôle structural : cellulose (constituant principal de la paroi des cellules végétales, polymère de
glucose), chitine (polymère de N-acétylglucosamine, carapace des arthropodes et paroi des mycètes)...
• Signau x de reconnaissanc e et de commu nication entre les cellules : glycoproté ines membranaires (exemple des antigènes des groupes sanguins A, B, O).1. Composition élémentaire
C, H, O
2. Fonctions chimiques
Groupe carbonyle : fonctions aldéhyde ou cétoneGroupe hydroxyle : fonction alcool
3. Classification des glucides
Également appelés monosaccharides ou sucres simplesNon hydrolysables
Molécules comportant de 3 à 7 atomes de carboneFormule brute : C
n H 2n O n : C n (H 2 O) n Cette formule brute explique le terme utilisé en anglais d'hydrate de carbone.Polyol qui porte au moins 2 fonctions alcools dont l'une au moins est une fonction alcool primaire, et une
groupement carbonyle réductrice, soit : • aldéhyde (-CHO) dans ce cas l'ose est un aldose. • cétone (>C=O) dans ce cas l'ose est un cétose. L'ose le plus répandu est un aldohexose en C6 : le glucose.Formule brute : C
6 H 12 O 6Glucides Non hydrolysables = oses = molécules de base Hydrolysables = osides Condensation d'un ou de plusieurs oses = holosides Condensation d'oses et de consti tuants non glucidiques = hétérosides
Cours biochimie BTS_ABM1 2019-2020 C. Larcher 1.3.1- Oses - Page 2 / 18 -1.3.1- LES OSES
1. Formule développée et isomérie ............................................................................................................... 3
1.1. Isomères de constitution (de fonction) ......................................................................................... 3
1.2. Stéréoisomères ............................................................................................................................. 3
1.2.1. Nombre de stéréoisomères ............................................................................................... 3
1.2.2. Représentation de Fischer ................................................................................................ 3
1.2.3. Diversité des stéréoisomères ............................................................................................ 4
1.2.4. Pouvoir rotatoire .............................................................................................................. 5
2. Structures cyclisées ................................................................................................................................... 6
2.1. Mise en évidence de l'existence de la structure cyclisée du glucose ........................................... 6
2.1.1. Réaction au réactif de Schiff ............................................................................................ 6
2.1.2. Réaction d'hémiacétalisation en présence d'un alcool .................................................... 6
2.1.3. Explication possible aux deux premières expériences ..................................................... 6
2.1.4. Phénomène de mutarotation ............................................................................................. 6
2.1.5. Conclusion ....................................................................................................................... 7
2.2. Représentation de Tollens ............................................................................................................ 7
2.3. Représentation de Haworth .......................................................................................................... 8
3. Propriétés des oses et du glucose .............................................................................................................. 9
3.1. Propriétés physiques ..................................................................................................................... 9
3.1.1. Propriétés optiques ........................................................................................................... 9
3.1.2. Propriétés polaires ............................................................................................................ 9
3.1.3. Thermodégradable ........................................................................................................... 9
3.1.4. Goût sucré ........................................................................................................................ 9
3.2. Propriétés chimiques .................................................................................................................. 10
3.2.1. Stabilité .......................................................................................................................... 10
3.2.2. Réactions d'oxydation des oses ..................................................................................... 10
3.2.3. Réaction de réduction des oses ...................................................................................... 12
3.2.4. Estérification .................................................................................................................. 13
3.2.5. Déshydratation à chaud .................................................................................................. 13
3.2.6. Épimérisation ................................................................................................................. 14
3.2.7. Interconversion des oses ................................................................................................ 14
4. Diversité des oses ................................................................................................................................... 14
4.1. Classification des oses ................................................................................................................ 14
4.1.1. En fonction du nombre de carbones .............................................................................. 14
4.1.2. En fonction de la nature de la fonction réductrice ......................................................... 14
4.1.3. Convention de numérotation .......................................................................................... 14
4.2. Principaux oses ........................................................................................................................... 15
4.2.1. D-ribose ......................................................................................................................... 15
4.2.2. Hexoses .......................................................................................................................... 15
4.3. Dérivés d'oses ............................................................................................................................ 16
4.3.1. Désoxyoses .................................................................................................................... 16
4.3.2. Acides (glyc)uroniques .................................................................................................. 16
4.3.3. (Glyc)osamines ou (hex)osamines : dérivés aminés d'oses ........................................... 16
4.3.4. Polyols ou glycitols : glycérol, sorbitol, xylitol ............................................................. 16
4.3.5. Dérivés autres : acide ascorbique ................................................................................... 16
Cours biochimie BTS_ABM1 2019-2020 C. Larcher 1.3.1- Oses - Page 3 / 18 -1. Formule développée et isomérie
1.1. Isomères de constitution (de fonction)
Des isomères de consti tution sont des molé cules de même formule brute ma is de formulesdéveloppées différentes. On distingue les isomères de chaîne, de position et de fonction.
Les isomères de fonction possèdent des groupes fonctionnels différents, donc des propriétés
physiques et chimiques différentes. Les oses les plus simples ont trois atomes de carbone : glycéraldéhyde et dihydroxyacétone • Aldose : glucide avec fonction aldéhydique en bout de chaîne (C1) • Cétose : glucide avec fonction cétone à l'intérieur de la chaîne (C2). D(+)-glycéraldéhyde L(-)-glycéraldéhyde Dihydroxyacétone Figure 1 : distinction entre un aldose et un cétose (exemple avec C3)On remarque que le C
2 du glyc éraldéhyde porte 4 substituants différent s Þ C as ymétrique Þpropriétés optiques (pouvoir rotatoire) : existence de 2 isomères optiques images l'un de l'autre dans un
miroir : on parle d'énantiomères (D-glycéraldéhyde et L-glycéraldéhyde).1.2. Stéréoisomères
1.2.1. Nombre de stéréoisomères
Le glucose a pour formule développée :
HOH 2 C - CHOH - C
HOH - C
HOH - C
HOH - CH = O
Il possède 4 carbones asymétriques (C
). Il existe donc 2 4 = 16 stéréoisomères différents.Les stéréoisomè res sont des isomères de configuration, c'est-à-dire des molé cules de
constitution identique mais dont l'organisation spatiale des atomes est différente.Pour visualiser les stéréoisomères, on utilise la représentation ou projection de Fischer.
Rappel : représentation de Cram
• C dans le plan de la feuille. • Liaison en pointillés : liaison dirigée vers l'arrière. • Liaison en trait épais : liaison dirigée vers l'avant.1.2.2. Représentation de Fischer
La projection de Fischer est surtout utilisée pour représenter les sucres et les acides aminés. Elle fut inventée par Emil Fischer. Passage de la représentation de Cram à la représentation de Fischer : • la chaîne carbonée est orientée avec son groupement le plus oxydé dirigé vers le haut • les traits verticaux symbolisent des liaisons dirigées vers l'arrière • les traits horizontaux symbolisent des liaisons dirigées vers l'avant C OH CHOH CH 2 OH CH 2 OH C CH 2 OH O C OH CH 2 OH OHH C OH CH 2 OH HHOEmil Fischer
1852-1919
Prix Nobel de
Chimie 1902
Cours biochimie BTS_ABM1 2019-2020 C. Larcher 1.3.1- Oses - Page 4 / 18 - On ne représente pas les atomes de carbone, ils sont situés à l'intersection des segmentshorizontaux et du trait vertical. La représentation de Fischer est souvent allégée en ne marquant la
position des groupements OH que par des tirets.Par convention, le D-glycéraldéhyde est l'énantiomère qui a le groupement OH positionné à
droite dans la représentation de Fischer. Cette représentation permet de différencier facilement les énantiomères chiraux 1L ou D.
Figure 2 : représentations de Cram et de Fischer du D-glucose On clas se les isomères de configurat ion en trois grands groupes : les énantiomères, les diastéréoisomères et les épimères.1.2.3. Diversité des stéréoisomères
a. Énantiomères Un énantiomère est un isomère de configuration non superposable à son homologue après symétrie dans un miroir.Tous les ose s possèdent un pouvoir rotatoire
2 du fai t de la présence d'un carbone asymétrique, les oses sont dits chiraux.Deux énantiomè res ont les mêmes propriétés physiques et chi miques à l'except ion
d'une seule : leur pouvoir rotatoire opposé. Dans la forme D, le groupement alcool (-OH) porté par le carbone n - 1 est à droite (en représentation de Fischer) comme le (+)-glycéraldéhyde. Dans la forme L, le groupement alcool (-OH) porté par le carbone n - 1 est à gauche (en représentation de Fischer) comme le (-)-glycéraldéhyde. Figure 3 : énantiomères du glucose ; forme D-glucose = forme naturelle.Les oses de la série D sont naturels.
Un méla nge équimolaire de 2 énanti omères est appelé mélange racém ique. Il se
caractérise par l'absence d'un pouvoir rotatoire car les effets d'un des énantiomères sur la
déviation du plan de la lumière polarisée sont annulés par ceux du second. 1 Molécule chirale : molécule qui ne peut pas se superposer à son image dans un miroir 2Pouvoir rotatoire : se dit du pouvoir qu'ont les substances asymétriques de faire tourner le plan de polarisation de la lumière.
Cours biochimie BTS_ABM1 2019-2020 C. Larcher 1.3.1- Oses - Page 5 / 18 - b. DiastéréoisomèresLes diastéréoisomères sont les stéréoisomères qui ne sont pas des énantiomères.
c. Epimères Deux épimères ne diffèrent entre eux que par la configuration absolue d'un seul carbone asymétrique, comme par exemple entre le D-mannose et le D-glucose ou encore entre leD-glucose et le D-galactose.
1.2.4. Pouvoir rotatoire
En soluti on, les formes énantiom ères d'une molécule portant un c arbone asymétriqueprésentent des propriétés optiques différentes. Chaque énantiomère dévie le plan de polarisation
d'une onde monochromatique polarisée (angle égal en valeur absolue mais de signe opposé).Cette propriété est caractérisée par le pouvoir rotatoire spécifique qui répond à la loi de Biot :
��� : angle de rotation observée en degré (°). : pouvoir rotatoire spécifique de la substance, constant pour une température et une longueur d'onde données (en °·g -1·dm
2 ℓ : longueur de la cellule contenant la substance, traversée par la lumière (en dm) ��� : concentration massique de la substance (en g·mL -1D-glucose L-glucose
ENANTIOMÈRES
Épimère (en C2) du D-glucose Épimère (en C4) du D-glucoseD-mannose D-galactose
DIASTEREOISOMERES
Figure 4 : illustration de la notion d'énantiomères, d'épimères et de diastéréoisomères
Voir planche filiation des oses
Remarque : en général, le suffixe des aldoses est " -ose » alors que celui des cétoses est " -ulose » (sauf exceptions : fructose,
sorbose,...). OH CH 2 OH OH CH 2 OH OH CH 2 OH OH CH 2 OH Cours biochimie BTS_ABM1 2019-2020 C. Larcher 1.3.1- Oses - Page 6 / 18 -2. Structures cyclisées
2.1. Mise en évidence de l'existence de la structure cyclisée du glucose
2.1.1. Réaction au réactif de Schiff
Le glucose possède une fonction aldéhydique. En présence du réactif de Schiff, on devrait
obtenir une coloration rouge que l'on n'obtient pas !2.1.2. Réaction d'hémiacétalisation en présence d'un alcool
Une molécule avec une fonction aldéhyde ou cétone est capable de réagir successivement avec deux molécules d'alcool (ici le méthanol) suivant les réactions suivantes :En présence d'HCl anhydre :
Aldéhyde + méthanol ® hémiacétal Hémiacétal + méthanol ® acétal + eau
R-CHO + CH
3OH ®
Aldéhyde + méthanol Hémiacétal
+ CH 3OH ®
+ H 2 OHémiacétal méthanol Acétal
Figure 5 : réaction d'hémiacétalisation entre un aldéhyde et un alcool Dans les mêmes conditions, le glucose ne réagit qu'avec une seule molécule de méthanol !2.1.3. Explication possible aux deux premières expériences
Dans le glucose, il s'est produit une réaction entre la fonction a ldéhydique et un desgroupements OH (= réaction d'hémiacétalisation intramoléculaire). Ceci expliquerait pourquoi le
glucose n'est pas capable de colorer le réactif de Schiff et pourquoi il ne peut réagir qu'avec une
seule molécule de méthanol (puisqu'il aurait déjà réagi avec une fonction alcool pour se retrouver
sous la forme d'un hémiacétal).2.1.4. Phénomène de mutarotation
La cristallisation du D-glucose dans des solvants différents (éthanol, pyrimidine) conduit nonpas à un seul produit mais à 2 produits dont les pouvoirs rotatoires sont différents. Ces 2 formes ont
été qualifiées de forme á (+ 112°), cristallisation dans l'éthanol (conditions !), et de forme â
(+ 19°), cristallisation dans la pyrimidine (conditions "). Ces deux formes sont dites anomères.
On observe pour chacune des formes mises en solution aqueuse, en fonction du temps, uneévolution du pouvoir rotatoire qui atteint pour chacune des formes la même valeur + 52,5°. Cette
valeur correspond à une proportion d'environ 1/3 de l'anomère a et 2/3 de l'anomère b. RC OH H OCH 3 RC OH H OCH 3 RC OCH 3 H OCH 3Solution de D-glucose Cristallisation dans conditions ! Þ obtention du composé 1, a = + 112° FORME a Cristallisation dans conditions " Þ obtention du composé 2, a = + 19° FORME b
Cours biochimie BTS_ABM1 2019-2020 C. Larcher 1.3.1- Oses - Page 7 / 18 - L'établissement de l'équilibre ci-dessus à partir de l'un ou l'autre des glucopyranoses s'appelle la mutarotation du glucose :D-a-glucose pur
Équilibre :
1/3 forme a et 2/3 forme b
D-b-glucose pur
112° 52,5° 19°
2.1.5. Conclusion
Seule explication possible à ce phénomène appelé mutarotation : il se produit un changement
de conformation entre les deux formes en solution. En fait, la mutarotation correspond au passaged'une forme a nomérique à une autre par ouverture du glucose s ous forme hémiacé talique et
recyclisation (b-D-glucose Û glucose linéaire Û a-D-glucose).2.2. Représentation de Tollens
Pour explique r ces différentes expéri ences, Tollens proposa une structure où le carbone 1 du
glucose devient asymétrique après l'apparition d'un cycle formé suite à l'hémiacétalisation de la fonction
aldéhydique par un groupement hydroxyle (du carbone 4 ou du carbone 5) créant un pont oxydique.
OOHO O Cours biochimie BTS_ABM1 2019-2020 C. Larcher 1.3.1- Oses - Page 8 / 18 - + H 2 O - H 2 OD-glucose
Forme aldéhydique libreHydrate
d'aldéhydeHémiacétal
Forme glucopyranose (pont oxydique enC1 et C5)
Figure 6 : Passage du D-glucose de la forme linéaire à la forme glucopyranose * Pour les aldoses : • Dans le cas d'un pont oxydique entre C1 et C5, on obtient un cycl e he xagonal comportant 5 carbones et un atome d'oxygène ; c'est un noyau pyrane. • Dans le cas d'un pont oxydi que entre C1 et C4, on obtient un cyc le pentagonal comportant 4 carbones et un atome d'oxygène ; c'est un noyau furane. * Pour les cétoses : • Dans le cas d'un pont oxydique entre C2 et C6, on obtient un noyau pyrane. • Dans le cas d'un pont oxydique entre C2 et C5, on obtient un noyau furane.Noyau pyrane Noyau furane
Figure 7 : représentation des noyaux pyrane et furane Dans la forme cyclisée apparaît donc un nouveau carbone asymétrique en C1 dans le cas desaldoses et en C2 dans le cas des cétoses. En fonction de la position de l'hydroxyle porté par ce
carbone, on distingue les formes anomériques a et b.Dans la représentation de Tollens, on représente l'anomère a en plaçant l'hydroxyle en C1 du
même côté que l'hydroxyle qui détermine la série de l'ose, c'est-à-dire du même côté que le pont
oxydique. Les oses étant de la série D, les isomères a sont ceux dont l'hydroxyle porté par le C1quotesdbs_dbs12.pdfusesText_18[PDF] maps belgique
[PDF] métabolisme du glucose pdf
[PDF] bilan glycolyse
[PDF] glycolyse schéma
[PDF] glucose oxydé
[PDF] oxydation glucose en acide gluconique
[PDF] mdm android gratuit
[PDF] http scholar google fr
[PDF] sucre et electrons
[PDF] telecharger google scholar
[PDF] google scholar traduction
[PDF] google scholar citations
[PDF] scholar traduction
[PDF] valeur cible excel
