 Propriétés physico- chimiques des oses
Propriétés physico- chimiques des oses
II.Propriétées chimiques : II.1) Stabilité chimique : a)En milieu acide : En milieu acide dilué les oses sont stables
![[PDF] Propriétés physico-chimiques des oses [PDF] Propriétés physico-chimiques des oses](https://pdfprof.com/PDFV2/GoBo/Images32/18_25674_3_.png) [PDF] Propriétés physico-chimiques des oses
[PDF] Propriétés physico-chimiques des oses
B-PROPRIETES CHIMIQUES: Une partie importante de leur propriété chimique est celle des fonctions carbonylés et des alcools. I/STABILISATION CHIMIQUE DES OSES.
 Structure et propriétés des glucides
Structure et propriétés des glucides
Aug 19 2020 b- Propriétés chimiques des oses b-1 – Propriétés dues à la fonction ... oses
 Propriétés physico- chimiques des oses
Propriétés physico- chimiques des oses
I.Propriétées physiques des oses : 1) solubilité : Riches en groupement hydroxyle (OH) propriétés polaires capables de multiples liaisons hydrogènes :.
 Propriétés physico- chimiques des oses
Propriétés physico- chimiques des oses
II.Propriétées chimiques : II.1) Stabilité chimique : a)En milieu acide : En milieu acide dilué les oses sont stables
 Diapositive 1
Diapositive 1
➢Principales propriétés des oses. ➢Propriétés Deux isomères optiques possèdent les mêmes propriétés chimiques et beaucoup de propriétés physiques (point.
 Structure des oses
Structure des oses
Le D-glycéraldéhyde α= +14 °. Le L-glycéraldéhyde α= -14°. Ces deux composés ont des propriétés physiques et chimiques identiques à l'exception de leur action.
 BIOCHIMIE STRUCTURALE GLUCIDES
BIOCHIMIE STRUCTURALE GLUCIDES
PROPRIETES CHIMIQUES. Les propriétés chimiques des oses sont caractéristiques des groupements hydroxyles et des groupements carbonyles. 1. Propriétés dues à
 Propriétés physico-chimiques des oses
Propriétés physico-chimiques des oses
- Citer les propriétés chimiques des oses dues à la présence des fonctions Propriétés physico-chimiques des oses. Année universitaire : 2022/2023. Dr BENSAAD.
 Les glucides
Les glucides
Deux énantiomères ont les mêmes propriétés chimiques et physiques mais la présence de un ou de plusieurs C* confère aux glycéraldéhydes (et aux autres oses)
 LES GLUCIDES
LES GLUCIDES
PROPRIETES DES OSES. I . PROPRIETES PHYSIQUES DES OSES. Les oses sont des molécules très riches en groupement hydroxyle ce qui leur confère des propriétés
 Propriétés physico- chimiques des oses
Propriétés physico- chimiques des oses
Propriétés physico- chimiques des oses. Dr. BENSAAD.S. Année universitaire : 2021/2022. Objectifs du cours : - Citer les propriétés physiques des oses.
 Propriétés physico-chimiques des oses
Propriétés physico-chimiques des oses
A-PROPRIETES PHYSIQUES: 1- Solubilité et cristallisation. *Les oses sont solubles dans l'eau car présentent plusieurs groupes OH.
 BIOCHIMIE STRUCTURALE & METABOLIQUE GLUCIDES
BIOCHIMIE STRUCTURALE & METABOLIQUE GLUCIDES
I.3 Propriétés optiques. I.4 Phénomène de mutarotation. II. PROPRIETES CHIMIQUES DES OSES. II.1 Stabilité chimique des oses. II.2 Propriétés dues à la
 I. Les Glucides
I. Les Glucides
Les oses : appelés aussi sucres simples ou monosaccharides ont comme formule Les propriétés chimiques des oses sont caractéristiques des groupements ...
 Les glucides COURS DE BIOCHIMIE
Les glucides COURS DE BIOCHIMIE
Propriétés physicochimiques des oses … Propriétés chimiques des oses… ... Vu que les oses portent la même formule chimique la distinction entre les ...
 COURS DE BIOCHIMIE STRUCTURALE
COURS DE BIOCHIMIE STRUCTURALE
Enfin les propriétés des glucides et des lipides font chacun l'objet d'un chapitre spécifique. Page 7. Chapitre 1 : les liaisons chimiques. La liaison chimique
 Les Glucides
Les Glucides
hétéroside : son hydrolyse libère des oses et des composés non glucidiques Les propriétés chimiques et physiques des énantiomères sont en général ...
 LES GLUCIDES
LES GLUCIDES
Les oses qui possèdent une fonction aldéhyde sont appelés des aldoses et ceux Les 2 énantiomères ont des propriétés physiques et chimiques identiques ...
 Biochimie structurale
Biochimie structurale
propriété physique : le pouvoir rotatoire. La propriété de pouvoir rotatoire des oses permet le dosage ... Filiation chimique des oses selon Fischer.
 [PDF] Propriétés physico-chimiques des oses
[PDF] Propriétés physico-chimiques des oses
A-PROPRIETES PHYSIQUES: 1- Solubilité et cristallisation *Les oses sont solubles dans l'eau car présentent plusieurs groupes OH
 [PDF] Propriétés physicochimiques des oses
[PDF] Propriétés physicochimiques des oses
propriétés chimiques dues à la présence des fonctions alcools : 1- Formation d'esters: • L'estérification est une réaction entre un acide et un alcool •
 [PDF] BIOCHIMIE STRUCTURALE & METABOLIQUE GLUCIDES
[PDF] BIOCHIMIE STRUCTURALE & METABOLIQUE GLUCIDES
Leurs propriétés chimiques sont caractéristiques des groupements hydroxyles alcooliques et des groupements carbonyles II 1 Stabilité chimique des oses En
 [PDF] LES GLUCIDES
[PDF] LES GLUCIDES
1 BTS BIAC 2ème année LES GLUCIDES Sous chapitre 1 STRUCTURE DES OSES Les 2 énantiomères ont des propriétés physiques et chimiques identiques
 [PDF] Structure et propriétés des glucides
[PDF] Structure et propriétés des glucides
19 août 2020 · b- Propriétés chimiques des oses b-1 – Propriétés dues à la fonction carbonyle b 1 1– Réduction des oses : obtention d'alditols (ositols)
 Propriétés des oses - FSM
Propriétés des oses - FSM
Les propriétés physiques et chimiques des oses reposent sur trois Bases structurales (1D - 1) qui sont : la polarité du carbonyle;; l'acidité de l'hydrogène
 [PDF] I Les Glucides
[PDF] I Les Glucides
2 2 1 Holosides : leur hydrolyse ne libère que des oses Les propriétés chimiques des oses sont caractéristiques des groupements hydroxyles alcooliques
 [PDF] • COURS DES GLUCIDES - Faculté des Sciences de Rabat
[PDF] • COURS DES GLUCIDES - Faculté des Sciences de Rabat
I - Les oses : (Monosaccharides) : 1- Plan de base des oses 2- Appellation des oses 3- Dissimétrie moléculaire-pouvoir rotatoire 4- Diversité des oses
 [PDF] 1 biochimie structurale 13- les glucides
[PDF] 1 biochimie structurale 13- les glucides
Les isomères de fonction possèdent des groupes fonctionnels différents donc des propriétés physiques et chimiques différentes Les oses les plus simples
Quelles sont les propriétés des oses ?
Les oses sont des molécules très riches en groupement hydroxyle ce qui leur confère des propriétés polaires capables de multiples liaisons hydrogène : - avec l'eau : ce sont des molécules très hydrosolubles (et solubilité variable dans les solvants organiques), - avec d'autres biomolécules comme les protéines.Quelles sont les propriétés chimiques du glucose ?
Propriétés chimiques
La formule brute du glucose est C6H1206, il s'agit d'un ose et plus précisément d'un aldohexose très soluble dans l'eau. En effet, il contient une fonction aldéhyde et six atomes de carbone. La masse molaire du glucose est de 180,1559 g/mol.Comment reconnaître un ose ?
Un ose (ou monosaccharide) est un monomère de glucide. Les oses poss?nt au moins trois atomes de carbone : ce sont des polyhydroxyaldéhydes ou des polyhydroxycétones. Les monosaccharides ne sont pas hydrolysables, mais les polysaccharides sont très solubles dans l'eau et poss?nt généralement un pouvoir sucrant.- Les oses, monoses, monosaccharides ou encore sucres simples, sont des molécules constituées de seulement trois types d'atomes (C, H et O). Ils poss?nt un squelette carboné, généralement linéaire, comportant de 3 à 6 carbones pour les oses les plus représentatifs, quelquefois 7, voire 8 carbones.
Propriétés physico-chimiquesdes oses
Propriétés physico-chimiquesdes oses
4PROPRIETES PHYSIQUES DES OSESI.1Solubilité:Les oses sont de petites molécules, très polarisables en raison de leurs nombreuses fonctionsalcooliques (groupements hydroxyle) qui leurs confèrent des propriétés polaires capables de multiplesliaisons hydrogènes :Avec l"eau : sont très hydrosolubles (jusqu'à 3 M,exemple: la solubilité des molécules de glucose(masse molaire=180/L) dans l"eau = 3M 3 x180 = 540 g/l.Par contre les oses sont insolubles dans l"éther et peu solubles dans le méthanol ou l"éthanol( Ils secristallisent )Avec des biomolécules:Ex :ProtéinesI.2Caramélisation:Leur structure est thermo-dégradablec'est-à-dire qu"une température élevée conduit à la dégradationdes osescaramélisation: le glucose par exemple quand il estChauffé, fond vers150 °C, maiscommence aussi tôt a secaramélisé.I.3Propriétés optiques ou spectralesLes oses ne présentent pas d'absorption dans le visible ou l'ultraviolet. Ils absorbent lesrayonnementsinfra rouges(Spectre infrarouge caractéristique).Deux propriétésphysiques servent a leur identification le pouvoir rotatoire et le comportementchromatographiqueI.4Phénomène de mutarotationLa valeur du pouvoir rotatoire d"un ose (mesurée au polarimètre) n"est pas fixée immédiatement ;elle le devient au bout d"un certain temps. Ce phénomène est dit phénomène demutarotation.Lorsqu"on dissout dans de l"eau le glucose, on constate que le pouvoir rotatoire varie dans le tempspour arriver à une valeur finale de + 52 ° 7(Figure 1).Cette expérience suggère que le D-glucose a unnouveau centre chiral supplémentaire et donc deux formes isomériques, l"anomèreα 112 ° 2ouβ 18 °7(Ces 2 anomères différentspar la position dans l"espace du OH hémi-acétalique).
Propriétés physico-chimiquesdes oses
Les anomèresαetβs"interconvertissent pour atteindre un équilibre caractéristique de l"ose.Pour le glucose, lorsque l'équilibre est atteint, les 2 formesα et β sont présentesen solution dans lesrapports respectifs suivants : 1/3 et 2/3.
Figure 1 :Phénomène de mutarotation
Propriétés physico-chimiquesdes oses
II.Propriétés chimiquesLeurs propriétés chimiques sont caractéristiques des groupements hydroxyles alcooliquesetdes groupements carbonyles.II.1Stabilité chimique des osesEn milieu acide et à chaud (Réaction furfuralique),les oses subissent une déshydratation interneet une cyclisation aboutissant à des dérivés furfurals.
iEn milieu acide faiblelesoses sont stables.En milieu alcalin et à froid,les oses subissent uneinter-conversioncaractérisée par le passage dela fonction aldéhyde à la fonction cétone et inversement,et uneépimérisationqui est une inversion dela configuration des substituantsd'un seul carboneassymétrique.L'épimérisation est également possible par voie enzymatique grâce à l'utilisation d'uneépimérase.
Lesdérivés furfurals peuvent être utilisés comme méthode de dosage: ils ont la propriétédese condenser avec des phénols, amines aromatiques ou des hétérocycles azotés pourdonner naissance à des produits colorés.
Propriétés physico-chimiquesdes oses
En milieu alcalin et à chaud,on aura une dégradation totale des oses.II.2Propriétés dues à la fonction carbonyliqueFormation d"un hémiacétalUn aldose ou une cétonevraiefixe deux molécules d"alcool pour former un acétal.
La fonction carbonylique des aldoses ou des cétoses ne fixe qu"une seule molécule d"alcool pourformer uniquement un hémiacétal.
Propriétés physico-chimiquesdes oses
Réduction en polyalcoolsLes oses se réduisent enpolyolssoit par voie chimique parl"Hydrure de bore et desodium(NaBH4)(Réaction irréversible:), ou par voie enzymatique (réactionréversible).La fonction aldéhydique ou cétonique est réduite enalcool.
Exemples:Glucose en Glucitol (anciennement appeléSorbitol) Galactose en Galactitol (ou Dulcitol) Mannose en Mannitol Ribose en RibitolLe Fructose donne 2 polyols epimères en C2 car la réduction du C= O entraîne la formation d"unC*asymétrique :
Propriétés physico-chimiquesdes oses
Réduction en polyalcoolsLes oses se réduisent enpolyolssoit par voie chimique parl"Hydrure de bore et desodium(NaBH4)(Réaction irréversible:), ou par voie enzymatique (réactionréversible).La fonction aldéhydique ou cétonique est réduite enalcool.
Exemples:Glucose en Glucitol (anciennement appeléSorbitol) Galactose en Galactitol (ou Dulcitol) Mannose en Mannitol Ribose en RibitolLe Fructose donne 2 polyols epimères en C2 car la réduction du C= O entraîne la formation d"unC*asymétrique :
Propriétés physico-chimiquesdes oses
Réduction en polyalcoolsLes oses se réduisent enpolyolssoit par voie chimique parl"Hydrure de bore et desodium(NaBH4)(Réaction irréversible:), ou par voie enzymatique (réactionréversible).La fonction aldéhydique ou cétonique est réduite enalcool.
Exemples:Glucose en Glucitol (anciennement appeléSorbitol) Galactose en Galactitol (ou Dulcitol) Mannose en Mannitol Ribose en RibitolLe Fructose donne 2 polyols epimères en C2 car la réduction du C= O entraîne la formation d"unC*asymétrique :
Propriétés physico-chimiquesdes oses
Réaction àla liqueur de FehlingC"est une réaction deréduction qui utilise les sels cuivriques cu2+, utilisée surtout pour la caractérisationdessucres.Les ionscuivresCu2+contenus dans la liqueur de Fehling et responsables de la couleur bleue sonttransformés en milieu alcalin et à chaud en ionsCu+par le sucre réducteur (glucose par exemple).Ces ions s'associent avec l'oxygène pour former del'oxyde cuivreux (Cu2O)qui donne un précipitérouge brique.
OxydationLa fonction aldéhydique ou cétonique des oses est susceptible d'être oxydée, les oses sont doncdes composésréducteurs mais plus faibles que les aldéhydes et les cétones vrais.Le résultat de l'oxydation dépend des conditions de cette oxydation.a) Par oxydation douce des aldoses avec le brome (Br2) ou l'iode ( I2) en milieu légèrementalcalin,on obtient les acides aldoniques.Pour nommer le produit de l'oxydation douce, on remplace lesuffixe"ose "par le suffixe"onique" .Exemples*le glucosedonnel'acide gluconique* le mannosedonne l'acide mannonique* le galactosedonne l'acide galactonique
Propriétés physico-chimiquesdes oses
b) Par oxydation pluspoussée avec l'acide nitrique (HNO3) à chaud,on obtient lesacidesaldariquesqui sont des diacides possédant une fonction carboxylique sur les carbones 1 et 6.
Pour nommerle produit de l'oxydation poussée, on remplace le suffixe"ose "par lesuffixe"arique" .le galactosedonne l'acide galactariquele glucosedonne l'acide glucarique
Pour les cétoses,la chaîne est rompue au niveau de la fonction cétone.Propriétés physico-chimiquesdes oses
b) Par oxydation pluspoussée avec l'acide nitrique (HNO3) à chaud,on obtient lesacidesaldariquesqui sont des diacides possédant une fonction carboxylique sur les carbones 1 et 6.
Pour nommerle produit de l'oxydation poussée, on remplace le suffixe"ose "par lesuffixe"arique" .le galactosedonne l'acide galactariquele glucosedonne l'acide glucarique
Pour les cétoses,la chaîne est rompue au niveau de la fonction cétone.Propriétés physico-chimiquesdes oses
b) Par oxydation pluspoussée avec l'acide nitrique (HNO3) à chaud,on obtient lesacidesaldariquesqui sont des diacides possédant une fonction carboxylique sur les carbones 1 et 6.
Pour nommerle produit de l'oxydation poussée, on remplace le suffixe"ose "par lesuffixe"arique" .le galactosedonne l'acide galactariquele glucosedonne l'acide glucarique
Pour les cétoses,la chaîne est rompue au niveau de la fonction cétone.Propriétés physico-chimiquesdes oses
c) Enfin, si la fonction aldéhyde est protégée pendant l'oxydation,onobtient les acides uroniquesoxydés uniquement sur la fonction alcool primaire . Pour la nomenclature de l'acide uroniqueformé,il suffit de remplacerle suffixe"ose "par le suffixe"uronique" .le glucose donnel'acide glucuronique:c" est le précurseur de la voie de synthèsede lavitamine Cou acide L-ascorbique.le galactose donne l'acide galacturonique
Réaction d"addition ou de substitutionSubstitution: L"action desphénols (C6H5OH)et des alcools(méthanol CH3OH)(Réactionde méthylation) sur les oses, donnent respectivement des composésphénylés(ex:D phényl glucoside)ouméthylés(ex: D méthyl glucoside).
Ces deux composés sont les constituants des glycosaminoglycanes, qui jouent un rôleessentiel dansla détoxicationhépatique.
Propriétés physico-chimiquesdes oses
c) Enfin, si la fonction aldéhyde est protégée pendant l'oxydation,onobtient les acides uroniquesoxydés uniquement sur la fonction alcool primaire . Pour la nomenclature de l'acide uroniqueformé,il suffit de remplacerle suffixe"ose "par le suffixe"uronique" .le glucose donnel'acide glucuronique:c" est le précurseur de la voie de synthèsede lavitamine Cou acide L-ascorbique.le galactose donne l'acide galacturonique
Réaction d"addition ou de substitutionSubstitution: L"action desphénols (C6H5OH)et des alcools(méthanol CH3OH)(Réactionde méthylation) sur les oses, donnent respectivement des composésphénylés(ex:D phényl glucoside)ouméthylés(ex: D méthyl glucoside).
Ces deux composés sont les constituants des glycosaminoglycanes, qui jouent un rôleessentiel dansla détoxicationhépatique.
Propriétés physico-chimiquesdes oses
c) Enfin, si la fonction aldéhyde est protégée pendant l'oxydation,onobtient les acides uroniquesoxydés uniquement sur la fonction alcool primaire . Pour la nomenclature de l'acide uroniqueformé,il suffit de remplacerle suffixe"ose "par le suffixe"uronique" .le glucose donnel'acide glucuronique:c" est le précurseur de la voie de synthèsede lavitamine Cou acide L-ascorbique.le galactose donne l'acide galacturonique
Réaction d"addition ou de substitutionSubstitution: L"action desphénols (C6H5OH)et des alcools(méthanol CH3OH)(Réactionde méthylation) sur les oses, donnent respectivement des composésphénylés(ex:D phényl glucoside)ouméthylés(ex: D méthyl glucoside).
Ces deux composés sont les constituants des glycosaminoglycanes, qui jouent un rôleessentiel dansla détoxicationhépatique.
Propriétés physico-chimiquesdes oses
I.3Propriétés dues à la présence de la fonction alcool1/Estérification:La réaction d'estérification est une réaction d'un acide et d'un alcool. Le produit de la réaction estun ester.Les fonctions alcools primaires et secondairesdes osespeuvent être estérifiées par des acidesminérauxou organiques.Par l'acide minéral comme l'acide phosphorique on obtient des esters phosphoriques :Monophosphoriquecomme leglycéraldéhyde 3 phosphate,
Diphosphorique comme lefructose 1,6 diphosphatequi est un intermédiaire de la glycolyse.Le glucose peut êtreestérifiéde trois façons conduisantla formationde trois substratsénergétiques très importants :Une estérification au niveau du carbone 1 conduisant à la formation duglucose1phosphate;Une estérification au niveau du carbone 1 conduisant à la formation duglucose 6 phosphate;Une doubleEstérificationau niveau du carbone 1et 6conduisant à la formation duglucose-1,6-bi-phosphate;
Propriétés physico-chimiquesdes oses
I.3Propriétés dues à la présence de la fonction alcool1/Estérification:La réaction d'estérification est une réaction d'un acide et d'un alcool. Le produit de la réaction estun ester.Les fonctions alcools primaires et secondairesdes osespeuvent être estérifiées par des acidesminérauxou organiques.Par l'acide minéral comme l'acide phosphorique on obtient des esters phosphoriques :Monophosphoriquecomme leglycéraldéhyde 3 phosphate,
Diphosphorique comme lefructose 1,6 diphosphatequi est un intermédiaire de la glycolyse.Le glucose peut êtreestérifiéde trois façons conduisantla formationde trois substratsénergétiques très importants :Une estérification au niveau du carbone 1 conduisant à la formation duglucose1phosphate;Une estérification au niveau du carbone 1 conduisant à la formation duglucose 6 phosphate;Une doubleEstérificationau niveau du carbone 1et 6conduisant à la formation duglucose-1,6-bi-phosphate;
Propriétés physico-chimiquesdes oses
I.3Propriétés dues à la présence de la fonction alcool1/Estérification:La réaction d'estérification est une réaction d'un acide et d'un alcool. Le produit de la réaction estun ester.Les fonctions alcools primaires et secondairesdes osespeuvent être estérifiées par des acidesminérauxou organiques.Par l'acide minéral comme l'acide phosphorique on obtient des esters phosphoriques :Monophosphoriquecomme leglycéraldéhyde 3 phosphate,
Diphosphorique comme lefructose 1,6 diphosphatequi est un intermédiaire de la glycolyse.Le glucose peut êtreestérifiéde trois façons conduisantla formationde trois substratsénergétiques très importants :Une estérification au niveau du carbone 1 conduisant à la formation duglucose1phosphate;Une estérification au niveau du carbone 1 conduisant à la formation duglucose 6 phosphate;Une doubleEstérificationau niveau du carbone 1et 6conduisant à la formation duglucose-1,6-bi-phosphate;
Propriétés physico-chimiquesdes oses
2 /Ethérification :Formation d"ether-oxydesLes hydroxyles donnent avec les alcools des ether-oxydes selon la réaction suivante :
Mèthylationdes fonctions alcoolsLa méthylation des oses est une réaction d'ethérificationconduisant à l'addition d'un méthylà un hydroxyle.Les agents méthylants tels que lesulfate de méthyle ((SO4(CH3)2)en présence de soude (Haworth)oul'iodure de méthyle ICH3 avec Ag2O(Purdie) agissent en substituant tous les hydrogènesdes groupements hydroxyles par un-CH3 formant ainsi un groupement éther.Laperméthylationconduira à la méthylation de tous les hydroxyles d'un ose .Si le groupement réducteur de l'ose est libre, il réagira en formant un dérivé O-méthylé.Cependant,en milieu acide cette liaison est hydrolysée ce qui conduit à la libération du méthyle.
Propriétés physico-chimiquesdes oses
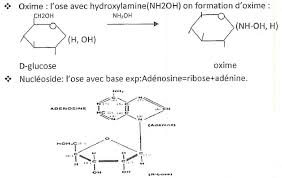
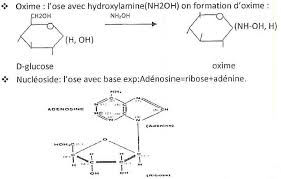
3/Formation des osaminesréaction de substitution d"ungroupement OH par un groupement aminé le plus souvent acétyléEx :Glucosamine,N-acetyl glucosamine (composition des oligo-polysaccharides)
quotesdbs_dbs12.pdfusesText_18[PDF] maps belgique
[PDF] métabolisme du glucose pdf
[PDF] bilan glycolyse
[PDF] glycolyse schéma
[PDF] glucose oxydé
[PDF] oxydation glucose en acide gluconique
[PDF] mdm android gratuit
[PDF] http scholar google fr
[PDF] sucre et electrons
[PDF] telecharger google scholar
[PDF] google scholar traduction
[PDF] google scholar citations
[PDF] scholar traduction
[PDF] valeur cible excel
