 SV Concours
SV Concours
26 февр. 2020 г. spectroscopie : ... UV / Visible Infra-Rouge
 Spectroscopie UV-Visible
Spectroscopie UV-Visible
Spectroscopie : Etude des interactions entre la matière et un rayonnement ε ➚ : effet hyperchrome ε ➘ : effet hypochrome. Conjugaison; mais aussi ...
 Chapitre XI Transitions électroniques Spectroscopie UV-visible 1
Chapitre XI Transitions électroniques Spectroscopie UV-visible 1
Enfin un effet hyperchrome augmente ε un effet hypochrome le diminue. 4.5. Aspect des spectres : raies
 chap.I master Spectr. UV
chap.I master Spectr. UV
SPECTROSCOPIE D'ABSORPTION. DANS L'UV-VISIBLE. CHAPITRE I : PLAN. CHAPITRE II + effet hyperchrome sur la bande π → π*. Même effet observé sur la ...
 Chapitre III-Spectroscopie dabsorption dans lUV-visible
Chapitre III-Spectroscopie dabsorption dans lUV-visible
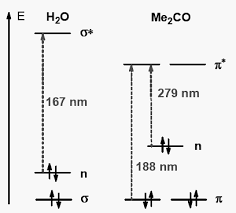
Il en découle un effet bathochrome et un effet hyperchrome sur la bande d'absorption correspondant à la transition π → π*. Composé λmax εmax. Ethylène. 165.
 Intérêt de la méthode des ajouts dosés en spectroscopie UV-Visible
Intérêt de la méthode des ajouts dosés en spectroscopie UV-Visible
26 апр. 2023 г. une influence sur les propriétés d'absorption et un effet hyperchrome dans le cas de HCl et l'eau par rapport à H2SO4. 9 Dans le cas des ...
 CHAPITRE I-spectroscopie dabsorption UV-visible
CHAPITRE I-spectroscopie dabsorption UV-visible
portés par un chromophore C=C ou C=O donnent des effets bathochrome et hyperchrome. V.3 - Effet de la conjugaison. L'enchaînement d'insaturations entraîne la
 8 Chapitre II - SPECTROSCOPIE DABSORPTION DANS LUV
8 Chapitre II - SPECTROSCOPIE DABSORPTION DANS LUV
portés par un chromophore C=C ou C=O donnent des effets bathochrome et hyperchrome. V.3 - Effet de la conjugaison. V.3.1 - Composés éthyléniques. L'enchaînement
 Chapitre 2 : Spectroscopie ultraviolet/visible
Chapitre 2 : Spectroscopie ultraviolet/visible
Remarque : On utilise également l'effet hyperchrome et l'effet hypochrome si on résonne par rapport à Є (coefficient d'absorption molaire). Effet
 [PDF] 3 Spectroscopie UV-Visible - LCMCP
[PDF] 3 Spectroscopie UV-Visible - LCMCP
Effet hyperchrome : le chromophore augmente l'intensité d'absorption : (augmente I) 3 4 Transitions ? – ?* Mettre d'un e Page
 [PDF] CHAPITRE I-spectroscopie dabsorption UV-visible
[PDF] CHAPITRE I-spectroscopie dabsorption UV-visible
Effet hypsochrome : déplacement des bandes d'absorption vers les courtes longueurs d'onde ? Effet hyperchrome : augmentation de l'intensité d'absorption
 [PDF] Chapitre 2 : Spectroscopie ultraviolet/visible
[PDF] Chapitre 2 : Spectroscopie ultraviolet/visible
La spectroscopie UV-Visible est la plus ancienne et la plus utilisée des méthodes d'analyse Effet hyperchrome: augmentation de l'intensité d'absorption
 [PDF] Spectroscopie UV-Visible - L3 Chimie Dijon
[PDF] Spectroscopie UV-Visible - L3 Chimie Dijon
Spectroscopie d'absorption UV-Visible Spectroscopie : Etude des interactions entre la matière et un rayonnement ? ? : effet hyperchrome
 [PDF] INTRODUCTION A LA SPECTROSCOPIE - EST Fkih Ben Salah
[PDF] INTRODUCTION A LA SPECTROSCOPIE - EST Fkih Ben Salah
Substituants à effet mésomère (auxochromes) OH -OR -X -NH2 portés par un chromophore C=C ou C=O : Effets bathochrome et hyperchrome
 [PDF] Spectroscopie UV-Visible
[PDF] Spectroscopie UV-Visible
La spectroscopie d'absorption dans l'UV et le visible est basée sur la propriété des molécules Effet hyperchrome : Augmentation de l'absorbance
 [PDF] Cours_Spectrophotométrie UV-VISIBLE
[PDF] Cours_Spectrophotométrie UV-VISIBLE
Effet hyperchrome: augmentation de l'intensité d'absorption L'analyse quantitative par la spectrométrie UV-visible est très employée (beaucoup
 [PDF] Chapitre XI Transitions électroniques Spectroscopie UV-visible 1
[PDF] Chapitre XI Transitions électroniques Spectroscopie UV-visible 1
Enfin un effet hyperchrome augmente ? un effet hypochrome le diminue 4 5 Aspect des spectres : raies bandes et structure fine
 [PDF] SPECTROSCOPIE MOLECULAIRE Introduction
[PDF] SPECTROSCOPIE MOLECULAIRE Introduction
La spectroscopie d'absorption dans l'UV et le visible est une méthode très commune Effet hyperchrome : Augmentation de l'absorbance
 Spectroscopie infrarouge - Webjournal Julie Daubié Rombas
Spectroscopie infrarouge - Webjournal Julie Daubié Rombas
Les trois bandes précédentes subissent un effet hyperchrome ; le subit en outre un effet hypsochrome et les autres un effet bathochrome : 3 Triple liaison carbone–carbone Spectroscopie Infrarouge Page 3 sur 14
Quels sont les effets du chromophore ?
Effet hypsochrome :le chromophore augmente la fréquence d’absorption (diminue le lambdamax). Effet hypochrome :le chromophore diminue l’intensité d’absorption : (diminue varepsilon). Effet hyperchrome :le chromophore augmente l’intensité d’absorption : (augmente varepsilon).
Qu'est-ce que la spectroscopie infrarouge?
Spectroscopie infrarouge Spectroscopie infrarouge Les transitions énergétiques se font ici entre les niveaux d’énergie de rotation des molécules ou entre leurs niveaux d’énergie de vibration. Les transitions entre niveaux de rotation apparaissent dans l’I.R. lointain (de 20 à 250 µm ou de 500 à 40 ).
Comment calculer la spectrophotométrie d’absorption moléculaire ?
Spectrophotométrie d’absorption moléculaire Uv – Visible Les spectres Caractéristiques générales Spectres de bandes : A = f(lambda) niveaux d’énergie électronique Zone spectrale : UV: 100 à 400 nm en pratique, on travaille à partir de 200 nm, car les UV sont absorbés par l’O2 de l’air et par le matériel ( cuve de mesure) Visible: 400 à 800 nm
Qu'est-ce que la spectrophotométrie UV-visible ?
spectrophotométrie Uv-Visible est la technique spectroscopique implique l'interaction des substances avec les rayonnements ultra-violet et visible Skip to content Chimie Analytique Analyse chimique en main Menu Accueil Chimie en solution Les concentrations en chimie Eléctrochimie Chromatographie Eléctrophorèse Spéctroscopie Quiz Contact Search for:
3. Spectroscopie UV-Visible
Spectroscopie UV-Visible :
Spectroscopie qui met en jeu les photons dont les longueurs d'onde se situent dans le domaine de l'ultraviolet (200 nm -400 nm) et du visible (400 nm - 750 nm).
Soumis à un rayonnement dans cette gamme de longueurs d'onde, les électrons de molécules, ions ou complexes sont susceptibles de subir une ou plusieurs transition électronique(s).3.1. Définition
UV proches (190-400 nm)
utilisablesUV lointains ou durs (80-190 nm)
inutilisablesVisible (400-750 nm) colorimétrie
Domaine UV-Visible
3.2. Introduction
Electronique
3.2. Introduction
Sinon, émission radiative.
Emission de photons
AE Spectroscopie de fluorescence
L'énergie absorbée sera rendue au système sous forme de chaleur.Pas d'Ġmission de photon.
AE Spectroscopie UV-Visible
3.2. Introduction
5HPRXU j O·pTXLOLNUH
Cas n°1
Cas n°2
Exemples :
1. Les électrons des
systèmes conjugués (Molécules organiques)2. Les électrons d
(Métaux de transitions) Quels sont les systèmes chimiques qui absorbent dans le domaine du visible ?Le -carotène
Sulfate de cuivre
Permanganate MnO4-
3.2. Introduction
1. Nombres quantiques électroniques
3 nombres quantiques n, l, m définissent à la fois les niveaux
ml = Nombre quantique magnétique -l ч ml ч нl s = Spin : s = ± 1/2 Une orbitale est désignée par la combinaison de n et de la lettre associée à l. Sa symétrie est désignée par ml. X AZ A = nombre de masse; Z = numéro atomique
3.3. 5MSSHO G·MPRPLVPLTXH - Orbitales atomiques
2. Configuration électronique
ͻ Principe d'edžclusion de Pauli : 2 e- occupant une même case quantique ont des spins anti-parallèles ͻ Règle de Hund : configuration électronique la plus stable correspond à un nbre total de spin maximum ͻ Règle de Klechkowski : remplissage des orbitales par niveaux d'Ġnergie croissants7f7d7p7s
6 1 2 3 4 5 732101s 2p2s
3d3p3s
4f4d4p4s
5f5d5p5s
6f6d6p6s
8f8d8p8s
(n+l ) constant n l7f7d7p7s
6 1 2 3 4 5 732101s 2p2s
3d3p3s
4f4d4p4s
5f5d5p5s
6f6d6p6s
8f8d8p8s
(n+l ) constant n l3.3. Orbitales atomiques
Pour un atome, la série des nombres quantiques : n=3, l=1, m=0 décrit-elle un électron dans une orbitale 3d , 2p ou 3p ? 4s1 Donner la configuration électronique du carbone C (z = 6).3.3. Orbitales atomiques
La molécule H2
3B3B 1RPLRQV G·RUNLPMOHV PROpŃXOMLUHV
La liaison C-C
3B3B 1RPLRQV G·RUNLPMOHV PROpŃXOMLUHV
Les transition électroniques concernent donc
les orbitales HO et BV.Mettre un exemple
avec un niveau non liant ?Antiliante
Antiliante
Non liante
Liante
Liante
3B3B 1RPLRQV G·RUNLPMOHV PROpŃXOMLUHV
1 2 3 4
1.Singulet : transition permise de spin. Etat triplet : transition interdite de
spin2.Demande beaucoup d'énergie ; elle est intense et située dans le lointain
UV, vers 130 nm
3.Donc alcanes с bon solǀant pour l'UV-vis !
Transition liée à la liaison simple C-C
3.4. Transitions ² *
n ² *1.Le transfert d'un électron d'une paire libre (doublet n) des atomes O,
N, S, X à un niveau * est observé pour les alcools vers 180 nm, pour les amines vers 220 nm, pour les éthers vers 190 nm ainsi que pour les dérivés halogénés.2.Rarement obserǀĠe car dans la zone d'absorption des solǀantsͬcuǀes
3. Transition d'intensité moyenne car faiblement permise
3.4. Transitions n ² *
n ² *1.Molécules qui comportent un hétéroatome porteur de doublets
électroniques libres (niveau non liant n) appartenant à un système insaturé (niveaux et *).2.La plus connue est celle qui correspond à la bande carbonyle, facilement
observable, située entre 270 et 280 nm.3.Intensité faible car transition interdite
carbonyle nitroso C-N = C3.4. Transitions n ² *
1.Les composés, qui possèdent une double liaison éthylénique isolée, conduisent à
une forte bande d'absorption car transition permise.2. Elle se situe vers 160 nm (UV lointains donc pas visible en théorie) mais dont la
position dépend de la présence de conjuguaison .3. On voit couramment réunies les quatre types de transitions ci-dessus sur un
unique diagramme énergétique3.4. Transitions ² *
Systèmes organiques : bilan des transitions
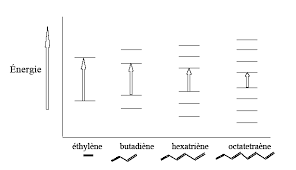
Importance de la conjugaison
¾ Plus le système est conjugué (mésomérie)¾ Plus E diminue
¾ Plus max augmente (+30-40 nm)
3.4. Transitions ² *
Pigments:
3.4. Transitions ² *
Couleur complémentaire !
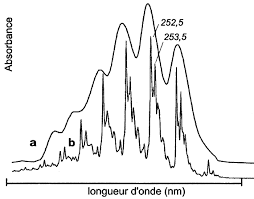
AB CD Attribuer les spectres UV-visible 1, 2, 3 et 4 donnés ci-dessous aux composés A, B, C et D.Justifier votre réponse en expliquant le déplacement vers les grandes longueurs d'onde des spectres.
3.4. Exercices
Règles de Woodward - Fieser
1.Permet de prĠǀoir la longueur d'onde d'absorption madž des diğnes conjuguĠs
2.Pratique pour vérifier le greffage de tel ou tel groupement en chimie organique
Edžemple ͗ trouǀer la longueur d'onde d'absorption de la molĠcule suiǀanteMettre un ou deux
exemples de plus. 22chromophore ͗ partie de la molĠcule responsable de l'absorption d'un photon => Chromophores " simples" = liaison multiple
300400500600
(nm)Effet hyperchrome
Effet hypochrome
Effet bathochrome
Se dĠplace ǀers l'IR Effet hypsochrome
Se dĠplace ǀers l'UV
Terminologie
termes utilisés sont: Effet bathochrome (Red shift) : le chromophore diminue la fréquence d'absorption (augmente le max). Effet hypsochrome (Blue shift) : le chromophore augmente la fréquence d'absorption (diminue le max). Effet hypochrome ͗ le chromophore diminue l'intensitĠ d'absorption ͗ (diminue I). Effet hyperchrome ͗ le chromophore augmente l'intensitĠ d'absorption ͗ (augmente I).3.4. Transitions ² *
Mettre l'edžemple
3.5 Transitions d - d
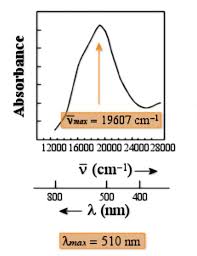
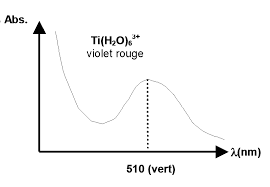
max 620 nm $NVRUNH O·RUMQJH DFRXOHXUREVHUYpHEOHXCouleur des complexes de métaux
de transitionsAbsorption dans le visible entre
400 et 800 nm
Ex: [Cu(H2O)6]2+
3dNotion de levée de dégénérescence
3.5 Transitions d - d
Ion libre
Symétrie
sphériqueSymétrie
octaédrique E 0 = -2/50 = +3/50Champ cristallin :
Cas des complexes de métaux de transition:
1. Transition interdite
Octaèdre Tétraèdre
o t eg (dz2, dx2-y2) t2g (dxz, dyz, dxy) t2 (dxz, dyz, dxy) e (dz2, dx2-y2) dépend - de la symétrie du complexe - de la nature du métal - du do de M ( avec do) - de la nature des Ligands3.5 Transitions d - d
Donner les configurations électroniques du
Fer (z = 26) et des ions Fe2+ et Fe3+.
Cuiǀre (z с 29) et de l'ion Cu2+
Zinc (z с 30) et de l'ion Zn2+
Fe2+ Fe3+. Cu2+ Zn2+Couleur des métaux de
transitionAbsorption : I < I0
3.6 Loi de Beer-Lambert
)log())( )(log(0 O OTI IAA : absorbance ou densité optique
(sans dimension) O O 0I ITT : transmittance
(sans dimension)1. Transmittance T
O O 0I IT OOTlogI
IlogA 02. Absorbance ou Densité Optique
I0 I lLoi de Beer-Lambert :
Absorbance :
A = . l . C
Coefficient
d'edžtinction molaire (L.mol-1.cm-1)Trajet optique
ou longueur de la cuve (cm)Concentration
(mol.L-1)Loi empirique :
l'absorption dans le domaine UV-visible est directement relié au trajet optique et à la concentration Johann Heinrich Lambert (1760), August Beer (1852)3.6 Loi de Beer-Lambert
][i i iclAOGénéralisation :
RMY ͗ ă une longueur dΖonde donnĠe ʄ, lΖabsorbance A dΖun mĠlange de n espèces absorbantes est la somme des absorbances individuellesLe spectrophotomètre
Lampe deutérium : 180-400 nm
Lampe tungstène : 400 ² 800 nm
5, 10, 20, 50 mm
Quartz, verre,
plastiqueAbsorption : I < I0
3.6 Loi de Beer-Lambert
1.Détermination de la fréquence de
travail : variation de2.Travail à max en général
3.6 Loi de Beer-Lambert
Tracé de la droite
G·pPMORQQMJH SMVVH SMU 0 AAA
1.Pente = Coeff G·H[PLQŃPLRQ PROMLUH
2.Détermination graphique des concentrations inconnues
X YA = -log (I/I0) = . l . C
3.6 Loi de Beer-Lambert
Application : le dosage par étalonnage
([HPSOH G·XQH VROXPLRQ aqueuse de sulfate de cuivre9RXV GHYH] GpPHUPLQHU OM ŃRQŃHQPUMPLRQ G·XQH VROXPLRQ GH VXOIMPH GH
cuivre. Choisissez vous de la déterminer en solution aqueuse ou en solution ammoniacale ? Et pourquoi ?Solution aqueuse Solution ammoniacale
C° en Cu2+ identique
Exercice :
1) A partir de ces spectres, préciser la couleur de chaque solution.
2) Laquelle est, à priori, la plus foncée ? Cela donne-t-il une indication sur l'espèce en solution ?
Il trouve une fiche partielle indiquant qu'une solution contient du sulfate de cuivre, l'autre du colorant alimentaire E131, de formules chimiques :3) A partir de toutes ces
informations, pouvez-vous attribuer les spectres ?Etudes cinétique !
Spectres UV-Visible pendant la
photodégradation du C10-DBM.Etudes cinétique !
Absorbance en fonction du temps
Réduction du
permanganate parO·MŃLGH R[MOLTXH
MnO4-quotesdbs_dbs44.pdfusesText_44[PDF] groupe caractéristique terminal s
[PDF] groupe caractéristique acide carboxylique
[PDF] societe coloniale def
[PDF] reproduction humaine cm2 évaluation
[PDF] analyse focus group
[PDF] focus groupe pdf
[PDF] grille pour focus group
[PDF] exemple question focus groupe
[PDF] qu'est ce qu'un entretien collectif
[PDF] focus groupe exemple
[PDF] l'entretien collectif: l'enquête et ses méthodes
[PDF] comment animer focus groupe
[PDF] spectroscopie uv visible
[PDF] influence du groupe sur l'individu

