 SV Concours
SV Concours
26 февр. 2020 г. spectroscopie : ... UV / Visible Infra-Rouge
 Spectroscopie UV-Visible
Spectroscopie UV-Visible
Spectroscopie : Etude des interactions entre la matière et un rayonnement ε ➚ : effet hyperchrome ε ➘ : effet hypochrome. Conjugaison; mais aussi ...
 Chapitre XI Transitions électroniques Spectroscopie UV-visible 1
Chapitre XI Transitions électroniques Spectroscopie UV-visible 1
Enfin un effet hyperchrome augmente ε un effet hypochrome le diminue. 4.5. Aspect des spectres : raies
 chap.I master Spectr. UV
chap.I master Spectr. UV
SPECTROSCOPIE D'ABSORPTION. DANS L'UV-VISIBLE. CHAPITRE I : PLAN. CHAPITRE II + effet hyperchrome sur la bande π → π*. Même effet observé sur la ...
 Chapitre III-Spectroscopie dabsorption dans lUV-visible
Chapitre III-Spectroscopie dabsorption dans lUV-visible
Il en découle un effet bathochrome et un effet hyperchrome sur la bande d'absorption correspondant à la transition π → π*. Composé λmax εmax. Ethylène. 165.
 Intérêt de la méthode des ajouts dosés en spectroscopie UV-Visible
Intérêt de la méthode des ajouts dosés en spectroscopie UV-Visible
26 апр. 2023 г. une influence sur les propriétés d'absorption et un effet hyperchrome dans le cas de HCl et l'eau par rapport à H2SO4. 9 Dans le cas des ...
 CHAPITRE I-spectroscopie dabsorption UV-visible
CHAPITRE I-spectroscopie dabsorption UV-visible
portés par un chromophore C=C ou C=O donnent des effets bathochrome et hyperchrome. V.3 - Effet de la conjugaison. L'enchaînement d'insaturations entraîne la
 8 Chapitre II - SPECTROSCOPIE DABSORPTION DANS LUV
8 Chapitre II - SPECTROSCOPIE DABSORPTION DANS LUV
portés par un chromophore C=C ou C=O donnent des effets bathochrome et hyperchrome. V.3 - Effet de la conjugaison. V.3.1 - Composés éthyléniques. L'enchaînement
 Chapitre 2 : Spectroscopie ultraviolet/visible
Chapitre 2 : Spectroscopie ultraviolet/visible
Remarque : On utilise également l'effet hyperchrome et l'effet hypochrome si on résonne par rapport à Є (coefficient d'absorption molaire). Effet
 3. Spectroscopie UV-Visible
3. Spectroscopie UV-Visible
Effet hyperchrome : le chromophore augmente l'intensité d'absorption : (augmente I). 3.4. Transitions π – π*. Mettre d'un e. Page
 [PDF] 3 Spectroscopie UV-Visible - LCMCP
[PDF] 3 Spectroscopie UV-Visible - LCMCP
Effet hyperchrome : le chromophore augmente l'intensité d'absorption : (augmente I) 3 4 Transitions ? – ?* Mettre d'un e Page
 [PDF] CHAPITRE I-spectroscopie dabsorption UV-visible
[PDF] CHAPITRE I-spectroscopie dabsorption UV-visible
Effet hypsochrome : déplacement des bandes d'absorption vers les courtes longueurs d'onde ? Effet hyperchrome : augmentation de l'intensité d'absorption
 [PDF] Chapitre 2 : Spectroscopie ultraviolet/visible
[PDF] Chapitre 2 : Spectroscopie ultraviolet/visible
La spectroscopie UV-Visible est la plus ancienne et la plus utilisée des méthodes d'analyse Effet hyperchrome: augmentation de l'intensité d'absorption
 [PDF] Spectroscopie UV-Visible - L3 Chimie Dijon
[PDF] Spectroscopie UV-Visible - L3 Chimie Dijon
Spectroscopie d'absorption UV-Visible Spectroscopie : Etude des interactions entre la matière et un rayonnement ? ? : effet hyperchrome
 [PDF] INTRODUCTION A LA SPECTROSCOPIE - EST Fkih Ben Salah
[PDF] INTRODUCTION A LA SPECTROSCOPIE - EST Fkih Ben Salah
Substituants à effet mésomère (auxochromes) OH -OR -X -NH2 portés par un chromophore C=C ou C=O : Effets bathochrome et hyperchrome
 [PDF] Spectroscopie UV-Visible
[PDF] Spectroscopie UV-Visible
La spectroscopie d'absorption dans l'UV et le visible est basée sur la propriété des molécules Effet hyperchrome : Augmentation de l'absorbance
 [PDF] Cours_Spectrophotométrie UV-VISIBLE
[PDF] Cours_Spectrophotométrie UV-VISIBLE
Effet hyperchrome: augmentation de l'intensité d'absorption L'analyse quantitative par la spectrométrie UV-visible est très employée (beaucoup
 [PDF] Chapitre XI Transitions électroniques Spectroscopie UV-visible 1
[PDF] Chapitre XI Transitions électroniques Spectroscopie UV-visible 1
Enfin un effet hyperchrome augmente ? un effet hypochrome le diminue 4 5 Aspect des spectres : raies bandes et structure fine
 [PDF] SPECTROSCOPIE MOLECULAIRE Introduction
[PDF] SPECTROSCOPIE MOLECULAIRE Introduction
La spectroscopie d'absorption dans l'UV et le visible est une méthode très commune Effet hyperchrome : Augmentation de l'absorbance
 Spectroscopie infrarouge - Webjournal Julie Daubié Rombas
Spectroscopie infrarouge - Webjournal Julie Daubié Rombas
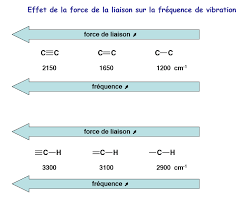
Les trois bandes précédentes subissent un effet hyperchrome ; le subit en outre un effet hypsochrome et les autres un effet bathochrome : 3 Triple liaison carbone–carbone Spectroscopie Infrarouge Page 3 sur 14
Quels sont les effets du chromophore ?
Effet hypsochrome :le chromophore augmente la fréquence d’absorption (diminue le lambdamax). Effet hypochrome :le chromophore diminue l’intensité d’absorption : (diminue varepsilon). Effet hyperchrome :le chromophore augmente l’intensité d’absorption : (augmente varepsilon).
Qu'est-ce que la spectroscopie infrarouge?
Spectroscopie infrarouge Spectroscopie infrarouge Les transitions énergétiques se font ici entre les niveaux d’énergie de rotation des molécules ou entre leurs niveaux d’énergie de vibration. Les transitions entre niveaux de rotation apparaissent dans l’I.R. lointain (de 20 à 250 µm ou de 500 à 40 ).
Comment calculer la spectrophotométrie d’absorption moléculaire ?
Spectrophotométrie d’absorption moléculaire Uv – Visible Les spectres Caractéristiques générales Spectres de bandes : A = f(lambda) niveaux d’énergie électronique Zone spectrale : UV: 100 à 400 nm en pratique, on travaille à partir de 200 nm, car les UV sont absorbés par l’O2 de l’air et par le matériel ( cuve de mesure) Visible: 400 à 800 nm
Qu'est-ce que la spectrophotométrie UV-visible ?
spectrophotométrie Uv-Visible est la technique spectroscopique implique l'interaction des substances avec les rayonnements ultra-violet et visible Skip to content Chimie Analytique Analyse chimique en main Menu Accueil Chimie en solution Les concentrations en chimie Eléctrochimie Chromatographie Eléctrophorèse Spéctroscopie Quiz Contact Search for:
Spectroscopie
Spectroscopie
UV-Visible
UV-Visible
Pr. Franck DENAT
ICMUB UMR 5260
9, Av. Alain Savary
BP 47870 21078 Dijon
Franck.Denat@u-bourgogne.fr
Spectroscopie d'absorption UV-Visible
I. Introduction.
Spectroscopie : Etud e des interaction s entre la m atière et un rayonnementélectromagnétique.
Une molécule absorbera une radiation d e fréquence ν sʼil existe des transitions nécessitant une énergie : ΔE = hν (h = 6,63 10 -34Js, cte de Planck)
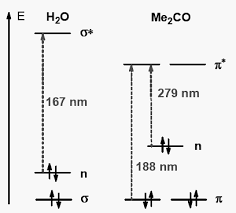
Absorption dʼun rayonnement dans le domaine de lʼUV-Visible : excitation dʼélectrons de valence. E excité E fondamentalΔE = hν = hc/λ = hcν
ν : fréquence
λ : longueur dʼonde
ν : nombre dʼonde
II. Le spectre électromagnétique
Excitation dʼélectrons de valence
190-400 nm : proche UV
400-700 nm : Visible
700-1100 nm : très proche IR
Transitions entre niveaux vibrationnels
Modification dʼétats de spin électroniqueRésonance Paramagnétique Electronique
Modification dʼétats de spin nucléaire
Résonance Magnétique Nucléaire
- dans un atome : lʼabsorption du rayonnement donne naissance à une seule raie spectraleII. Absorption moléculaire, spectre de bandes
Etat d'énergie excité
Etat d'énergie fondamental
Transition électronique
- dans une molécule : les ≠ états électroniques ont des domaines énergétiques larges, dus aux niveaux vibrationnels et rotationnels : E totale = Eélectronique
+ E vibrationnelle + E rotationnelle ERapport ≈ 1000:50:1
G spectre de bandes
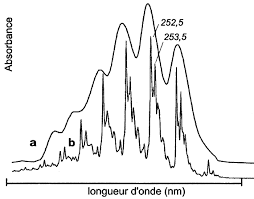
Ex : spectre du benzène a) en solution , b) à lʼétat de vapeur (structure fine) - large domaine dʼapplications (Chimie minérale, organique, biochimie),90% des analyses médicales
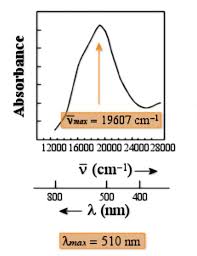
- analyses quantitatives (loi de Beer-Lambert) - grande sensibilité : limite de détection ≈ 10 -5 M - précision : 1 - 5% erreur - simplicité, rapidité. Le spectre UV-Visible est le tracé de A (absorbance) en fonction de λ (en nm)Bande dʼabsorption caractérisée par :
sa position λ max (nm) et son intensité ε max (L.mol -1 .cm -1 ) ou coefficient dʼabsorption molaireLoi de Beer-Lambert :
A="lc =log
I 0 I =log 1 T I o I l : parcours optique (cm)échantillon concentration c (mol.L
-1T : transmittance
Intérêts de la spectroscopie UV-Visible :
III. Les différents types de transitions
III.1. Dans les composés organiques
-transitions σ G σ* : λ max < 150 nm (UV lointain) -transitions n G σ* : 150 nm < λ max < 250 nm, intensité moyenne (50 < ε < 2000 L.mol -1 .cm -1 -transitions π G π* : λ max > 190 nm (> 400 nm pour systèmes très conjugués), forte intensité (1000 < ε < 10000 L.mol -1 .cm -1 -transitions n G π* : λ max > 190 nm, faible intensité (10 < ε < 100 L.mol -1 .cm -1ChromophoreTransition!maxlog(")
nitrile # to $*160< 1.0
alkyne$ to $*1703.0 alkene$ to $*1753.0 alcohol # to %*1802.5
ether# to %*1803.5 $ to $*1803.0ketone
# to $*2801.5 $ to $*1902.0aldehyde # to $*2901.0
amine# to %*1903.5 acid # to $*2051.5
ester# to $*2051.5 amide# to $*2101.5 thiol # to %*2103.0
nitro# to $*271< 1.0 azo # to $*340< 1.0
Valeurs de λ
max et ε pour quelques chromophores Chromophore : groupement présentant une absorption caractéristique dans lʼUV ou le visibleExemples de spectres de composés organiques
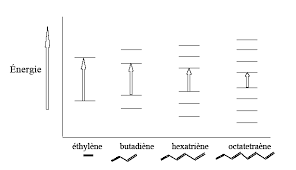
Conjugaison : rapprochement des orbitales π et π* : λ Hλ H : effet bathochrome
λ H : effet hypsochrome
H : effet hyperchrome
ε H : effet hypochrome
Conjugaison; mais aussi :
effets de substituants (NR 2OH, OR, X,...),
effets de solvant (polarité),... Règles de Woodward-Fieser G estimation de λ maxIII.2. Dans les espèces inorganiques
Transitions électroniques entre orbitales d
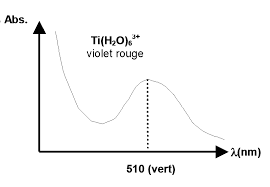
Exemples de spectres de solutions aqueuses
dʼions de métaux de transition : max et ε dépendent de : - la nature du métal - son degré dʼoxydation - son environnement (géométrie, champ de ligand)III.3. Dans les complexes de transfert de charge
Transition électronique dʼun donneur vers un accepteurEx : Fe(III)-thiocyanate
Forte intensité : ε > 10000 L.mol
-1 .cm -1IV. Appareillage
Système dispersif : prisme ou réseau (1200 traits / mm) Spectromètre "monocanal"Spectromètre "multicanaux", à optique inversée détecteur = PM ou photodiode ou barette de diodes lampe W (>350 nm) + lampe D 2 (<350 nm) ( ou lampe Xe pulsé ) IV.1. Spectromètre à simple faisceau monocanalRéseau tournant : balayage
Largeur de fente (bande passante) H G résolution H mais rapport signal/bruit (S/N) HIV.2. Spectromètre à double faisceau
IV.3. Spectromètre multicanaux (à barette de diodes) - spectromètre "lumineux" : S/N élevé - observation "instantanée" de tout le spectre (qques ms) G détecteur HPLC - résolution médiocreV. Préparation des échantillons
Le plus souvent liquides
V.1. Cellules (cuves)
l = 1 à 100 mm (standard 1 cm)Plastique, verre, quartz
V.2. Solvant
- pouvoir de dissolution - transparent dans la zone dʼintérêt - "spectrophotometric grade" : absence dʼimpuretés, agents stabilisants,... - solvants volatils : boucher la celluleExemples dʼapplications:
- mesures en ligne pour le suivi de procédés - mesures dans des environnements contaminés - mesures dans des atmosphères explosives ou radioactives - mesures de cinétiques de réactionsV.3. Sondes à immersion
Fibres optiques
A="lc =log
I 0 I =log 1 TVI. Analyses quantitatives
Loi de Beer-Lambert :
Pente = εl (ε si l = 1 cm)
- Additivité de la loi de Beer-Lambert :Ex: mélange de 2 constituants
1 2 1 lc 1 2 lc 2 = l(ε 1 c 1 2 c 2 c ech. A ech. - Analyse multicomposants : mesure de A à autant de λ ≠ que de constituants dans le mélange Limites de validité de la loi de Beer-Lambert : - solutions diluées (c < 0,01 M) - absence dʼinteractions soluté-solvant - lumière monochromatique (impossible dans lʼabsolu) - influence de la lumière parasite, éviter de travailler à A > 1,5 Les solution étalons doivent avoir une composition voisine de celle des échantillons afin de minimiser les effets des divers constituants (effet de matrice) G Parfois difficile G Méthode des ajouts dosés :On prélève plusieurs fois un volume V
x dʼune solution dʼun échantillon de [ ] c x inconnue, on ajoute un volume croissant V e dʼune solution étalon de [ ] c e V x V e V tΑ= εlc
e V e /V t + εlc x V x /V t = εl/V t c e V e + εl/V t c x V x = aV e + b avec a = εl/V t c e et b = εl/V t c x V x c x b c e a V x point isobestiqueRéaction simple A G B :
A λ du point isobestique, A constant car ε
A B lc A lc B = εl (c A + c B ) = ctequotesdbs_dbs44.pdfusesText_44[PDF] groupe caractéristique terminal s
[PDF] groupe caractéristique acide carboxylique
[PDF] societe coloniale def
[PDF] reproduction humaine cm2 évaluation
[PDF] analyse focus group
[PDF] focus groupe pdf
[PDF] grille pour focus group
[PDF] exemple question focus groupe
[PDF] qu'est ce qu'un entretien collectif
[PDF] focus groupe exemple
[PDF] l'entretien collectif: l'enquête et ses méthodes
[PDF] comment animer focus groupe
[PDF] spectroscopie uv visible
[PDF] influence du groupe sur l'individu
