 Chapitre 3 :Oxydoréduction
Chapitre 3 :Oxydoréduction
• Oxydation : réaction au cours de laquelle une espèce perd un ou plusieurs On considère une réaction d'oxydoréduction qui se produit dans une cellule.
 Les réactions doxydo-réduction
Les réactions doxydo-réduction
➔ Le réducteur d'un couple (noté 1) peut participer à une réaction chimique avec l'oxydant d'un autre couple. (noté 2). ➔ Au cours de cette réaction le
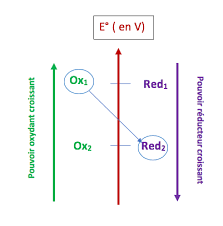 Fiche de synthèse n° 3.c Réactions doxydo-réduction
Fiche de synthèse n° 3.c Réactions doxydo-réduction
1.1. Définitions : Une oxydation est une réaction chimique où il y a perte d'un ou plusieurs électrons. Au cours d'
 Leçon 11 : RÉDUCTION DES OXYDES
Leçon 11 : RÉDUCTION DES OXYDES
-Une réaction d'oxydoréduction est une réaction chimique au cours de laquelle l'oxydation et la réduction se font simultanément. Activité d'application a-Ecris
 Réactions doxydo-réduction
Réactions doxydo-réduction
Interprétation : Au cours de cette transformation. • Le dépôt rouge est du cuivre métallique constitué d'atomes de cuivre de formule Cu
 Chimie analytique 2éme année pharmacie -Les réactions d
Chimie analytique 2éme année pharmacie -Les réactions d
1.2. Définition d'une réaction d'oxydo-réduction : Une réaction d'oxydoréduction est une réaction chimique au cours de laquelle se produit un transfert.
 CHAPITRE 3 : Réactions doxydo-réduction
CHAPITRE 3 : Réactions doxydo-réduction
Au cours de cette oxydation le réducteur se transforme en sa forme conjuguée qui est un oxydant : β Red = α Ox + ne−. • Réduction : gain d'électron(s) par un
 Chimie analytique 2éme année pharmacie -Les réactions d
Chimie analytique 2éme année pharmacie -Les réactions d
1.2. Définition d'une réaction d'oxydo-réduction : Une réaction d'oxydoréduction est une réaction chimique au cours de laquelle se produit un transfert.
 Les réactions doxydoréduction
Les réactions doxydoréduction
>>Une oxydation est une réaction au cours de laquelle des électrons sont produits. >>Une espèce capable de former des électrons au cours d'une réaction d'
 TROISIEME ANNEE CHIMIE : OXYDOREDUCTION COMMENT
TROISIEME ANNEE CHIMIE : OXYDOREDUCTION COMMENT
4) Les couples mis en jeu Au cours de cette réaction sont S FeS. ⁄ et FeS Fe. ⁄ . II. REACTION ENTRE LE CARBONE (C) ET L'OXYDE DE CUIVRE (CuO) : ENONCE : On
 Chapitre 3 :Oxydoréduction
Chapitre 3 :Oxydoréduction
I Réactions d'oxydoréduction. A) En solution aqueuse. 1) Définition. • Oxydation : réaction au cours de laquelle une espèce perd un ou plusieurs électrons.
 Les réactions doxydo-réduction
Les réactions doxydo-réduction
? Le réducteur d'un couple (noté 1) peut participer à une réaction chimique avec l'oxydant d'un autre couple. (noté 2). ? Au cours de cette réaction le
 Cours de chimie en solution Oxydoréduction
Cours de chimie en solution Oxydoréduction
- Equilibrer la charge (électro neutralité de demi-réaction) avec des électrons e - . Fe3+ + 1.e-. Fe2+. Couple (Fe3+/ Fe2+). (+III). (+II).
 Chimie analytique 2éme année pharmacie -Les réactions d
Chimie analytique 2éme année pharmacie -Les réactions d
1.2. Définition d'une réaction d'oxydo-réduction : Une réaction d'oxydoréduction est une réaction chimique au cours de laquelle se produit un transfert.
 Chapitre 6 : Les réactions doxydoréduction
Chapitre 6 : Les réactions doxydoréduction
Nous allons voir dans ce chapitre les réactions d'oxydoréduction est trouver une grande 1) Réaction entre les ions cuivre II et le métal zinc :.
 Chapitre SA-PC&PSI. Seconde période Plan du cours
Chapitre SA-PC&PSI. Seconde période Plan du cours
26 Mar 2017 Dans une réaction d'oxydoréduction un élément chimique perd (oxydation) ou gagne (réduction) des électrons. Le nombre d'oxydation d'un élément ...
 Chapitre 2 : Réactions doxydoréduction
Chapitre 2 : Réactions doxydoréduction
2.4 Equilibre d'oxydoreduction en milieu basique . Les réactions d'oxydoréduction sont des réactions chimiques au cours desquelles il y a un échange d' ...
 Chapitre 4 Oxydo-réduction
Chapitre 4 Oxydo-réduction
Dans une réaction d'oxydoréduction les réactifs sont un oxydant et un réducteur de Au cours de cette réaction
 GÉNÉRALITÉS SUR LOXYDORÉDUCTION
GÉNÉRALITÉS SUR LOXYDORÉDUCTION
22 Feb 2016 Réaction chimique d'oxydoréduction. Réactions d'oxydoréduction
 CHAPITRE 2 : LES REACTIONS DOXYDO-REDUCTION
CHAPITRE 2 : LES REACTIONS DOXYDO-REDUCTION
Une réaction d'oxydo-réduction est une transformation chimique au cours de laquelle il y a un échange d'électrons entre l'oxydant d'un couple
 [PDF] Chapitre 3 :Oxydoréduction - Melusine
[PDF] Chapitre 3 :Oxydoréduction - Melusine
I Réactions d'oxydoréduction A) En solution aqueuse 1) Définition • Oxydation : réaction au cours de laquelle une espèce perd un ou plusieurs électrons
 [PDF] Les réactions doxydo-réduction - Physique - Chimie
[PDF] Les réactions doxydo-réduction - Physique - Chimie
? Au cours de cette réaction le réducteur 1 va libérer 1 ou plusieurs électrons qui seront ensuite captés par l'oxydant 2 exemple : réaction entre le
 [PDF] Chimie - Chapitre 9 : Réactions doxydoréduction Ce quil faut retenir
[PDF] Chimie - Chapitre 9 : Réactions doxydoréduction Ce quil faut retenir
La réaction susceptible de se produire à l'interface met en jeu un couple redox : ? Ox + n e- + x H+ = ? Red + y H2O Potentiel de Nernst d'un couple redox : Le
 [PDF] Chapitre 4 Oxydo-réduction
[PDF] Chapitre 4 Oxydo-réduction
2 Les réactions d'oxydoréduction 2 1 Définition Dans une réaction d'oxydoréduction les réactifs sont un oxydant et un réducteur de deux couples oxydant
 [PDF] COURS-Oxydoreductionpdf
[PDF] COURS-Oxydoreductionpdf
I – REACTIONS D'OXYDOREDUCTION 1-1 Introduction Les réactions d'oxydoréduction sont des réactions dans lesquelles des électrons sont transférés
 [PDF] Cours-Réaction-redoxpdf
[PDF] Cours-Réaction-redoxpdf
? couple d'oxydo-réduction ou couple redox est un couple formé par un oxydant et son réducteur conjugué Oxydant + ne- Réducteur ? Par convention on écrit
 [PDF] Chapitre 6 : Les réactions doxydoréduction - Physagreg
[PDF] Chapitre 6 : Les réactions doxydoréduction - Physagreg
Nous allons voir dans ce chapitre les réactions d'oxydoréduction est trouver une grande 1) Réaction entre les ions cuivre II et le métal zinc :
 [PDF] Chimie analytique 2éme année pharmacie -Les réactions d
[PDF] Chimie analytique 2éme année pharmacie -Les réactions d
1 2 Définition d'une réaction d'oxydo-réduction : Une réaction d'oxydoréduction est une réaction chimique au cours de laquelle se produit un transfert
 [PDF] GÉNÉRALITÉS SUR LOXYDORÉDUCTION
[PDF] GÉNÉRALITÉS SUR LOXYDORÉDUCTION
22 fév 2016 · Réaction chimique d'oxydoréduction Réactions d'oxydoréduction Potentiel d'électrode et oxydoréduction Titrages par oxydoréduction COURS
 [PDF] [PDF] 1 Généralités sur loxydo-réduction
[PDF] [PDF] 1 Généralités sur loxydo-réduction
2 2 Loi de Nernst et sens d'évolution d'une réaction d'oxydo-réduction Ce cours fait partie du programme de préparation aux 51me Olympiades
Comment définir une réaction d'oxydoréduction ?
Une réaction d'oxydoréduction est une réaction qui implique un échange d'électrons entre des réactifs. De nombreuses transformations chimiques impliquent le transfert d'un ou de plusieurs électrons d'un atome à un autre.Comment savoir qui est l'oxydant et qui est le réducteur ?
Pour savoir qui est l'oxydant et le réducteur , en utilise cette définition : La substance qui perd des électrons est oxydée et est le réducteur. La substance qui gagne des électrons est réduite et est l'oxydant .- Pour écrire une équation d'oxydo-réduction il faut donc commencer par écrire les deux demi équations puis de les combiner pour former l'équation complète en vérifiant que le nombre d'électrons perdus lors de l'oxydation corresponde au nombre d'électrons gagnés lors de la réduction.
0+13'+1,
*!4 %*!$4 4 +0 dd+-®1 ,*,4,*!!* 2*)* 1 0 +(+((5 2 1Î &100 326&1 7276
&1*** ba. =´+´.1&1&ba (&10* 26
&1* 2766
*8 971*
&1839&1276&&12766& &182:66 +=+7% 3 +&1+=+73=&12766& &1+=+723:6& '1
323666
+=+73>7390 32+33+0+
'*$,2?&@*$,, )$,0'&'0&+++ +=+ba
ABA*$&1
*=´D '0&a=+&b++'0+ '7666 76603636
>0+' '09 99
&101+&1&1' =´D+´D+´D baba aba -,4(*!! 2(: -,4($4 ,44,;& ,,4& 9 +6 -*4Û4Û
21++®+-+
-*;4ÛÛ21-++®+CC+
-6C+34+3&9+7+34(
74C+3&
1++1CC+®+++
1+1*&-((D*&-(CC-+-+-+
E*)"E1'0
03%0+103%0+0+%0+
+033+720+13+0+
$1+= 11FG '00+1*&-(0$(0+-+=
4( '02(:1*2H!*,'0
%#23!*I, %#1$3 %#2J!*K, %#,1$J L M*' &&�&&& +=++++-gba gba#101&&& 11 1 1 %)N 25(9O&D 7&*7 *D M2
2P>95L&*7
M**!2+LQ2+P5(LD
gbag ba#101&&&1LPL(L(+P51#101&&&
1L(+P51
P5(LD+):LPL(
-*4,3%03%0+
-,4, **1 [][]====+-DRD1+ 0 ++1%0370++13+72+013+7 +++L):+95( (ST+>( %00+ %00%00 +1++1++1+ *M3%M+3SMTSTM(>:==(+
DL(+P51%MM
+%M M+ 1!$& +%#+,43#+2#3
+U M*4), %#$3 37V#&+%#+$J #+V +3+7& 3#+V +3#& 44
*4& 1$* #1 1>( +=ba *$& *W*(+*$& N +>($&-+=(,X *W* *897%8+3(+3%
8973L7350
328+33+0+
+33+72$+8973L13>0
32+8+33L+33+90+
%8%8++9++-= 1>( 8%8+ 8%8 9 L+ 8%8 9L+++ %%++5 98%88%8
%++8%98++9+ 9++ 9+++5 +9+9111>( 1$(A1>(11S8TS0TS8T>(ST>(1S0TS8TSTS8T1ST+>(S8TS0ST8TL>( 44,$1>( 8%8 %8%8%8%8
111>(++9++9++9
1Û*1
5 4*!3#+1372
+3#137 1>( +L1 *X, 3#+V +3#4& !Y*!(4DI9 >(9´>-& :+9(´>D
%1* *M3%M+3XM
3372M+3
SMTSMT(>:==(+
%MM+ **M 3 %MM%MM+ %MM%MM+SMTSMT>(MM++++++++>Û>=-Û>++
*W*(M+3* %MM%MM+ .),4 M3%M+3:==(
%MM+ 93%3:=9( 9=++ 6,* 93M+3
"4147933M+3VM 33
3 P ZS8TS8TL>(P>(5
S8TS8TL>(S8TS0ST8TL>(+9
8%8+ 9 8%8+ 5 9 :L(8%88%8
9+ 9+ 9+9 P>(*88%88%89+9+9->Û+-+--
**J 1-P M" P>(8%8+9-=+-!!
K((,89767&
I((,8+36+&
*4* ba#1 1>( 1 *4 4 *(4 +M666%M66* []+99M1''>MM1''>M+==+==+--+-
[][]---+-+=+=+9M1'M1'MM
M66%M661[][]--==9
>M1'M66M1'M66666M666%M%MM+
%MM66M666%M+
66M666%M+
%MM+66M666%M+
%MM >M1'[]-9 >M1'· ,$,'7
M3367VM+336+
· ,'7*
M666M661
XTM1'>S9736+VTM1'>S
7367$*M666%TM1'>S 7* 4
M666%TM1'>S
7*"esdbs_dbs14.pdfusesText_20[PDF] réaction d'oxydoréduction exemple
[PDF] réaction d'oxydoréduction exercices corrigés
[PDF] réaction d'oxydoréduction exercices corrigés pdf
[PDF] réaction d'oxydoréduction fe2+/fe3+
[PDF] réaction d'oxydoréduction pdf
[PDF] réaction de fission def
[PDF] réaction de fission du plutonium 239
[PDF] réaction de fission exemple
[PDF] réaction de fission nucléaire définition
[PDF] réaction de fission uranium 235
[PDF] réaction de la fermentation alcoolique
[PDF] réaction de la fermentation lactique
[PDF] réaction de la glycolyse
[PDF] réaction de la peau au soleil
