 Chapitre 3 :Oxydoréduction
Chapitre 3 :Oxydoréduction
• Oxydation : réaction au cours de laquelle une espèce perd un ou plusieurs On considère une réaction d'oxydoréduction qui se produit dans une cellule.
 Les réactions doxydo-réduction
Les réactions doxydo-réduction
➔ Le réducteur d'un couple (noté 1) peut participer à une réaction chimique avec l'oxydant d'un autre couple. (noté 2). ➔ Au cours de cette réaction le
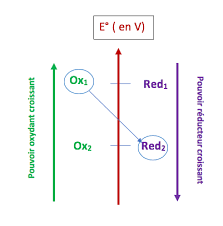 Fiche de synthèse n° 3.c Réactions doxydo-réduction
Fiche de synthèse n° 3.c Réactions doxydo-réduction
1.1. Définitions : Une oxydation est une réaction chimique où il y a perte d'un ou plusieurs électrons. Au cours d'
 Leçon 11 : RÉDUCTION DES OXYDES
Leçon 11 : RÉDUCTION DES OXYDES
-Une réaction d'oxydoréduction est une réaction chimique au cours de laquelle l'oxydation et la réduction se font simultanément. Activité d'application a-Ecris
 Réactions doxydo-réduction
Réactions doxydo-réduction
Interprétation : Au cours de cette transformation. • Le dépôt rouge est du cuivre métallique constitué d'atomes de cuivre de formule Cu
 Chimie analytique 2éme année pharmacie -Les réactions d
Chimie analytique 2éme année pharmacie -Les réactions d
1.2. Définition d'une réaction d'oxydo-réduction : Une réaction d'oxydoréduction est une réaction chimique au cours de laquelle se produit un transfert.
 CHAPITRE 3 : Réactions doxydo-réduction
CHAPITRE 3 : Réactions doxydo-réduction
Au cours de cette oxydation le réducteur se transforme en sa forme conjuguée qui est un oxydant : β Red = α Ox + ne−. • Réduction : gain d'électron(s) par un
 Chimie analytique 2éme année pharmacie -Les réactions d
Chimie analytique 2éme année pharmacie -Les réactions d
1.2. Définition d'une réaction d'oxydo-réduction : Une réaction d'oxydoréduction est une réaction chimique au cours de laquelle se produit un transfert.
 Les réactions doxydoréduction
Les réactions doxydoréduction
>>Une oxydation est une réaction au cours de laquelle des électrons sont produits. >>Une espèce capable de former des électrons au cours d'une réaction d'
 TROISIEME ANNEE CHIMIE : OXYDOREDUCTION COMMENT
TROISIEME ANNEE CHIMIE : OXYDOREDUCTION COMMENT
4) Les couples mis en jeu Au cours de cette réaction sont S FeS. ⁄ et FeS Fe. ⁄ . II. REACTION ENTRE LE CARBONE (C) ET L'OXYDE DE CUIVRE (CuO) : ENONCE : On
 Chapitre 3 :Oxydoréduction
Chapitre 3 :Oxydoréduction
I Réactions d'oxydoréduction. A) En solution aqueuse. 1) Définition. • Oxydation : réaction au cours de laquelle une espèce perd un ou plusieurs électrons.
 Les réactions doxydo-réduction
Les réactions doxydo-réduction
? Le réducteur d'un couple (noté 1) peut participer à une réaction chimique avec l'oxydant d'un autre couple. (noté 2). ? Au cours de cette réaction le
 Cours de chimie en solution Oxydoréduction
Cours de chimie en solution Oxydoréduction
- Equilibrer la charge (électro neutralité de demi-réaction) avec des électrons e - . Fe3+ + 1.e-. Fe2+. Couple (Fe3+/ Fe2+). (+III). (+II).
 Chimie analytique 2éme année pharmacie -Les réactions d
Chimie analytique 2éme année pharmacie -Les réactions d
1.2. Définition d'une réaction d'oxydo-réduction : Une réaction d'oxydoréduction est une réaction chimique au cours de laquelle se produit un transfert.
 Chapitre 6 : Les réactions doxydoréduction
Chapitre 6 : Les réactions doxydoréduction
Nous allons voir dans ce chapitre les réactions d'oxydoréduction est trouver une grande 1) Réaction entre les ions cuivre II et le métal zinc :.
 Chapitre SA-PC&PSI. Seconde période Plan du cours
Chapitre SA-PC&PSI. Seconde période Plan du cours
26 Mar 2017 Dans une réaction d'oxydoréduction un élément chimique perd (oxydation) ou gagne (réduction) des électrons. Le nombre d'oxydation d'un élément ...
 Chapitre 2 : Réactions doxydoréduction
Chapitre 2 : Réactions doxydoréduction
2.4 Equilibre d'oxydoreduction en milieu basique . Les réactions d'oxydoréduction sont des réactions chimiques au cours desquelles il y a un échange d' ...
 Chapitre 4 Oxydo-réduction
Chapitre 4 Oxydo-réduction
Dans une réaction d'oxydoréduction les réactifs sont un oxydant et un réducteur de Au cours de cette réaction
 GÉNÉRALITÉS SUR LOXYDORÉDUCTION
GÉNÉRALITÉS SUR LOXYDORÉDUCTION
22 Feb 2016 Réaction chimique d'oxydoréduction. Réactions d'oxydoréduction
 CHAPITRE 2 : LES REACTIONS DOXYDO-REDUCTION
CHAPITRE 2 : LES REACTIONS DOXYDO-REDUCTION
Une réaction d'oxydo-réduction est une transformation chimique au cours de laquelle il y a un échange d'électrons entre l'oxydant d'un couple
 [PDF] Chapitre 3 :Oxydoréduction - Melusine
[PDF] Chapitre 3 :Oxydoréduction - Melusine
I Réactions d'oxydoréduction A) En solution aqueuse 1) Définition • Oxydation : réaction au cours de laquelle une espèce perd un ou plusieurs électrons
 [PDF] Les réactions doxydo-réduction - Physique - Chimie
[PDF] Les réactions doxydo-réduction - Physique - Chimie
? Au cours de cette réaction le réducteur 1 va libérer 1 ou plusieurs électrons qui seront ensuite captés par l'oxydant 2 exemple : réaction entre le
 [PDF] Chimie - Chapitre 9 : Réactions doxydoréduction Ce quil faut retenir
[PDF] Chimie - Chapitre 9 : Réactions doxydoréduction Ce quil faut retenir
La réaction susceptible de se produire à l'interface met en jeu un couple redox : ? Ox + n e- + x H+ = ? Red + y H2O Potentiel de Nernst d'un couple redox : Le
 [PDF] Chapitre 4 Oxydo-réduction
[PDF] Chapitre 4 Oxydo-réduction
2 Les réactions d'oxydoréduction 2 1 Définition Dans une réaction d'oxydoréduction les réactifs sont un oxydant et un réducteur de deux couples oxydant
 [PDF] COURS-Oxydoreductionpdf
[PDF] COURS-Oxydoreductionpdf
I – REACTIONS D'OXYDOREDUCTION 1-1 Introduction Les réactions d'oxydoréduction sont des réactions dans lesquelles des électrons sont transférés
 [PDF] Cours-Réaction-redoxpdf
[PDF] Cours-Réaction-redoxpdf
? couple d'oxydo-réduction ou couple redox est un couple formé par un oxydant et son réducteur conjugué Oxydant + ne- Réducteur ? Par convention on écrit
 [PDF] Chapitre 6 : Les réactions doxydoréduction - Physagreg
[PDF] Chapitre 6 : Les réactions doxydoréduction - Physagreg
Nous allons voir dans ce chapitre les réactions d'oxydoréduction est trouver une grande 1) Réaction entre les ions cuivre II et le métal zinc :
 [PDF] Chimie analytique 2éme année pharmacie -Les réactions d
[PDF] Chimie analytique 2éme année pharmacie -Les réactions d
1 2 Définition d'une réaction d'oxydo-réduction : Une réaction d'oxydoréduction est une réaction chimique au cours de laquelle se produit un transfert
 [PDF] GÉNÉRALITÉS SUR LOXYDORÉDUCTION
[PDF] GÉNÉRALITÉS SUR LOXYDORÉDUCTION
22 fév 2016 · Réaction chimique d'oxydoréduction Réactions d'oxydoréduction Potentiel d'électrode et oxydoréduction Titrages par oxydoréduction COURS
 [PDF] [PDF] 1 Généralités sur loxydo-réduction
[PDF] [PDF] 1 Généralités sur loxydo-réduction
2 2 Loi de Nernst et sens d'évolution d'une réaction d'oxydo-réduction Ce cours fait partie du programme de préparation aux 51me Olympiades
Comment définir une réaction d'oxydoréduction ?
Une réaction d'oxydoréduction est une réaction qui implique un échange d'électrons entre des réactifs. De nombreuses transformations chimiques impliquent le transfert d'un ou de plusieurs électrons d'un atome à un autre.Comment savoir qui est l'oxydant et qui est le réducteur ?
Pour savoir qui est l'oxydant et le réducteur , en utilise cette définition : La substance qui perd des électrons est oxydée et est le réducteur. La substance qui gagne des électrons est réduite et est l'oxydant .- Pour écrire une équation d'oxydo-réduction il faut donc commencer par écrire les deux demi équations puis de les combiner pour former l'équation complète en vérifiant que le nombre d'électrons perdus lors de l'oxydation corresponde au nombre d'électrons gagnés lors de la réduction.
Classe de 1èreS Chapitre 6 Chimie
1Chapitre 6 : Les réactions d"oxydoréduction
Introduction :
Nous allons voir dans ce chapitre les réactions d"oxydoréduction est trouver une grande analogie avec les réactions acides bases étudiées précédemment. Ces réactions rédox, sont celles qui permettent les feux d"artifices par exemples ou bien qui expliquent la formation de la rouille. Elles sont aussi très importantes dans le domaine industriel (préparation de métaux par ex).I Exemples de réactions d"oxydoréductions :
1) Réaction entre les ions cuivre II et le métal zinc :
Expérience : On plonge une lame de zinc dans une solution de sulfate de cuivre II (couleur bleue).Observations des élèves :
La partie immergée de la plaque est recouverte d"un dépôt de couleur rouge brique. Caractérisons un des produits formés : a. Bécher + sulfate de cuivre II + poudre de zinc.On agite puis on filtre.
Observations des élèves :
La solution obtenue est incolore.
b. + solution d"hydroxyde de sodium. Observations des élèves : Il se forme un précipité blanc qui se redissout dans un excès d"hydroxyde de sodium.
Ce précipité est caractéristique des ions Zn2+ (on peut faire un témoin avec une solution
de sulfate de zinc) Interprétation :Réactifs : Cu2+ et Zn ; Un des produits : Zn
2+. Le dépôt rouge brique sur la lame de zinc rappelle la couleur du cuivre métal il s"agit du deuxième produit. Pourquoi la solution d"ions cuivre II s"est décolorée ?Ceci est dû au fait que les ions cuivre II constitue le réactif limitant de la réaction, ils ne sont
donc plus présent à la fin de la réaction et ce sont tous transformés en métal cuivre.
Une analogie avec les réaction acide-bases : transfert de particules :Qu"a-t-il pu se passer ?
Pour passer d"ions à des atomes ou inversement il faut qu"il y ait eu transfert de chargesélectriques, des électrons.
On peut dons écrire deux demi-équations électroniques :Zn(s) = Zn2+(aq) + 2 e-
Cu2+(aq) + 2 e- = Cu(s)
)(2 )((s)(aq)2 Zn CuaqsZnCu+++ ®+ Les atomes de zinc ont cédé deux électrons, les ions cuivre II en ont accepté deux.Équation
d"oxydoréduction ou rédoxClasse de 1èreS Chapitre 6 Chimie
22) Définition :
Lors d"une réaction d"oxydoréduction, il y a transfert d"électrons.Remarque :
Les électrons n"existent pas à l"état libre en solution aqueuse. 3) Autre exemple : réaction entre le métal cuivre et les ions argent : Expérience : Dans un erlenmeyer, on verse du nitrate d"argent et on ajoute de la tournure de cuivre.Observations des élèves :
La solution est devenue bleue.
Donc :
Il y a eu production d"ions cuivre II et d"argent métallique. Interprétation :Demi équations électroniques :
Chaque atome de cuivre perd 2 électrons pour se transformer en ion cuivre (II) : Cu (s) = Cu2+(aq) + 2 e- Chaque ion argent gagne 1 électron pour se transformer en atome d"argent : Ag +(aq) + 1 e- = Ag(s)Equation d"oxydoréduction :
Cu(s) + 2Ag+(aq) ®®®® Cu2+ (aq) + 2Ag (s) II Analogie avec les acides et les bases : oxydant et réducteur : Réducteur (analogie à l"acide) :Un réducteur est une espèce chimique
susceptible de céder un ou plusieurs électrons.Ex de réducteur :
le métal zinc Zn (s) = Zn2+(aq) + 2 e- , le métal cuivre Cu(s) = Cu2+(aq) + 2 e- Oxydant (analogie à la base) :Un oxydant est une espèce chimique
susceptible de capter un ou plusieurs électrons.Ex d"oxydant :
Les ions cuivre (II) Cu
2+(aq) + 2 e- = Cu(s) , les ions argent Ag+(aq) + 1 e- = Ag(s)
Couple oxydant/réducteur : Un couple oxydant / réducteur est l"ensemble d"un oxydant et d"un réducteur qui se correspondent dans une demi équation électronique : oxydant + n e- = réducteurEx : Cu
(s) = Cu2+(aq) + 2 e-Le cuivre est un réducteur et l"ion cuivre (II) capable de capter deux électrons est un oxydant.
On dit que l"ion cuivre (II) est l"oxydant conjugué du cuivre ou que le cuivre est le réducteur
conjugué de l"ion cuivre (II).Exercices n°7,12 et 13 p92
Classe de 1èreS Chapitre 6 Chimie
3 III Quels sont les oxydants, quels sont les réducteurs ? Fiche élève 1) Les couples à connaître et leur demi-équation : 2) Reconnaître un réducteur et un oxydant à partir de la classification périodique des éléments : 3)Oxydants et réducteurs de la vie courante :
L"eau de javel est un mélange équimolaire de chlorure de sodium (Na+(aq), Cl-(aq)) et d"hypochlorite de sodium (Na +(aq), ClO-(aq)). Ses propriétés désinfectantes et blanchissantes sont dues aux propriétés oxydantes de l"ion hypochlorite (ClO -(aq)). La production d"énergie dans les cellules sous forme d"ATP s"explique pour des transformations chimiques en chaîne, où interviennent des couples oxydant/réducteur tels que O2(g)/H2O(l) et NAD+/NADH. Dans les muscles, par exemple, en fonctionnement
normal, le glucose est converti en acide pyruvique, lequel est ensuite oxydé en dioxyde de carbone. Lors d"efforts violents (où manque le dioxygène), l"acide pyruvique est réduit par NADH en acide lactique, dont l"accumulation peut entraîner des crampes musculaires. Couple Nom de l"oxydant Nom du réducteur Demi ÉquationH+(aq)/H2(g)
Ion H+ (aqueux) Dihydrogène 2H+(aq)+ 2 e- = H2(g)Mn+(aq)/M(s)
Cation métallique métal Mn+(aq) + n e- = M(s)Fe3+(aq)/Fe2+(aq)
Ion fer (III) Ion fer (II) Fe3+(aq)+ 1 e- = Fe2+(aq)MnO4-(aq)/Mn2+(aq)
Ion permanganate
violet Ion manganèse (II) incolore MnO4-(aq) + 8H+ + 5e- = Mn2+(aq) + 4 H2O
I2(aq)/I-(aq)
diiode Ion iodure I2(aq) + 2 e- = 2I-(aq)S4O62-(aq)/S2O32-(aq)
Ion tétrathionate Ion thiosulfate
S4O62-(aq) + 2 e- = 2 S2O32-(aq
Un grand nombre des réducteurs rencontrés sont des métaux (cuivre, argent, fer, magnésium...) Tous ces éléments se situent dans la partie gauche ou centrale de la classification. Ils ont tendance à céder des électrons. Les principaux oxydants sont des corps simples correspondant à des éléments situés dans la partie droite de la classification (dioxygène, dihalogène). Ces éléments forment facilement des anions en captant des électrons. réducteurs réducteurs oxydantsClasse de 1èreS Chapitre 6 Chimie
4IV Les réactions d"oxydoréduction :
Comme pour les acides et les bases, un oxydant réagit forcément avec un réducteur.Définition :
Une réaction d"oxydoréduction consiste en un transfert d"électrons entre un oxydant d"un couple et un réducteur d"un autre couple. Méthode d"écriture des demi-équations électroniques : a.Oxydant + e- = réducteur
b.Equilibrer tous les atomes autres que O et H.
c. Equilibrer les O en ajoutant des molécules d"eau. d.Equilibrer les H en ajoutant des protons H+.
e. Compléter le nombre d"électrons pour respecter les charges électriques. Méthode pour écrire les réactions d"oxydoréduction : a.On écrit les deux demi équations :
réducteur 1 = oxydant 1 + n1 é
oxydant 2 + n2 é = réducteur 2
b.On s"arrange pour avoir le même nombre d"électrons transférés dans les deux équations :
pour cela, on multiplie par n2 la première et par n1 la seconde : n2 * réducteur 1 = n2 * oxydant 1 + n2 * n1 é n1 * oxydant 2 + n1 * n2 é = n1 * réducteur 2 c. On additionne alors les deux demi équations, les électrons n"apparaissent plus : n1 * oxydant 2 + n2 * réducteur 1 n2 * oxydant 1 + n1 * réducteur 2Exercices n°15,16 et 18 p93
quotesdbs_dbs14.pdfusesText_20[PDF] réaction d'oxydoréduction exemple
[PDF] réaction d'oxydoréduction exercices corrigés
[PDF] réaction d'oxydoréduction exercices corrigés pdf
[PDF] réaction d'oxydoréduction fe2+/fe3+
[PDF] réaction d'oxydoréduction pdf
[PDF] réaction de fission def
[PDF] réaction de fission du plutonium 239
[PDF] réaction de fission exemple
[PDF] réaction de fission nucléaire définition
[PDF] réaction de fission uranium 235
[PDF] réaction de la fermentation alcoolique
[PDF] réaction de la fermentation lactique
[PDF] réaction de la glycolyse
[PDF] réaction de la peau au soleil
