 Synthèse du paracétamol ou de lacétanilide CORRECTION
Synthèse du paracétamol ou de lacétanilide CORRECTION
Synthèse de l'acétanilide : (Groupes impairs). 1)&2) Voir I. 3) Rendement : • On détermine la masse d'acétanilide attendu. Pour cela il faut savoir quel est
 Synthèse du paracétamol ou de lacétanilide
Synthèse du paracétamol ou de lacétanilide
Extraire et exploiter des informations : - sur l'utilisation de réactifs chimiosélectifs. - sur la protection d'une fonction dans le cas de la synthèse
 D.S. n° 1
D.S. n° 1
Dans la synthèse décrite dans la suite on remplacera l'acide éthanoïque par un dérivé de cet acide : l'anhydride éthanoïque. Au lycée
 CORRECTİON DES EXERCİCES – C13
CORRECTİON DES EXERCİCES – C13
Synthèse de l'acétanilide. 1. L'anhydride éthanoïque est corrosif : manipulation avec blouse gants et lunettes de protection. L'aniline est toxique et
 EXERCICE I : SYNTHÈSE DUN FÉBRIFUGE : LACÉTANILIDE ( 4
EXERCICE I : SYNTHÈSE DUN FÉBRIFUGE : LACÉTANILIDE ( 4
SYNTHESE D'UN FÉBRIFUGE … correction. 1.1.a. Montage à reflux : 1.1.b. Le L'acétanilide étant très peu soluble dans l'eau froide il cristallise. 1.1 ...
 TRAVAUX PRATIQUES DE CHIMIE ORGANIQUE FILIERE SMC S5
TRAVAUX PRATIQUES DE CHIMIE ORGANIQUE FILIERE SMC S5
SYNTHESE DE L'ACIDE BENZOIQUE. I-. Principe. La réaction haloforme est une réaction caractéristique des cétones α-méthylées. (R-CO-CH3).Plutôt que d'utiliser la
 QUATRE SATELLITES TERRESTRES ARTIFICIELS PARMI BIEN D
QUATRE SATELLITES TERRESTRES ARTIFICIELS PARMI BIEN D
TS 6 spé. CONTRÔLE DE SCIENCES PHYSIQUES. Durée conseillée : 45 minutes. 12/12/11. Lors de la correction il sera Étape 1 : synthèse de l'acétanilide.
 Corrigé D.S de Spécialité Physique Chimie
Corrigé D.S de Spécialité Physique Chimie
10 déc. 2011 Définir et calculer le rendement de cette synthèse. (3 pts). Le rendement d'une synthèse est le rapport de la masse d'acétanilide obtenue ...
 Thème :
Thème :
Acétanilide. Bilan macroscopique de la synthèse : □ Classe de la réaction (basée sur la comparaison des structures) : Lors de cette transformation chimique le
 Synthèse du paracétamol ou de lacétanilide CORRECTION
Synthèse du paracétamol ou de lacétanilide CORRECTION
TPC15. Chapitre C12 : Sélectivité en chimie organique. Synthèse du paracétamol ou de l'acétanilide. CORRECTION. I. Synthèse du paracétamol : (Groupes pairs).
 Correction dexamen TP Synthèse organique 1.a; Définir les termes
Correction dexamen TP Synthèse organique 1.a; Définir les termes
La réaction de 10 ml l'anhydride éthanoïque avec 5 ml de l'aniline en présence d'acide éthanoïque à 80 Cº conduit à un fébrifuge ( l'acétanilide ). a) C'est
 D.S. n° 1
D.S. n° 1
Étape 1 : synthèse de l'acétanilide. - dans un ballon rodé propre et sec introduire V1 = 15 mL d'acide éthanoïque qui joue ici le rôle de solvant
 A.R.E.
A.R.E.
Deux travaux pratiques sont prévus : la synthèse de chimie organique d'un médicament (3h en salle TP CHIMIE : SYNTHESE D'UN MEDICAMENT - L'ACETANILIDE.
 Thème :
Thème :
Acétanilide ;. • Acide acétylsalicilique ;. • Paracétamol. • CONTEXTUALISATION DES SYNTHESES ORGANIQUES. • PISTES D'EXPLOITATION AVEC LES ELEVES. • COMPETENCES
 Synthèse du paracétamol ou de lacétanilide
Synthèse du paracétamol ou de lacétanilide
Synthèse du paracétamol ou de l'acétanilide. Notions et contenus. Compétences exigibles. Sélectivité en chimie organique. Composé polyfonctionnel : réactif.
 EXERCICE I Synthèse dun fébrifuge: lacétanilide (4 points) spécialité
EXERCICE I Synthèse dun fébrifuge: lacétanilide (4 points) spécialité
L'acétanilide C6H5—NH—CO—CH3 fut l'un des premiers fébrifuges (médicaments combattant la fièvre) synthétisé par l'industrie chimique à partir de l'aniline
 Analyse spectrale Spectres IR
Analyse spectrale Spectres IR
Les corrigés sont rédigés par les professeurs de l'association Labolycée. L'autre produit issu de la synthèse de l'aspirine est l'acide éthanoïque de ...
 Untitled
Untitled
Synthèse de l'acétanilide. 9. Synthèse de la benzocaine. 10. Synthèse du savon. 11. Identification des produits obtenus par des méthodes physicochimiques et
 Correction de Contrôle de TP Synthèse Organique
Correction de Contrôle de TP Synthèse Organique
I. Réaction de synthèse : C'est l'étape ou la réaction étudiée a lieu : Dans un solvant choisi
 SYNTHÈSE D’UN FÉBRIFUGE : L’ACÉTANILIDE
SYNTHÈSE D’UN FÉBRIFUGE : L’ACÉTANILIDE
SYNTHÈSE D’UN FÉBRIFUGE : L’ACÉTANILIDE L’acétanilide C 6 H 5 — NH — CO — CH 3 fut l’un des premiers fébrifuges (médicaments combattant la fièvre) synthétisé par l’industrie chimique à partir de l’aniline et du vinaigre (solution aqueuse d’acide éthanoïque) C’est un solide blanc
 TPC1 4 Synthèse du paracétamol ou de l’acétanilide - Labo TP
TPC1 4 Synthèse du paracétamol ou de l’acétanilide - Labo TP
2) Réaliser la synthèse du paracétamol ; une synthèse s’effectue en plusieurs étapes : - Synthèse du produit brut - Séparation du produit d’intérêt des autres espèces - Purification par recristallisation - Identification du produit obtenu 3) Calculer le rendement de la réaction ? = masse de produit obtenu
 Synthèse du paracétamol ou de l’acétanilide CORRECTION
Synthèse du paracétamol ou de l’acétanilide CORRECTION
Synthèse du paracétamol ou de l’acétanilide CORRECTION I Synthèse du paracétamol : (Groupes pairs) 1) Il est nécessaire de porter une blouse des lunettes de protection et d’utiliser au maximum la hotte aspirante 2) Pour la purification par recristallisation on dissout le produit brut dans de l’eau chaude Les
 Searches related to synthèse de l acétanilide corrigé PDF
Searches related to synthèse de l acétanilide corrigé PDF
Acétanilide Bilan macroscopique de la synthèse : O O Classe de la réaction (basée sur la comparaison des structures) : Lors de cette transformation chimique le groupe caractéristique amino du réactif principal (aniline) est modifié : il est remplacé par un groupe amide : il s’agit d’une éat ion de substitution
Comment faire la synthèse de l’acétanilide ?
Étape 1 : synthèse de l’acétanilide. dans un ballon rodé propre et sec, introduire V1 = 15 mL d’acide éthanoïque qui joue ici le rôle de solvant, V2 = 15,0 mL d’anhydride éthanoïque, V3 = 10,0 mL d’aniline et quelques grains de pierre ponce ;
Quels sont les bienfaits de l’acétanilide ?
développement photographique (au XIXe siècle). En outre, l’acétanilide a des propriétés analgésiques et réduit la fièvre. Elle se classe dans la même catégorie de médicaments que le paracétamol. Elle est souvent prescrite à de nombreux patients et on la trouve dans la plupart des pharmacies.
Comment fonctionne l'acétanilide ?
Ainsi, il existe des structures de résonance où une charge négative se déplace dans l'anneau, et une autre où elle réside dans l'atome O. En conséquence de cette «asymétrie électronique» -qui vient de la main de l'asymétrie moléculaire-, l'acétanilide il interagit de manière intermoléculaire par des forces dipôle-dipôle.
Qu'est-ce que le Acétanilide ?
Le acétanilide (C8H9NO) est un amide aromatique qui reçoit plusieurs noms supplémentaires: N-acétylarylamine, N-phénylacétamide et acétanil. Il se présente comme un solide inodore sous forme de paillettes, sa nature chimique est l'amide, et en tant que tel peut former des gaz inflammables en réagissant avec des agents réducteurs puissants.
Devoir surveillé n° 1
Exercice 1 : Synthèse d"un fébrifuge : l"acétanilideL"acétanilide C6H5 - NH - CO - CH3 fut l"un des premiers fébrifuges (médicaments combattant la fièvre) synthétisé par
l"industrie chimique à partir de l"aniline et du vinaigre (solution aqueuse d"acide éthanoïque). C"est un solide blanc.
Dans la synthèse décrite dans la suite, on remplacera l"acide éthanoïque par un dérivé de cet acide : l"anhydride éthanoïque.
Au lycée, on prépare l"acétanilide en suivant le protocole suivant.Étape 1 : synthèse de l"acétanilide
- dans un ballon rodé propre et sec, introduire V1 = 15 mL d"acide éthanoïque qui joue ici le rôle de solvant, V2 = 15,0 mL
d"anhydride éthanoïque, V3 = 10,0 mL d"aniline et quelques grains de pierre ponce
- adapter sur le ballon rodé un réfrigérant à boules ; chauffer le ballon au bain-marie à 80°C pendant environ 20 minutes
- retirer le ballon du bain-marie et verser immédiatement par le sommet du réfrigérant 10 mL d"eau sans attendre le
refroidissement en faisant attention aux vapeurs chaudes et acides- lorsque l"ébullition cesse, ajouter 50 mL d"eau froide et agiter à température ambiante jusqu"à apparition des cristaux
- lorsque les premiers cristaux blancs apparaissent, ajouter 50 mL d"eau glacée et refroidir le ballon dans la glace jusqu"à
cristallisation complète - effectuer une filtration sous vide en rinçant à l"eau distillée froideÉtape 2 : purification du produit obtenu
- dans un bécher, faire chauffer environ 50 mL d"eau ; y dissoudre la totalité du produit obtenu lors de l"étape 1
- après dissolution, attendre la cristallisation - effectuer une filtration sous vide - placer le solide obtenu dans une coupelle préalablement pesée - sécher à l"étuve à 90 °C - la masse du produit obtenu est m = 11,6 g.1. Questions à propos du mode opératoire.
1.1. À propos de l"étape 1.
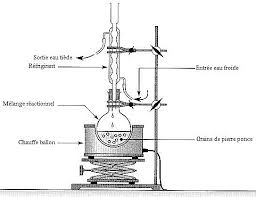
1.1.1. Faire un schéma annoté du montage à reflux. Préciser le sens de circulation de l"eau dans le
réfrigérant.1.1.2. Pourquoi chauffer ? Pourquoi à reflux ?
1.1.3. En utilisant les données de la fin de l"exercice, justifier l"apparition des cristaux blancs après
refroidissement.1.1.4. Quel est l"intérêt d"effectuer une filtration sous vide ?
1.2. À propos de l"étape 2.
Comment appelle-t-on la technique de purification utilisée dans cette étape ?2. À propos de l"acétanilide.
La formule de !"acétanilide, aussi appelée N- phényléthanamide, est donnée ci-contre. Recopier cette formule et entourer le groupe caractéristique amide.3. Rendement de la synthèse.
L"équation de la réaction entre l"aniline et l"anhydride éthanoïque est : aniline + anhydride éthanoïque = acétanilide + A. Dans cette équation, tous les nombres stoechiométriques sont égaux à 1.3.1. Quel est le nom du composé A de l"équation de la réaction ? Réécrire cette équation en utilisant les
formules topologiques (l"aniline, comme l"acétanilide, contient un cycle benzénique).3.2. Calculer les quantités de matière initiales des réactifs.
3.3. Quel est le réactif limitant ? On réalisera un tableau d"évolution du système chimique.
3.4. Quelle masse maximale d"acétanilide peut-on espérer obtenir ?
3.5. Définir et calculer le rendement de cette synthèse.
HN C O CH3 -2-Données :
* L"anhydride éthanoïque réagit violemment avec l"eau à chaud et à froid.Exercice 2 :
formule brute masse volumique en g.mL-1 masse molaire en g. mol -1 solubilité dans l"eau chaude solubilité dans l"eau froide aniline C6H7N 1,02 93 soluble soluble anhydrideéthanoïque C
4H6O3 1,08 102 * *
acétanilide C8H9ON solide 135 soluble très peu soluble acide éthanoïque C2H4O2 1,05 60 très soluble très soluble9. Compléter le chromatogramme ci-dessus en sachant
que : - A correspond au dépôt d"acétate de lynalyle - L correspond au dépôt de limonène - EO correspond au dépôt de l"extrait obtenuAnnexe 1 : à rendre
avec la Front d"éluantLigne de
dépôtA L EO
1.- Représenter le montage d"hydrodistillation.
2.- Préciser la technique du relarguage : produit utilisé et
intérêt.3.- Pourquoi utiliser du cyclohexane comme solvant
d"extraction ? Justifier. Au cours de cette extraction par solvant, pourquoi faut-il agiter l"ampoule à décanter et la purger de temps en temps ?4.- A la fin de l"extraction, représenter l"ampoule à
décanter en précisant la nature des deux phases. Quelle phase faut-il receuillir ? Justifier.5.- Quel est le rôle du carbonate de calcium anhydre ?
Quel autre produit peut aussi jouer ce rôle ?
-3-Correction du D.S. n° 1
Exercice 1 :
Synthèse d"un fébrifuge : l"acétanilide
1. Questions à propos du mode opératoire.
1.1. À propos de l"étape 1.
1.1.1. CHAUFFAGE À REFLUX
1.1.2. Le chauffage permet par l"augmentation de température,
d"accélérer la réaction. Le réfrigérant à boules condensent les vapeurs, ainsi elles retombent dans le milieu réactionnel évitant les pertes de matière et leur dissipation dans le laboratoire.1.1.3. L"acétanilide étant très peu soluble dans l"eau froide, il cristallise.
1.1.4. La filtration sous vide est plus rapide qu"une simple filtration.
1.2. À propos de l"étape 2.
La technique utilisée est appelée recristallisation.2. À propos de l"acétanilide.
groupe caractéristique amide3. Rendement de la synthèse.
3.1. A est de l"acide éthanoïque.
NH2 +O O O NH O +O3.2. V
2 = 15,0 mL d"anhydride éthanoïque
n = mM or m = r.V2 donc n2 = 2.V
M r n2 = 1,08 15,0
102´ = 0,159 mol d"anhydride éthanoïque initialement De même, on trouve pour l"aniline : n1 = 0,110 mol
3.3.équation chimique aniline + anhydride éthanoïque = acétanilide + acide éthanoïque
État du
système Avancement (mol) Quantités de matière (mol)État initial x = 0 0,110 0,159 0 beaucoup
(solvant)En cours de
transformation x 0,110 - x 0,159 - x x beaucoup État final xmax 0,110 - xmax 0,159 - xmax xmax beaucoupSi l"aniline est le réactif limitant, elle est totalement consommée : 0,110 - xmax = 0 , alors xmax = 0,110 mol
Si l"anhydride éthanoïque est le réactif limitant : 0,159 - x max = 0 ; alors xmax = 0,159 mol.Le réactif limitant est celui qui conduit à la valeur de l"avancement maximal la plus faible, il s"agit de
l"aniline et x max = 0,110 mol.3.4. D"après le tableau, nacétanilide = xmax, soit m = xmax.Macétanilide
m = 0,110 ´ 135 =14,9 g
HN C O CH3 -4-3.5. Le rendement de la réaction est défini par h = exp
théo m m où mexp est la masse d"acétanilide obtenue expérimentalement, et m théo est la masse maximale d"acétanilide obtenue si la transformation est totale. h = 11,614,85 = 0,781 = 78,1 % (calcul avec mthéo non arrondie).
Exercice 2 :
Que contient la bergamote
A.-1) Voir TPC1
2) Le relarguage consiste à ajouter à l"hydrodistillat de l"eau
salée afin d"augmenter la densité de la phase aqueuse ; ce qui permet une meilleure séparation des phases.3) Le cyclohexane est à la fois bon solvant du limonène et de l"acétate de linalyle mais aussi très peu
soluble dans l"eau salée donc non miscible. Il faut agiter l"ampoule pour permettre le passage des produits
de la phase aqueuse vers la phase organique. Ce passage s"accompagne de surpressions qu"il faut éliminer
en ouvrant le robinet de l"ampoule.4) On receuille la phase organique du dessus (car d
cyclo < deau salée) car c"est elle qui contient l"acétate de linalyle et le limonène en majorité en raison de leur bonne solubilité dans ce solvant.5) Le carbonate de calcium CaCO
3 (s) est un desséchant qui piège les molécules
d"eau en restant à l"état solide. On peut aussi utiliser le sulfate de magnésium MgSO4 (s).
6) En comparant le réseau de tache de l"extrait obtenu à celui des produits purs
acétate de linalyle et limonène, on pourra savoir si l"extrait les contient ou non.7) Pour la chromatographie : la cuve contenant l"éluant doit être préparée à
l"avance. Les dépôts de produits doivent être concentrés mais de petite taille. La ligne de dépôt doit être au dessus du niveau de l"éluant dans la cuve. Enfin, une fois l"élution commencée, il ne faut plus bouger l"ensemble.8) Les R
f de l"extraits sont proches de ceux du limonène et de l"acétate de linalyle. On peut en déduire que
l"extrait est bien composé de ces deux produits. 9)Annexe 1 : à rendre
avec la Front d"éluantLigne de
dépôtA L EO
quotesdbs_dbs26.pdfusesText_32[PDF] fables de la fontaine théâtre
[PDF] synthèse de laspirine ? partir de lacide salicylique
[PDF] la cigale et la fourmi version theatre
[PDF] synthèse de lacétanilide tp
[PDF] mettre en scène un conte ? lécole
[PDF] synthèse aspirine tp
[PDF] les fables de la fontaine mise en scene par robert wilson
[PDF] schéma narratif le renard et la cigogne
[PDF] le renard et la cigogne analyse des personnages
[PDF] comment les plantes se défendent elles
[PDF] le torrent et la rivière date
[PDF] telecharger e.t l'extra terrestre dvdrip
[PDF] les structures et mécanismes de défense de l'acacia caffra
[PDF] morale du torrent et la rivière
