 Synthèse du paracétamol ou de lacétanilide CORRECTION
Synthèse du paracétamol ou de lacétanilide CORRECTION
Synthèse de l'acétanilide : (Groupes impairs). 1)&2) Voir I. 3) Rendement : • On détermine la masse d'acétanilide attendu. Pour cela il faut savoir quel est
 Synthèse du paracétamol ou de lacétanilide
Synthèse du paracétamol ou de lacétanilide
Extraire et exploiter des informations : - sur l'utilisation de réactifs chimiosélectifs. - sur la protection d'une fonction dans le cas de la synthèse
 D.S. n° 1
D.S. n° 1
Dans la synthèse décrite dans la suite on remplacera l'acide éthanoïque par un dérivé de cet acide : l'anhydride éthanoïque. Au lycée
 CORRECTİON DES EXERCİCES – C13
CORRECTİON DES EXERCİCES – C13
Synthèse de l'acétanilide. 1. L'anhydride éthanoïque est corrosif : manipulation avec blouse gants et lunettes de protection. L'aniline est toxique et
 EXERCICE I : SYNTHÈSE DUN FÉBRIFUGE : LACÉTANILIDE ( 4
EXERCICE I : SYNTHÈSE DUN FÉBRIFUGE : LACÉTANILIDE ( 4
SYNTHESE D'UN FÉBRIFUGE … correction. 1.1.a. Montage à reflux : 1.1.b. Le L'acétanilide étant très peu soluble dans l'eau froide il cristallise. 1.1 ...
 TRAVAUX PRATIQUES DE CHIMIE ORGANIQUE FILIERE SMC S5
TRAVAUX PRATIQUES DE CHIMIE ORGANIQUE FILIERE SMC S5
SYNTHESE DE L'ACIDE BENZOIQUE. I-. Principe. La réaction haloforme est une réaction caractéristique des cétones α-méthylées. (R-CO-CH3).Plutôt que d'utiliser la
 QUATRE SATELLITES TERRESTRES ARTIFICIELS PARMI BIEN D
QUATRE SATELLITES TERRESTRES ARTIFICIELS PARMI BIEN D
TS 6 spé. CONTRÔLE DE SCIENCES PHYSIQUES. Durée conseillée : 45 minutes. 12/12/11. Lors de la correction il sera Étape 1 : synthèse de l'acétanilide.
 Corrigé D.S de Spécialité Physique Chimie
Corrigé D.S de Spécialité Physique Chimie
10 déc. 2011 Définir et calculer le rendement de cette synthèse. (3 pts). Le rendement d'une synthèse est le rapport de la masse d'acétanilide obtenue ...
 Thème :
Thème :
Acétanilide. Bilan macroscopique de la synthèse : □ Classe de la réaction (basée sur la comparaison des structures) : Lors de cette transformation chimique le
 Synthèse du paracétamol ou de lacétanilide CORRECTION
Synthèse du paracétamol ou de lacétanilide CORRECTION
TPC15. Chapitre C12 : Sélectivité en chimie organique. Synthèse du paracétamol ou de l'acétanilide. CORRECTION. I. Synthèse du paracétamol : (Groupes pairs).
 Correction dexamen TP Synthèse organique 1.a; Définir les termes
Correction dexamen TP Synthèse organique 1.a; Définir les termes
La réaction de 10 ml l'anhydride éthanoïque avec 5 ml de l'aniline en présence d'acide éthanoïque à 80 Cº conduit à un fébrifuge ( l'acétanilide ). a) C'est
 D.S. n° 1
D.S. n° 1
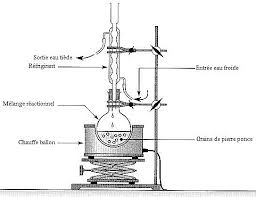
Étape 1 : synthèse de l'acétanilide. - dans un ballon rodé propre et sec introduire V1 = 15 mL d'acide éthanoïque qui joue ici le rôle de solvant
 A.R.E.
A.R.E.
Deux travaux pratiques sont prévus : la synthèse de chimie organique d'un médicament (3h en salle TP CHIMIE : SYNTHESE D'UN MEDICAMENT - L'ACETANILIDE.
 Thème :
Thème :
Acétanilide ;. • Acide acétylsalicilique ;. • Paracétamol. • CONTEXTUALISATION DES SYNTHESES ORGANIQUES. • PISTES D'EXPLOITATION AVEC LES ELEVES. • COMPETENCES
 Synthèse du paracétamol ou de lacétanilide
Synthèse du paracétamol ou de lacétanilide
Synthèse du paracétamol ou de l'acétanilide. Notions et contenus. Compétences exigibles. Sélectivité en chimie organique. Composé polyfonctionnel : réactif.
 EXERCICE I Synthèse dun fébrifuge: lacétanilide (4 points) spécialité
EXERCICE I Synthèse dun fébrifuge: lacétanilide (4 points) spécialité
L'acétanilide C6H5—NH—CO—CH3 fut l'un des premiers fébrifuges (médicaments combattant la fièvre) synthétisé par l'industrie chimique à partir de l'aniline
 Analyse spectrale Spectres IR
Analyse spectrale Spectres IR
Les corrigés sont rédigés par les professeurs de l'association Labolycée. L'autre produit issu de la synthèse de l'aspirine est l'acide éthanoïque de ...
 Untitled
Untitled
Synthèse de l'acétanilide. 9. Synthèse de la benzocaine. 10. Synthèse du savon. 11. Identification des produits obtenus par des méthodes physicochimiques et
 Correction de Contrôle de TP Synthèse Organique
Correction de Contrôle de TP Synthèse Organique
I. Réaction de synthèse : C'est l'étape ou la réaction étudiée a lieu : Dans un solvant choisi
 SYNTHÈSE D’UN FÉBRIFUGE : L’ACÉTANILIDE
SYNTHÈSE D’UN FÉBRIFUGE : L’ACÉTANILIDE
SYNTHÈSE D’UN FÉBRIFUGE : L’ACÉTANILIDE L’acétanilide C 6 H 5 — NH — CO — CH 3 fut l’un des premiers fébrifuges (médicaments combattant la fièvre) synthétisé par l’industrie chimique à partir de l’aniline et du vinaigre (solution aqueuse d’acide éthanoïque) C’est un solide blanc
 TPC1 4 Synthèse du paracétamol ou de l’acétanilide - Labo TP
TPC1 4 Synthèse du paracétamol ou de l’acétanilide - Labo TP
2) Réaliser la synthèse du paracétamol ; une synthèse s’effectue en plusieurs étapes : - Synthèse du produit brut - Séparation du produit d’intérêt des autres espèces - Purification par recristallisation - Identification du produit obtenu 3) Calculer le rendement de la réaction ? = masse de produit obtenu
 Synthèse du paracétamol ou de l’acétanilide CORRECTION
Synthèse du paracétamol ou de l’acétanilide CORRECTION
Synthèse du paracétamol ou de l’acétanilide CORRECTION I Synthèse du paracétamol : (Groupes pairs) 1) Il est nécessaire de porter une blouse des lunettes de protection et d’utiliser au maximum la hotte aspirante 2) Pour la purification par recristallisation on dissout le produit brut dans de l’eau chaude Les
 Searches related to synthèse de l acétanilide corrigé PDF
Searches related to synthèse de l acétanilide corrigé PDF
Acétanilide Bilan macroscopique de la synthèse : O O Classe de la réaction (basée sur la comparaison des structures) : Lors de cette transformation chimique le groupe caractéristique amino du réactif principal (aniline) est modifié : il est remplacé par un groupe amide : il s’agit d’une éat ion de substitution
Comment faire la synthèse de l’acétanilide ?
Étape 1 : synthèse de l’acétanilide. dans un ballon rodé propre et sec, introduire V1 = 15 mL d’acide éthanoïque qui joue ici le rôle de solvant, V2 = 15,0 mL d’anhydride éthanoïque, V3 = 10,0 mL d’aniline et quelques grains de pierre ponce ;
Quels sont les bienfaits de l’acétanilide ?
développement photographique (au XIXe siècle). En outre, l’acétanilide a des propriétés analgésiques et réduit la fièvre. Elle se classe dans la même catégorie de médicaments que le paracétamol. Elle est souvent prescrite à de nombreux patients et on la trouve dans la plupart des pharmacies.
Comment fonctionne l'acétanilide ?
Ainsi, il existe des structures de résonance où une charge négative se déplace dans l'anneau, et une autre où elle réside dans l'atome O. En conséquence de cette «asymétrie électronique» -qui vient de la main de l'asymétrie moléculaire-, l'acétanilide il interagit de manière intermoléculaire par des forces dipôle-dipôle.
Qu'est-ce que le Acétanilide ?
Le acétanilide (C8H9NO) est un amide aromatique qui reçoit plusieurs noms supplémentaires: N-acétylarylamine, N-phénylacétamide et acétanil. Il se présente comme un solide inodore sous forme de paillettes, sa nature chimique est l'amide, et en tant que tel peut former des gaz inflammables en réagissant avec des agents réducteurs puissants.
 1
1 Fiche professeur
Plan du document :
SUPPORT DE TRAVAIL - QUELQUES PRECISIONS SUR LES DIFFERENTES SYNTHESES PROPOSEESAcétanilide ;
Acide acétylsalicilique ;
Paracétamol.
CONTEXTUALISATION DES SYNTHESES ORGANIQUES
PISTES D'EXPLOITATION AVEC LES ELEVES
COMPETENCES TRAVAILLEES PAR LES ELEVES DANS LE CADRE DE L'ACTIVITE PROPOSEEThème :
AGIR, défis du XXIe siècle.
Synthétiser des molécules, fabriquer de nouveaux matériaux // sélectivité en chimie organique
Type de ressource :
Activité pour la classe
Notions et contenus :
Transformation organique. Composé polyfonctionnel et réactif chimiosélectif. Utilisation de la flèche courbe.
Nature de l'actiǀitĠ :
Ġlğǀes lors d'un oral.
Résumé :
L'obtention, la purification et la caractérisation de trois molécules organiques permet de mettre en évidence
expérimentalement la réactivité de certains groupes caractéristiques présents dans les réactifs. La séance de
d'amener et de comprendre la notion de réactif chimiosélectif . 2 Support de travail - Quelques précisions sur les différentes synthèses présentéesAcétanilide
Bilan macroscopique de la synthèse :
Lors de cette transformation chimique, le groupe caractéristique amino du réactif principal (aniline) est
modifié : il est remplacé par un groupe amide ͗ il s'agit d'une rĠaction de substitution.
Protocole de synthèse :
NH2 O OO NH OCH3COOH++
Anhydride éthanoïqueAnilineAcétanilide
Acide éthanoïque
N O OO H HO O O NHH O O O NHH O O O NHH+ O O O NHH+O O O NH +HEtape n°1
Etape n°2
Etape n°3
Addition
Dissociation
Réaction
acide/base NH2 O OO NH OCH3COOH++
Anhydride éthanoïqueAnilineAcétanilide
Acide éthanoïque
Groupe
aminoGroupe
amide 3Dans un ballon, introduire 10 mL d'aniline (dangereux) et quelques grains de pierre ponce. Introduire
Porter ă Ġbullition douce pendant 15 minutes. A l'issue de ces 15 min, cesser le chauffage. Une fois le
pilée. Un solide blanc apparaît (la cristallisation peut ġtre initiĠe en grattant le fond de l'erlenmeyer
avec une tige en verre).Filtrer le mélange. Essorer les cristaux pour commencer à les sécher. Placer les cristaux dans un verre à
montre prĠalablement pesĠ et les mettre ă l'Ġtuǀe pour finir de les sĠcher.Données complémentaires :
TempĠrature d'Ġbullition Densité Température de fusionAniline 184 °C 1,02 -
Anhydride éthanoïque 140 °C 1,08 -
Acétanilide - - 114 °C
CCM : éluant CH2Cl2/acétone (50/50 en volume) ;Recristallisation ͗ l'acĠtanilide est soluble dans l'eau chaude et insoluble dans l'eau froide.
Remarque ͗ ă l'Ġtat pur, la poudre blanche d'acĠtanilide sert de ͨ poudre étalon » du banc Kofler.
Acide acétylsalicylique
Bilan macroscopique de la synthèse :
Lors de cette transformation chimique, seul un groupe caractéristique hydroxyle du réactif principal (acide
salicylique) est modifié : il est remplacé par un groupe ester ͗ il s'agit d'une rĠaction de substitution.
O OO +O OH OHCH3COOH+
O OHO OAcide salicylique
Anhydride éthanoïque
Acide acétylsalicylique
Acide éthanoïque
O OO +O OH OHCH3COOH+
O OH O OAcide salicylique
Anhydride éthanoïque
Aspirine
Acide éthanoïque
Groupe
hydroxyleGroupe
ester 4Protocole de synthèse :
Préparer un bain marie à 70°C ;
Aprğs agitation pour dissoudre le mĠlange, adapter un rĠfrigĠrant ă air sur l'erlenmeyer et chauffer le
mélange au bain-marie de 70°C pendant 20 minutes environ tout en agitant régulièrement ;A l'issue de ces 20 min, retirer l'erlenmeyer et le refroidir sous l'eau du robinet puis ajouter enǀiron 70
grattant le fond de l'erlenmeyer aǀec une tige en ǀerre).Plonger l'erlenmeyer dans un bain d'eau glacĠe (eau froide н glaĕons) pendant 10 minutes enǀiron
sans agiter.Filtrer le mélange. Essorer les cristaux. Puis les placer dans un verre à montre préalablement pesé et
les mettre ă l'Ġtuǀe pour finir de les sĠcher.Données complémentaires :
TempĠrature d'Ġbullition Densité Température de fusionAcide salicylique - 1,443 159 °C
Anhydride éthanoïque 140 °C 1,08 -73,1 °CAcide acétylsalicylique - - 135 °C
cyclohexane/acide méthanoïque/acétate de butyle (40/20/60 en volume); O OO O O O O O O O O OH O O O O O OH O O OO O OH H H H H H O O OO O OH H O O OO O O H +HEtape n°1:
Etape n°2:
Etape n°3:
Addition
Dissociation
Réaction
acide/base 5Paracétamol
Bilan macroscopique de la synthèse :
Précisions sur la transformation chimique
Lors de cette transformation chimique, seul un groupe caractéristique amino du réactif principal
Protocole de synthèse :
HONH2 O OO HONH OCH3COOH++
Paraaminophénol
Anhydride éthanoïque
Paracétamol
Acide éthanoïque
HONH2 O OO HONH OCH3COOH++
Paraaminophénol
Anhydride éthanoïque
Paracétamol
Acide éthanoïque
Groupe
aminoGroupe
amide N O OO H HO O O NHH O O O NHH O O O NHH+ O O O NHH+O O O NH +HEtape n°1
Etape n°2
Etape n°3
HO OHOH OH OHOHAddition
Dissociation
Réaction
acide/base 6Dissoudre, en chauffant (80°C), 2,72 g de para-aminophĠnol dans 20 mL d'une solution d'acide
éthanoïque (2 mol/L).
supplémentaires (avec réfrigérant) [peut être fait à froid].Refroidir le mélange dans un bain de glace. Des cristaux blancs apparaissent. Filtrer, rincer à l'eau
distillée. Sécher les cristaux avec un papier filtre et placer les cristaux dans un verre à montre
prĠalablement pesĠ et les mettre ă l'Ġtuǀe pour finir de les sĠcher.Données complémentaires :
TempĠrature d'Ġbullition Densité Température de fusion Paraaminophénol Déc. 1,02 186°C/187 °C Anhydride éthanoïque 140 °C 1,08 -73,1 °C paracétamol - 1,29 171 °C dans le bécher. Recristallisation : le paracĠtamol est soluble dans l'eau chaude et insoluble dans l'eau froide.Contextualisation des synthèses organiques
D'aprğs wikipĠdia
Les trois molécules proposées présentent, ou ont présenté, un intérêt biologique en relation avec leur activité
thérapeutique.Le paracétamol (contraction de para-acétyl-amino-phénol) est la substance active de nombreuses spécialités
médicamenteuses de la classe des antalgiques antipyrétiques non salicylés. Il est indiqué dans le traitement
symptomatique de la fièvre et des douleurs d'intensité faible à modérée, seul ou en association à d'autres
analgésiques. Contrairement à l'aspirine, il est dépourvu de propriétés anti-inflammatoires et n'agit pas sur
l'agrégation plaquettaire.tous à base de paracétamol et totalisent plus de 260 millions de doses. Il a l'avantage d'avoir peu de contre-
indications, de pouvoir être prescrit à tout âge et d'être dénué d'effets indésirables sérieux lorsqu'il est utilisé à
la posologie recommandée.L'acide acétylsalicylique, plus connu sous le nom d'aspirine, est la substance active de nombreux médicaments
aux propriétés analgésiques, antipyrétiques et anti-inflammatoires. Il est aussi utilisé comme antiagrégant
plaquettaire. C'est un anti-inflammatoire non stéroïdien.C'est le médicament le plus consommé au monde, avec une consommation annuelle estimée à 40 000 tonnes,
soit l'équivalent de 120 milliards de comprimés de 300 mg. En France, 237 médicaments commercialisés
contiennent de l'aspirine.L'acétanilide, aussi appelé acétylaniline ou acétylaminobenzène, a des propriétés analgésiques. Elle se classe
dans la même catégorie de médicaments que le paracétamol. En 1948, Julius Axelrod et Bernard Brodie ont
découvert que l'acétanilide était beaucoup plus toxique dans ses utilisations que les autres médicaments,
endommageant notamment le foie et les reins. C'est donc un mĠdicament abandonnĠ ă ce jour. 7De plus, ce composé est souvent responsable de méthémoglobinémie mortelle (taux important d'une protĠine
Pistes d'edžploitation aǀec les Ġlğǀes (acétylsalicylique, paracétamol ou acétanilide) ;paramètres du protocole afin d'en Ġtudier l'importance ͗ durĠe de rĠaction, importance de l'Ġtape de
Les équipes désignent un ou deux rapporteurs qui seront chargés de faire la synthèse des différents travaux
suivante) du compte rendu des expériences. Afin que chaque élève ait une trace écrite concernant les trois
synthèses traitées, le compte rendu sera corrigé et annoté par le professeur puis photocopié au reste de la
Chaque équipe présente au reste de la classe les synthèses étudiées (sur transparent ou diaporama préparé à
présenter peuvent être décomposées de la façon suivante pour chaque synthèse:Par exemple,
(proportions) et composés chimiques, justification/explication des étapes du protocole, rôle de la durée
fusion, recristallisation, analyse des spectres IR des produits.Remarque : l'Ġtude des mĠcanismes rĠactionnels peut ġtre rĠalisĠe ă partir d'une actiǀitĠ de reconstruction
donnée par le professeur (exemple : les formules des réactifs, produits et intermédiaires réactionnels
interǀenant dans les diffĠrentes Ġtapes du mĠcanisme sont donnĠes et l'Ġlğǀe doit reconstituer les diffĠrentes
différentes étapes élémentaires, identification des sites donneur et accepteur, identification les liaisons rompues
ou formĠes au cours d'une Ġtape ĠlĠmentaire, tracé de flèches courbes en reliant les sites donneur et
Les conclusions expérimentales de chaque équipe, présentées oralement par les élèves au groupe, sont les
suivantes (notons que les conclusions des trois équipes sont validées par les caractérisations des produits de
synthèse : point de fusion, CCM) : RNH2 O OORNHOCH3COOH++
8A la lumiğre de ces rĠsultats et dans le cas de la rĠaction entre l'anhydride Ġthanoïque et le paraaminophénol,
les Ġlğǀes peuǀent facilement prĠǀoir l'obtention des deudž composĠs suiǀants :
Après appropriation de la problématique, il est facile de présenter aux élèves les notions suivantes :
notion de sélectivité en chimie organique : si une réaction de chimie organique donne exclusivement
ou préférentiellement un produit parmi tous les produits réactionnels imaginables " sur le papier »,
elle est qualifiée de sélective ;notion de chimiosélectivité : s'il subsiste un choix entre -NH2 et -OH, l'anhydride rĠagit aǀec le groupe
éthanoïque, qui peut réagir avec les deux groupements, " sélectionne » le groupe avec lequel il va
réagir : il est chimiosélectif ! OH NH2 O OO OH NH OCH3COOH
O NH2CH3COOH+
OObservé
expérimentalement par les élèvesLes deux groupes
caractéristiques peuvent réagir avec l'anhydrideéthanoïque
Non observé 9 Compétences travaillées par les élèves dans le cadre de cette activitéLes pistes d'edžploitation dĠcrites dans ce document permettent de faire travailler aux élèves des compétences
variées détaillées ci-dessous : Macrocompétences et compétences travaillées en sciences physiques et chimiques " Observables » en chimie dans le cadre de l'actiǀitĠ proposĠeREALISER
ORGANISER
Respecter les consignes
Respecter un protocole et les consignes de sécurité. Réaliser le compte rendu demandé. Présenter oralement son étude en respectant les critères dictés par le professeur.Travailler en équipe
Responsabiliser les élèves : utilisation des résultats expérimentaux pour élaborer la conclusion ; copie du les élèves aient une trace écrite des trois synthèses. Répartir les taches au sein du groupe: étude de l'importance de la durĠe du reflux ; étude du rôle de la compte rendu ; réalisation du diaporama ; étude desGérer le temps
Expérimenter en temps limité lors des synthèses, purification et caractérisation. Exploiter les informations expérimentales et préparer l'oral en temps limité (rédaction du CR, analyse et interprétation des résultats expérimentaux, conception du Présenter ses résultats oralement en temps limité (savoir synthétiser)EFFECTUER
protocole donné Réaliser les synthèses organiques ; respecter les étapes et l'ordre imposĠ par le protocole. Identifier le risque et respecter les conditions de sécurité.Utiliser de manière adaptée les
instruments de laboratoire reflux, filtration, recristallisation, CCM, mesure de point deCOMMUNIQUER
S'INFORMER
Trier et edžploiter l'information
Analyser le protocole et les caractéristiques physico- chimiques des réactifs et des produits pour justifier lesObserver, extraire des informations
d'un fait edžpĠrimental Analyser une CCM et mesurer un point de fusionS'EXPRIMER
S'edžprimer correctement ă l'Ġcrit
Rédiger un compte rendu faisant apparaître des schémasMaîtriser la langue française.
S'edžprimer correctement ă l'oral
(usage des outils de communication) Utiliser éventuellement un diaporama ou un transparent pour la présentation orale. Maîtriser le vocabulaire scientifique (en particulier lorsque microscopique pour décrire les transformations chimiques)quotesdbs_dbs31.pdfusesText_37[PDF] fables de la fontaine théâtre
[PDF] synthèse de laspirine ? partir de lacide salicylique
[PDF] la cigale et la fourmi version theatre
[PDF] synthèse de lacétanilide tp
[PDF] mettre en scène un conte ? lécole
[PDF] synthèse aspirine tp
[PDF] les fables de la fontaine mise en scene par robert wilson
[PDF] schéma narratif le renard et la cigogne
[PDF] le renard et la cigogne analyse des personnages
[PDF] comment les plantes se défendent elles
[PDF] le torrent et la rivière date
[PDF] telecharger e.t l'extra terrestre dvdrip
[PDF] les structures et mécanismes de défense de l'acacia caffra
[PDF] morale du torrent et la rivière
