 Les réactions acido-basiques
Les réactions acido-basiques
1) Pour les acides forts. Les solutions d'acides chlorhydrique nitrique et sulfurique contiennent en très grande quantité l'ion oxonium H3O+ appartenant au
 Fiche de présentation et daccompagnement - Chapitre
Fiche de présentation et daccompagnement - Chapitre
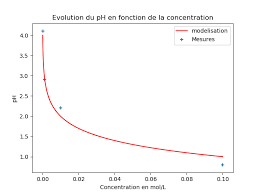
Nom de l'activité : L'acidité d'une solution (Python). Type d'activité Concentration obtenue [H3O+] (mol/L). 0100. Volume de la fiole (mL). Volume de ...
 Tableau de certains ions polyatomiques Formules Constantes et
Tableau de certains ions polyatomiques Formules Constantes et
dans l'eau à 25 °C. Ions -. 1. Ions -. 2. Ions -. 3. Formule Nom. Formule Nom. Formule Nom. H2PO4. –. H2PO3. –. HCO3. –. HSO4. –. HSO3. –. BrO3. –. CH3COO–.
 Chapitre 1 Acides et bases
Chapitre 1 Acides et bases
Nom. Teinte acide. Zone de virage. Teinte basique. Hélianthine rouge. 31 < pH < 4
 Mesures de pH
Mesures de pH
de formule HCℓ était connu sous le nom d'acide muriatique ou encore d'esprit de sel. À l'aide de Régressi
 COMMENT ÉCRIRE UN COUPLE ACIDE‑BASE ?
COMMENT ÉCRIRE UN COUPLE ACIDE‑BASE ?
Les affirmations suivantes sont‑elles vraies ou fausses ? 1. L'acide conjugué de OH– est H3O+. 2. La base conjuguée de HS– est H2S. 3
 Untitled
Untitled
H3O* est [H3O+]= 10³ mol.L¨¹. II. Théorie de Bronsted des acides et des bases ... Nom du couple. Ammoniac/ion ammonium. Acick Ethancque / Ethanoate. ICN). Auck.
 CORRECTION EXERCICE C9
CORRECTION EXERCICE C9
A partir de la valeur de pH mesurée on trouve : [H3O+] = 10-3
 Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
solutions acides utilisées sont d'une part une solution d'acide chlorhydrique (H3O+ (aq) + Cl− Le nom « ascorbique » vient du préfixe grec a (privatif) et ...
 nomeclature miné
nomeclature miné
Pour être à l'aise en chimie il est nécessaire de connaître le nom
 Mesures de pH
Mesures de pH
l'acide sulfurique sur le chlorure de sodium d'où son nom «muriatique» appartenant au Plus le pH est petit
 Les réactions acido-basiques
Les réactions acido-basiques
Les solutions d'acides chlorhydrique nitrique et sulfurique contiennent en très grande quantité l'ion oxonium H3O+ appartenant au couple H3O+(aq) / H2O(l).
 Chapitre 1 Acides et bases
Chapitre 1 Acides et bases
où H3O+ est l'ion hydronium ou oxonium
 Les acides et les bases + H+ + H3O+ + H+ + NH4
Les acides et les bases + H+ + H3O+ + H+ + NH4
étant plus faible que celle en H3O+ ; c'est l'ion hydronium H3O+ qui présente un danger. Justifier le mot acide dans le nom acide nitrique.
 COMMENT ÉCRIRE UN COUPLE ACIDE?BASE ?
COMMENT ÉCRIRE UN COUPLE ACIDE?BASE ?
Un ampholyte (nom) ou une espèce amphotère (adjectif) est une espèce Réaction entre une solution d'acide chlorhydrique (H3O+ + Cl–) et une solution.
 TD1 : Acides et bases
TD1 : Acides et bases
Application numérique : [H3O+] = 40.10?8 mol.L?1. 2. a) La réaction qui a lieu est la dissociation de la soude dans l'eau : NaOH +
 pKa de divers couples acido-basiques
pKa de divers couples acido-basiques
Nom de l'acide. Base conjuguée Cl- ion chlorure. -3. H2SO4 acide sulfurique. HSO4. - ion hydrogénosulfate ... H3O+ ion hydronium.
 Transformations chimiques en solution aqueuse
Transformations chimiques en solution aqueuse
L'eau peut accepter un proton pour donner l'ion oxonium H3O+ mais c'est aussi un acide NOM. FORMULE MOLECULAIRE. NATURE. Acide sulfurique.
 Lacide chlorhydrique : une solution dangereusem ent efficace
Lacide chlorhydrique : une solution dangereusem ent efficace
L'acide chlorhydrique aussi connu sous le nom acide muriatique
 [PDF] TD1 : Acides et bases - UTC
[PDF] TD1 : Acides et bases - UTC
a) La concentration [H3O+] est donnée par le pH de cette solution : [H3O+] = 10?pH Application numérique : [H3O+] = 631 10?5 mol L?1
 [PDF] Chapitre 1 Acides et bases
[PDF] Chapitre 1 Acides et bases
où H3O+ est l'ion hydronium ou oxonium aussi appelé “proton hydraté” puisqu'il s'agit d'un proton (H+) attaché à une molécule d'eau La concentration [H3O+]
 [PDF] Les réactions acido-basiques
[PDF] Les réactions acido-basiques
Les solutions d'acides chlorhydrique nitrique et sulfurique contiennent en très grande quantité l'ion oxonium H3O+ appartenant au couple H3O+(aq) / H2O(l)
 [PDF] Mesures de pH - Labo TP
[PDF] Mesures de pH - Labo TP
TPC1 Chapitre C1 Mesures de pH Noms : On désire mesurer le pH de différentes solutions d'acide chlorhydrique (H3O+ (aq) C??
 [PDF] COURS DE CHIMIE GENERALE Semestre 1 SVI
[PDF] COURS DE CHIMIE GENERALE Semestre 1 SVI
Chaque atome est désigné par son nom et son symbole Exemple : Oxygène : O Chlore : Cl Les atomes diffèrent par leurs structures et leurs masses
 [PDF] Filière Sciences de la Matière Chimie Cours Chimie des Solutions
[PDF] Filière Sciences de la Matière Chimie Cours Chimie des Solutions
acide dans l'eau comme le nombre de mol d'ion H3O+ susceptible d'être libérés par un litre de solution De même la normalité oxydo-réductrice d'une
 [PDF] Chapitre 11 Formule Nom Test didentification Couleur en solution Io
[PDF] Chapitre 11 Formule Nom Test didentification Couleur en solution Io
H3O+ Ion oxonium solution acide incolore Na+ Ion sodium incolore Mg2+ Ion magnésium Ag++Cl- ? AgCl incolore Zn2+ Ion zinc incolore Formule Nom
 [PDF] H+ ou H3O+
[PDF] H+ ou H3O+
Mais l'ion H+ qui est un simple proton ne se promène pas seul en solution On utilise donc la notation H+ pour écrire le lien entre un acide et sa base
 [PDF] Transformations chimiques en solution aqueuse - Chimie en PCSI
[PDF] Transformations chimiques en solution aqueuse - Chimie en PCSI
L'eau peut accepter un proton pour donner l'ion oxonium H3O+ mais c'est aussi un acide NOM FORMULE MOLECULAIRE NATURE Acide sulfurique
 [PDF] Les acides et les bases Corrigés des exercices F2School
[PDF] Les acides et les bases Corrigés des exercices F2School
Donnez la formule et le nom de l'acide conjugué correspondant aux Quel est le nom des acides suivants : Ions : H3O+ Cl– et très peu de OH–
Comment s'appelle l'ion H3O+ ?
L'ion hydronium est le plus simple des ions oxonium ; sa formule chimique est H3O+ ou H+(aq). En solution aqueuse, il est solvaté par plusieurs molécules d'eau et peut être écrit H7O3+, H9O4+ etc. Il résulte de la protonation d'une molécule d'eau soit par un acide, soit par autoprotolyse de l'eau.C'est quoi H3O Cl ?
Il est un ion hydrogène hydraté.Quelle est la base de H3O+ ?
L'eau se comporte comme une base vis-à-vis d'un acide. Le couple considéré est: H3O+ / H2O (l'eau est la base du couple).- L'acide conjugué d'une base très faible ou nulle est un acide fort (les couples chlorure/acide chlorhydrique, bromure/acide bromhydrique et iodure/acide iodhydrique par exemple). Pour les cas intermédiaires, plus la base est forte, plus l'acide conjugué est faible et inversement.
TD1 : Acides et bases
1. La concentration [H
3O+] dans le sang vaut :
[H3O+] = 10pH
Application numérique :[H3O+] = 4;0:108mol:L1.
2. a) La réaction qui a lieu est la dissociation de la soude dans l"eau :
NaOH + H
2O!Na(aq)++ HO-
La soude est une base forte, cette réaction est donc totale. b) La soude étant totalement dissociée, la concentration finale [HO -] est égale à la concen- tration apportée en NaOH. Le pH vaut donc : pH=pKe+ log([NaOH]) =pKe+ log m NaOHMNaOHVeau
Application numérique :pH= 11;4.
Remarque :la température n"étant pas précisée dans l"énoncé on suppose que= 25C doncpKe= 14.3. On a réalisé le mélange de deux solutions de bases fortes. Aucune réaction chimique n"a
lieu au moment du mélange. Les deux bases fortes sont entièrement disssociées en solution.La concentration finale [HO
-] est donc égale à la somme des concentrations apportées enNaOH et KOH :
[HO ] =c1v1v1+v2+c2v2v
1+v2 où(v1;c1)sont le volume apporté de solution de soude et sa concentration, et(v2;c2)sont le volume apporté de solution de potasse et sa concentration. Alors : pH=pKe+ logc1v1+c2v2v 1+v2Application numérique :pH= 10;86.
4. a) Les espèces chimiques présentes en solution sont les suivantes :
l"acide fluoro éthanoïque; sa base conjuguée, l"ion fluoro éthanoate; la triméth ylamine; son acide conjugué, l"ion triméth ylammonium; l"eau (solv ant); l"ion h ydroxyde(issu des disso ciations,y co mprisl"autoprotolyse) ; l"ion h ydronium(issu des disso ciations,y compris l"autoprotolyse). b) Pour un couple acide/base AH/A -, les domaines (de pH) de prédominance de l"une ou l"autre espèce sont déterminés par la relation : pHpKa= log[A][AH]De plus, en milieu acide [H
3O+]>[HO-], alors qu"en milieu basique [H3O+]<[HO-].
Parmi les trois couples acide/base en présence, voici les espèces prédominantes àpH= 6;1: 1 -l"ion fluoro éthanoate,car pH > pKa(acide fluoroéthanoïque/fluoroéthanoate); l"ion triméth ylammonium,car pH < pKa(triméthylammonium/triméthylamine); l"ion h ydroniumest prédominan tsur l"ion h ydroxydecar le pH est inférieur à 7.5. a) La concentration [H
3O+] est donnée par le pH de cette solution :
[H3O+] = 10pH
Application numérique :[H3O+] = 6;31:105mol:L1. b) La réaction de dissociation de HInd dans l"eau s"écrit :HInd + H
2OInd-+ H3O+
On ne sait pas encore s"il s"agit d"un acide fort ou faible, donc dans le doute on écrit la réaction comme équilibrée. c) Le tableau d"avancement ci-dessous permet d"établir le taux d"avancement final :AvancementHIndH
2OInd -H 3O+0c0v0excès00
x fc0v0xfexcèsx
fx f x max0excèsx maxx max oùv0est le volume de la solution étudiée. On en déduit l"expression dexfetxmax: x max=c0v0;xf= [H3O+]v0Ainsi :
=[H3O+]v0c0v0=[H3O+]c
0Application numérique := 0;22.
d) D"après la question précédente, la réaction de dissociation du vert de bromocrésol dans
l"eau n"est pas totale, c"est donc un acide faible (d"où son utilisation comme indicateur coloré de pH dans l"eau).6. a) À 25
C,pKe= 14. Le produit ionique de l"eauKes"écrit : K e= 10pKe= [H3O+][HO]À 25
C,Ke= 1014.
b) Une solution aqueuse est dite neutre si et seulement si : [H3O+] = [HO]
ssi[H3O+] =pK e ssipH=12 pKeÀ 25
C,pKe= 14donc un pH neutre vaut 7.
c) À 50 CpKe= 13;25. DoncKe= 10pKe= 5;62:1014. D"après la question précé- dente, une solution neutre a pour pH :pH=pKe=2. Soit, à 50C,pH= 6;63.7. a) Le couple acide/base de l"ammoniaque a unpKa= 9;2<14, il s"agit donc d"une
base faible. b) La dissociation de l"ammoniaque dans l"eau s"écrit : NH3+ H20NH4++ HO-
Le produit formé NH
4+est l"ion ammonium, acide conjugué de l"ammoniaque.
2 c) Voici le diagramme de prédominance du couple ammonium/ammoniaque :NH4+ pK a= 9,2NH 3 pHd) De l"ammoniaque et de l"éthylamine, la base la plus forte est celle du couple dont le pK aest le plus élevé. Or pK aCH3NH3+=CH3NH2= 10;7> pKaNH4+=NH3= 9;9Donc l"éthylamine est la base la plus forte.
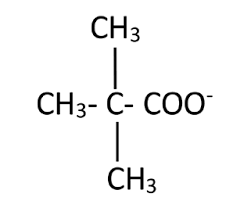
8.Remarque :une erreur s"est glissée dans l"énoncé : la formule de la glycine estCH2(NH2)-COOH
et pas CH3(NH2)-COOH.
a) Le tracé du diagramme de prédominance de la glycine permet d"écrire les formes des espèces de chaque couple acide/base concerné :CH2(NH3+)-COOH pK a,1= 2,4CH2(NH3+)-COO-
pK a,2= 9,8CH2(NH2)-COO-
pHLes deux couples acide/base de la glycine peuvent donc s"écrire : (CH2(NH3+)-COOH/CH2(NH3+)-COO-) :pKa;1= 2;4;
(CH2(NH3+)-COO-/CH2(NH2)-COO-) :pKa;2= 9;8.
b) Les constantes d"acidité des deux couples de la glycine s"écrivent : K a;i= 10pKa;i Applications numériques :Ka;1= 3;98:103etKa;2= 1;58:1010. c) À pH neutre l"espèce prédominante est l"ampholyte : CH2(NH3+)-COO-.
9. a) La dissociation de l"acide nitrique dans l"eau est totale, elle s"écrit :
HNO3+ H2O!NO3-+ H3O+
b) La dissociation de l"acide nitrique étant totale, le pH de la solution diluée s"écrit : pH=log[H3O+] =log([HNO3]) =lognHNO3V =logmHNO3M HNO3VApplication numérique :pH= 3;8.
Remarque :vous pouvez écrire directementpH=log[HNO3]si vous vous rappelez la relation.10. Les espèces suivantes ne sont ni des bases ni des acides d"après la théorie de Brønsted,
car ils ne peuvent ni céder ni accepter un proton : Fe2+,Fe3+. L"alcool CH3CH2OH et
l"aldéhyde CH3CHO n"agissent pas non plus comme des acides, les protons des fonctions
alcool et aldéhyle ne peuvent être cédés à cause de la manière dont se répartissent les
électrons de valence.
Remarque :sauf dans quelques cas particuliers, les seules fonctions organiques ayant des propriétés acido-basiques (selon Brønsted) sont les fonctions amino et carboxyle. Voici les couples acide/base complétés, avec en gras les acides ou bases conjugués qui n"étaient pas dans l"énoncé : 3AcidesAmpholytesBases
H 3O+H 2OHO CH3COOHCH
3COO- (CO2,H2O)HCO
3-CO 32-NH 4+NH 3
R-COOH
1R-COO
R(NH3+)-COOH2R(NH
3+)-COO-R(NH
2)-COO-
1 noms IUPAC : acide 2-hydroxybenzoïque et sa base conjuguée l"ion 2-hydroxybenzoate.Cet acide est aussi appelé acide salicylique, il est présent dans l"écorce de saule et entre
dans la fabrication de l"aspirine (acide acétylsalicylique).2cet acide-aminé est la leucine, et, comme souvent, la forme neutre écrite dans
l"énoncé est très minoritaire en solution aqueuse. Son nom IUPAC complet est acide 2- amino-4-méthylpentanoïque.11. a) Dans ce premier dosage, la concentrationcGen glycine est donnée par la relation :
cG=cBvB;eqv
0Application numérique :cG= 4;0:102mol:L1.
b) Dans ce second dosage, la concentrationcGen glycine est donnée par la relation : cG=cAvA;eqv
0Application numérique :cG= 3;0:102mol:L1.
12. a) L"acide sulfurique H
2SO4est un diacide fort, sa (double) dissociation dans l"eau est
donc totale : H2SO4+ H2O!SO42-+ 2H3O+
b) Le tableau d"avancement de la dissociation s"écrit :AvancementH
2SO4H 2OSO 42-H3O+0nexcès00
xnxexcèsx2x x f0excèsx f=n2xf= 2n c) Le pH de la solution obtenue s"écrit : pH=log2nVApplication numérique :pH= 3;1.
13. a) Le suc gastrique est assimilé à une solution aqueuse de HCl, un acide fort. Le pH
s"écrit donc : pH=log(HCl) Ainsi, la différence entre deux mesures successives de pH, est liée au rapport des concen- trations, c"est à dire au facteur de dilution : pH2pH1= log([HCl]1)log((HCl]2) = log[HCl]1[HCl]
2 = log(X) 4 ssiX= 10pH2pH1 oùX= [HCl]1=[HCl]2est le facteur de dilution. Application numérique :X= 100. b) La concentration des ions hydroxyde dans l"intestin est donnée par la relation : [HO ] = 10pOH= 10pHpKe oùpKe= 13;7(donnée). Application numérique :[HO] = 2;0:106mol:L1.14. L"eau du lac est assimilable à une solution acide diluée. L"élévation du niveau revient
à une dilution supplémentaire, donc à une augmentation du pH. Les acides en présence sont des acides forts (chlorure d"hydrogène, acide sulfurique issu du dioxyde de soufre). Le lac peut être assimilé à un cylindre, de surfaceS(donnée) et de hauteurh(h1lors de la mesure initiale,h2lors de la nouvelle mesure). La hauteur initiale du lac est donnée par :h1=V=S. La quantiténd"ions hydronium dans le lac est donnée par la relation : pH1=lognV
n=V10pH1 Le pH mesuré après l"élévation du niveau du lac s"écrit : pH2=lognh
2S avech2=h1 + 10m On peut donc écrire le pH mesuré après élévation du niveau : pH2=pH1+ log
1 +10mSV
Application numérique :pH2= 0;25.
15. Les ions nitrate NO
3-, sulfate SO42-et chlorure Cl-trouvés dans l"eau de pluie
proviennent de la dissociation totale des acides forts suivants : HNO3+ H2O!NO3-+ H3O+
H2SO4+ H2O!SO42-+ 2H3O+
HCl + H
2O!Cl-+ H3O+
Donc on peut assimiler l"eau de pluie testée à un mélange de trois acides forts, dont un est un diacide. Son pH s"écrit alors : pH=log[H3O+] =log[NO3] + 2[SO42] + [Cl] =logc(NO3)M(NO
3)+ 2SO42M(SO
42)+c(Cl)M(Cl)
Application numérique :pH= 4;05.
16. a) La propriété d"une solution tampon est de conserver un pH quasi-constant malgré
une dilution modérée ou l"ajout d"une petite quantité d"acide fort ou de base forte. b) La relation entre le pH, lepKaet les concentrations en acide et en base s"écrit : pH=pKa+ log[CH3COO][CH3COOH]
5 c) On prépare une solution tampon depH= 5> pKa. Il faut donc introduire plus de base que d"acide.17. a) La meilleure solution tampon estS1, car les variations du par dilution ou aout
d"acide fort sont plus faibles avec cette solution qu"avec la solutionS2. b) L"utilisation de valeurs absolues (jpHj) s"explique par le fait que le pH peut augmenter ou diminuer selon qu"on ajoute un peu de base forte ou d"acide fort à la solution tampon. Les équations aux dimensions des différentes grandeursis"écrivent : [1] = [pH] = 1 [2] =[n][pH]=N1 =N [3] =[n][V][pH]=N:L3 Le tableau suivant regroupe les valeurs des différentes grandeursipour chacune des expériences :V (mL)n (mmol)pH 12(mmol)
3(mmol/L)S
1S 2S 1S 2S 1S 2S 1S250054,84,60,20,425,012,55025
10054,03,01,02,05,02,55025
10024,64,20,40,85,02,55025
c) Au vu des résultats, la grandeur3semble être la plus pertinente pour caractériser la qualité d"une solution tampon : pour une solution tampon donnée, sa valeur ne dépend pas du cas de figure (i.e. du facteur de dilution ou de la quantité d"acide ou de base forte ajoutée).S1est une meilleure solution tampon queS2et on voit que3(S1)> 3(S2). Une bonne solution tampon est donc caractérisée par une grande valeur de. d) La valeur minimale depour cette solution tampon, correspondant à la ariation maximale de pH autorisée, s"écrit : min=nVjpHmaxjApplication numérique :min= 20mmol:L1.
18. a) La masse d"hydroxyde de sodium nécessaire pour préparerVB= 1Lde solution
S1s"écrit :
mNaOH=cBVBMNaOH
Application numérique :mNaOH= 400g.
b) La masse de chlorure d"hydrogène dans un échantillon de volumeV= 1;0Let de massemde la solutionS3s"écrit : mHCl=xm=xV
ssimHCl=xV deau La quantité de chlorure d"hydrogène contenue dans l"échantillon s"écrit : nHCl=mHClM
HCl 6 Applications numériques :mHCl= 440getnHCl= 12;1mol. c) Le volumeV3de solutionS3à prélever pour préparer un volumeVde solutionS2 s"écrit : V3=cAVc
HCl oùcHCl=nHCl=1Lest la concentration molaire de la solution commerciale. Application numérique :V3= 1;66mL. d) La quantité d"ions hydronium en solution (1 L de solutionS2) avant ajout de solution basique s"écrit : nH3O+;0=cAV
La réaction de la soude avec l"acide chlorhydrique étant totale, la quantité d"ions hydro- nium en solution après ajout de solution basique s"écrit :quotesdbs_dbs44.pdfusesText_44[PDF] cas cliniques
[PDF] autoprotolyse de l'eau
[PDF] une maladie a incidence sociale c'est quoi
[PDF] zone de virage phénolphtaléine
[PDF] caractéristique d'une maladie a incidence sociale
[PDF] acide sulfanilique
[PDF] pourquoi peut-on affirmer qu'une mcv est une maladie sociale
[PDF] bleu de bromothymol
[PDF] maladie incidence sociale définition
[PDF] maladies sociales
[PDF] bbt
[PDF] liste maladie rare
[PDF] interpretation graphique d'une equation
[PDF] rouge de crésol zone de virage
