 Les réactions acido-basiques
Les réactions acido-basiques
1) Pour les acides forts. Les solutions d'acides chlorhydrique nitrique et sulfurique contiennent en très grande quantité l'ion oxonium H3O+ appartenant au
 TD1 : Acides et bases
TD1 : Acides et bases
Son nom IUPAC complet est acide 2- amino-4-méthylpentanoïque. 11. a) Dans ce HCl + H2O→Cl– + H3O+. Donc on peut assimiler l'eau de pluie testée à un ...
 Fiche de présentation et daccompagnement - Chapitre
Fiche de présentation et daccompagnement - Chapitre
Nom de l'activité : L'acidité d'une solution (Python). Type d'activité Concentration obtenue [H3O+] (mol/L). 0100. Volume de la fiole (mL). Volume de ...
 Tableau de certains ions polyatomiques Formules Constantes et
Tableau de certains ions polyatomiques Formules Constantes et
dans l'eau à 25 °C. Ions -. 1. Ions -. 2. Ions -. 3. Formule Nom. Formule Nom. Formule Nom. H2PO4. –. H2PO3. –. HCO3. –. HSO4. –. HSO3. –. BrO3. –. CH3COO–.
 Chapitre 1 Acides et bases
Chapitre 1 Acides et bases
Nom. Teinte acide. Zone de virage. Teinte basique. Hélianthine rouge. 31 < pH < 4
 COMMENT ÉCRIRE UN COUPLE ACIDE‑BASE ?
COMMENT ÉCRIRE UN COUPLE ACIDE‑BASE ?
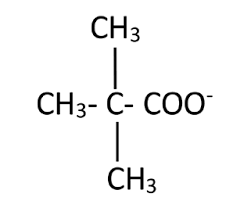
Les affirmations suivantes sont‑elles vraies ou fausses ? 1. L'acide conjugué de OH– est H3O+. 2. La base conjuguée de HS– est H2S. 3
 Untitled
Untitled
H3O* est [H3O+]= 10³ mol.L¨¹. II. Théorie de Bronsted des acides et des bases ... Nom du couple. Ammoniac/ion ammonium. Acick Ethancque / Ethanoate. ICN). Auck.
 CORRECTION EXERCICE C9
CORRECTION EXERCICE C9
A partir de la valeur de pH mesurée on trouve : [H3O+] = 10-3
 Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
solutions acides utilisées sont d'une part une solution d'acide chlorhydrique (H3O+ (aq) + Cl− Le nom « ascorbique » vient du préfixe grec a (privatif) et ...
 nomeclature miné
nomeclature miné
Pour être à l'aise en chimie il est nécessaire de connaître le nom
 Mesures de pH
Mesures de pH
l'acide sulfurique sur le chlorure de sodium d'où son nom «muriatique» appartenant au Plus le pH est petit
 Les réactions acido-basiques
Les réactions acido-basiques
Les solutions d'acides chlorhydrique nitrique et sulfurique contiennent en très grande quantité l'ion oxonium H3O+ appartenant au couple H3O+(aq) / H2O(l).
 Chapitre 1 Acides et bases
Chapitre 1 Acides et bases
où H3O+ est l'ion hydronium ou oxonium
 Les acides et les bases + H+ + H3O+ + H+ + NH4
Les acides et les bases + H+ + H3O+ + H+ + NH4
étant plus faible que celle en H3O+ ; c'est l'ion hydronium H3O+ qui présente un danger. Justifier le mot acide dans le nom acide nitrique.
 COMMENT ÉCRIRE UN COUPLE ACIDE?BASE ?
COMMENT ÉCRIRE UN COUPLE ACIDE?BASE ?
Un ampholyte (nom) ou une espèce amphotère (adjectif) est une espèce Réaction entre une solution d'acide chlorhydrique (H3O+ + Cl–) et une solution.
 TD1 : Acides et bases
TD1 : Acides et bases
Application numérique : [H3O+] = 40.10?8 mol.L?1. 2. a) La réaction qui a lieu est la dissociation de la soude dans l'eau : NaOH +
 pKa de divers couples acido-basiques
pKa de divers couples acido-basiques
Nom de l'acide. Base conjuguée Cl- ion chlorure. -3. H2SO4 acide sulfurique. HSO4. - ion hydrogénosulfate ... H3O+ ion hydronium.
 Transformations chimiques en solution aqueuse
Transformations chimiques en solution aqueuse
L'eau peut accepter un proton pour donner l'ion oxonium H3O+ mais c'est aussi un acide NOM. FORMULE MOLECULAIRE. NATURE. Acide sulfurique.
 Lacide chlorhydrique : une solution dangereusem ent efficace
Lacide chlorhydrique : une solution dangereusem ent efficace
L'acide chlorhydrique aussi connu sous le nom acide muriatique
 [PDF] TD1 : Acides et bases - UTC
[PDF] TD1 : Acides et bases - UTC
a) La concentration [H3O+] est donnée par le pH de cette solution : [H3O+] = 10?pH Application numérique : [H3O+] = 631 10?5 mol L?1
 [PDF] Chapitre 1 Acides et bases
[PDF] Chapitre 1 Acides et bases
où H3O+ est l'ion hydronium ou oxonium aussi appelé “proton hydraté” puisqu'il s'agit d'un proton (H+) attaché à une molécule d'eau La concentration [H3O+]
 [PDF] Les réactions acido-basiques
[PDF] Les réactions acido-basiques
Les solutions d'acides chlorhydrique nitrique et sulfurique contiennent en très grande quantité l'ion oxonium H3O+ appartenant au couple H3O+(aq) / H2O(l)
 [PDF] Mesures de pH - Labo TP
[PDF] Mesures de pH - Labo TP
TPC1 Chapitre C1 Mesures de pH Noms : On désire mesurer le pH de différentes solutions d'acide chlorhydrique (H3O+ (aq) C??
 [PDF] COURS DE CHIMIE GENERALE Semestre 1 SVI
[PDF] COURS DE CHIMIE GENERALE Semestre 1 SVI
Chaque atome est désigné par son nom et son symbole Exemple : Oxygène : O Chlore : Cl Les atomes diffèrent par leurs structures et leurs masses
 [PDF] Filière Sciences de la Matière Chimie Cours Chimie des Solutions
[PDF] Filière Sciences de la Matière Chimie Cours Chimie des Solutions
acide dans l'eau comme le nombre de mol d'ion H3O+ susceptible d'être libérés par un litre de solution De même la normalité oxydo-réductrice d'une
 [PDF] Chapitre 11 Formule Nom Test didentification Couleur en solution Io
[PDF] Chapitre 11 Formule Nom Test didentification Couleur en solution Io
H3O+ Ion oxonium solution acide incolore Na+ Ion sodium incolore Mg2+ Ion magnésium Ag++Cl- ? AgCl incolore Zn2+ Ion zinc incolore Formule Nom
 [PDF] H+ ou H3O+
[PDF] H+ ou H3O+
Mais l'ion H+ qui est un simple proton ne se promène pas seul en solution On utilise donc la notation H+ pour écrire le lien entre un acide et sa base
 [PDF] Transformations chimiques en solution aqueuse - Chimie en PCSI
[PDF] Transformations chimiques en solution aqueuse - Chimie en PCSI
L'eau peut accepter un proton pour donner l'ion oxonium H3O+ mais c'est aussi un acide NOM FORMULE MOLECULAIRE NATURE Acide sulfurique
 [PDF] Les acides et les bases Corrigés des exercices F2School
[PDF] Les acides et les bases Corrigés des exercices F2School
Donnez la formule et le nom de l'acide conjugué correspondant aux Quel est le nom des acides suivants : Ions : H3O+ Cl– et très peu de OH–
Comment s'appelle l'ion H3O+ ?
L'ion hydronium est le plus simple des ions oxonium ; sa formule chimique est H3O+ ou H+(aq). En solution aqueuse, il est solvaté par plusieurs molécules d'eau et peut être écrit H7O3+, H9O4+ etc. Il résulte de la protonation d'une molécule d'eau soit par un acide, soit par autoprotolyse de l'eau.C'est quoi H3O Cl ?
Il est un ion hydrogène hydraté.Quelle est la base de H3O+ ?
L'eau se comporte comme une base vis-à-vis d'un acide. Le couple considéré est: H3O+ / H2O (l'eau est la base du couple).- L'acide conjugué d'une base très faible ou nulle est un acide fort (les couples chlorure/acide chlorhydrique, bromure/acide bromhydrique et iodure/acide iodhydrique par exemple). Pour les cas intermédiaires, plus la base est forte, plus l'acide conjugué est faible et inversement.
Chapitre C1
Mesures de pH
Noms :
3O+(aq), Cκ(aq))
concentration en ions oxonium [H3O+]. I. Préparation dune solution dacide chlorhydrique par dissolutionLe chlorure dhydrogène HCκ est un gaz très soluble dans leau. Sa dissolution donne une
solution appelée acide chlorhydrique. On peut la réaliser avec lexpérience du " jet deau » en
renversant un ballon contenant du chlorure dhydrogène gazeux sur un cristallisoir rempli deau.Q1. Préciser quelles sont les espèces chimiques présentes dans le ballon à l'état initial et à l'état
final. Justifier lapparition de chaque produit par des observations et le test approprié. Q2. En déduire léquation modélisant la réaction entre le chlorure dhydrogène et leau.Document 1 : Lacide chlorhydrique
, sous sa forme anhydre, de formule HCκ, était connu fort, très corrosif, il est aussi . perse Jabir lbn Hayyan (721-815), par la réaction de sulfurique sur le chlorure de sodium nom "muriatique», appartenant au sel de la mer ou de la mer. Dhttp://www.societechimiquedefrance/ acidechlorhydrique.htmlDocument 2 : Hélianthine et pH
L'hélianthine est un indicateur coloré acido-basique. Elle donne une coloration rouge (rose)aux solutions dont le pH est inférieur à 3,3 et une coloration jaune aux solutions dont le pH est
supérieur à 4,4. Plus le pH est petit, plus la concentration en ions oxonium [H3O+(aq)] est élevée. Document 3 : Test de présence des ions chlorure CκEn présence dions argent Ag+, les ions chlorure Cκ réagissent pour former un précipité blanc
de chlorure dargent AgCl qui noircit à la lumière. II. Préparation de solutions dacide chlorhydrique obtenues par dilutionOn souhaite préparer deux solutions S2 et S4 cide chlorhydrique (H3O+(aq) + Cκ(aq)) à
partir dune solution mère S0 de concentration [H3O+(aq)]0 = 0,10 mol.L-1.Solution S0 S1 S2 S3 S4
[H3O+(aq)] (mol.L-1) 0,10 5,0×102 1,0×102 5,0×103. 1,0×103Q3. Parmi le matériel mis à votre disposition indiquer celui nécessaire à la préparation des
solutions S2 et S4 ? Justifier le choix des volumes pour chaque solution. Puis préparer ces
solutions. Document 4 : Protocole dune dilution http://acver.fr/j5aSource © HACHETTE
Document 5 : Solutions mère/fille
eau à une solution mère de volume Vmère et de concentration Cmère en soluté e solution fille de volume Vfille et de concentration Cfille inférieure à Cmère. La quantité de matière de soluté ne change pas au cours de la dilution, ainsi on a :Cmère. Vmère = Cfille. Vfille
III. Mesures du pH
Q4. Après avoir étalonné le pH-mètre, effectuer les mesures de pH des différentes solutions et
compléter le tableau ci-dessous :Solution S0 S1 S2 S3 S4
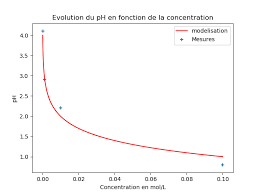
[H3O+(aq)] (mol.L-1) 0,10 5,0×102 1,0×102 5,0×103. 1,0×103 pHmesQ5. À laide de Régressi, afficher la courbe pHmes = f([H3O+(aq)]). Pour simplifier lécriture,
[H3O+(aq)] sera notée c. Q6. Créer la grandeur pHtheo = log( c ) et ajouter la courbe pHtheo = f(c) sur le graphique.Imprimer.
Comparer les deux courbes obtenues.
Document 6 : Le pH
Le terme " pH », abréviation de " potentiel Hydrogène », a été utilisé pour la première fois
en 1909 par le chimiste danois Søren Sørensen. Il proposa également l'échelle de mesuredu degré d'acidité d'une solution de 0 à 14, utilisée aujourd'hui et qui répond à la formule :
pH = log c3 (aq)
0 HO avec c0 = 1 mol.L-1. On peut écrire également : [H3O+(aq)] = c0.10pHDocument 7 : Utilisation du pH-mètre
Le pH-mètre est un appareil permettant de mesurer le pH d'une solution. Il est constitué dedeux éléments : un boîtier électronique qui affiche la valeur du pH et une électrode qui
mesure cette valeur. Pour étalonner le pH-mètre on utilise deux solutions tampons (une solution tampon est une solution qui malgré l'addition d'acide, de base ou d'une dilution, garde approximativement le même pH) ; dabord celle de pH = 7 puis celle de pH = 4.Document 8 : Utilisation de Régressi
Pour entrer des valeurs dans Régressi il suffit de faire Fichier>Nouveau>Clavier. La fenêtre graphe permet dobtenir la courbe et " Coord » de changer abscisses / ordonnées.Longlet grandeur permet de voir les grandeurs créées, " Y+ » permet den créer de
nouvelles. Q7. Compléter le tableau ci-dessous et conclure.Solution S0 S1 S2 S3 S4
[H3O+(aq)] (mol.L1) 0,10 5,0×102 1,0×102 5,0×103. 1,0×103 pHthéo mes théo- pH pH u pH Document 9 : Comparaison à une valeur de référenceLa validation dune relation à laide dune expérience dépend de lincertitude-type u(X), où X
est la grandeur mesurée et de létendue des mesures |Xmes Xthéo|.On peut utiliser le z-score =
mes théoXX u( X ) , si ce quotient est inférieur ou égal à 2, on peut valider la relation fournie. Si non, il faut analyser les sources derreurs et modifier le protocole afin dobtenir des résultats cohérents. Lincertitude-type u(pH) de mesure du pH-mètre figure dans la notice à votre disposition.quotesdbs_dbs44.pdfusesText_44[PDF] cas cliniques
[PDF] autoprotolyse de l'eau
[PDF] une maladie a incidence sociale c'est quoi
[PDF] zone de virage phénolphtaléine
[PDF] caractéristique d'une maladie a incidence sociale
[PDF] acide sulfanilique
[PDF] pourquoi peut-on affirmer qu'une mcv est une maladie sociale
[PDF] bleu de bromothymol
[PDF] maladie incidence sociale définition
[PDF] maladies sociales
[PDF] bbt
[PDF] liste maladie rare
[PDF] interpretation graphique d'une equation
[PDF] rouge de crésol zone de virage
