Les réactions acido-basiques
Les réactions acido-basiques
1) Pour les acides forts. Les solutions d'acides chlorhydrique nitrique et sulfurique contiennent en très grande quantité l'ion oxonium H3O+ appartenant au
 TD1 : Acides et bases
TD1 : Acides et bases
Son nom IUPAC complet est acide 2- amino-4-méthylpentanoïque. 11. a) Dans ce HCl + H2O→Cl– + H3O+. Donc on peut assimiler l'eau de pluie testée à un ...
 Fiche de présentation et daccompagnement - Chapitre
Fiche de présentation et daccompagnement - Chapitre
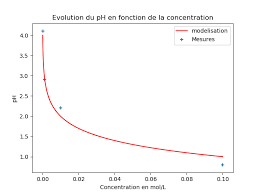
Nom de l'activité : L'acidité d'une solution (Python). Type d'activité Concentration obtenue [H3O+] (mol/L). 0100. Volume de la fiole (mL). Volume de ...
 Tableau de certains ions polyatomiques Formules Constantes et
Tableau de certains ions polyatomiques Formules Constantes et
dans l'eau à 25 °C. Ions -. 1. Ions -. 2. Ions -. 3. Formule Nom. Formule Nom. Formule Nom. H2PO4. –. H2PO3. –. HCO3. –. HSO4. –. HSO3. –. BrO3. –. CH3COO–.
 Chapitre 1 Acides et bases
Chapitre 1 Acides et bases
Nom. Teinte acide. Zone de virage. Teinte basique. Hélianthine rouge. 31 < pH < 4
 Mesures de pH
Mesures de pH
de formule HCℓ était connu sous le nom d'acide muriatique ou encore d'esprit de sel. À l'aide de Régressi
 Untitled
Untitled
H3O* est [H3O+]= 10³ mol.L¨¹. II. Théorie de Bronsted des acides et des bases ... Nom du couple. Ammoniac/ion ammonium. Acick Ethancque / Ethanoate. ICN). Auck.
 CORRECTION EXERCICE C9
CORRECTION EXERCICE C9
A partir de la valeur de pH mesurée on trouve : [H3O+] = 10-3
 Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
solutions acides utilisées sont d'une part une solution d'acide chlorhydrique (H3O+ (aq) + Cl− Le nom « ascorbique » vient du préfixe grec a (privatif) et ...
 nomeclature miné
nomeclature miné
Pour être à l'aise en chimie il est nécessaire de connaître le nom
 Mesures de pH
Mesures de pH
l'acide sulfurique sur le chlorure de sodium d'où son nom «muriatique» appartenant au Plus le pH est petit
 Les réactions acido-basiques
Les réactions acido-basiques
Les solutions d'acides chlorhydrique nitrique et sulfurique contiennent en très grande quantité l'ion oxonium H3O+ appartenant au couple H3O+(aq) / H2O(l).
 Chapitre 1 Acides et bases
Chapitre 1 Acides et bases
où H3O+ est l'ion hydronium ou oxonium
 Les acides et les bases + H+ + H3O+ + H+ + NH4
Les acides et les bases + H+ + H3O+ + H+ + NH4
étant plus faible que celle en H3O+ ; c'est l'ion hydronium H3O+ qui présente un danger. Justifier le mot acide dans le nom acide nitrique.
 COMMENT ÉCRIRE UN COUPLE ACIDE?BASE ?
COMMENT ÉCRIRE UN COUPLE ACIDE?BASE ?
Un ampholyte (nom) ou une espèce amphotère (adjectif) est une espèce Réaction entre une solution d'acide chlorhydrique (H3O+ + Cl–) et une solution.
 TD1 : Acides et bases
TD1 : Acides et bases
Application numérique : [H3O+] = 40.10?8 mol.L?1. 2. a) La réaction qui a lieu est la dissociation de la soude dans l'eau : NaOH +
 pKa de divers couples acido-basiques
pKa de divers couples acido-basiques
Nom de l'acide. Base conjuguée Cl- ion chlorure. -3. H2SO4 acide sulfurique. HSO4. - ion hydrogénosulfate ... H3O+ ion hydronium.
 Transformations chimiques en solution aqueuse
Transformations chimiques en solution aqueuse
L'eau peut accepter un proton pour donner l'ion oxonium H3O+ mais c'est aussi un acide NOM. FORMULE MOLECULAIRE. NATURE. Acide sulfurique.
 Lacide chlorhydrique : une solution dangereusem ent efficace
Lacide chlorhydrique : une solution dangereusem ent efficace
L'acide chlorhydrique aussi connu sous le nom acide muriatique
 [PDF] TD1 : Acides et bases - UTC
[PDF] TD1 : Acides et bases - UTC
a) La concentration [H3O+] est donnée par le pH de cette solution : [H3O+] = 10?pH Application numérique : [H3O+] = 631 10?5 mol L?1
 [PDF] Chapitre 1 Acides et bases
[PDF] Chapitre 1 Acides et bases
où H3O+ est l'ion hydronium ou oxonium aussi appelé “proton hydraté” puisqu'il s'agit d'un proton (H+) attaché à une molécule d'eau La concentration [H3O+]
 [PDF] Les réactions acido-basiques
[PDF] Les réactions acido-basiques
Les solutions d'acides chlorhydrique nitrique et sulfurique contiennent en très grande quantité l'ion oxonium H3O+ appartenant au couple H3O+(aq) / H2O(l)
 [PDF] Mesures de pH - Labo TP
[PDF] Mesures de pH - Labo TP
TPC1 Chapitre C1 Mesures de pH Noms : On désire mesurer le pH de différentes solutions d'acide chlorhydrique (H3O+ (aq) C??
 [PDF] COURS DE CHIMIE GENERALE Semestre 1 SVI
[PDF] COURS DE CHIMIE GENERALE Semestre 1 SVI
Chaque atome est désigné par son nom et son symbole Exemple : Oxygène : O Chlore : Cl Les atomes diffèrent par leurs structures et leurs masses
 [PDF] Filière Sciences de la Matière Chimie Cours Chimie des Solutions
[PDF] Filière Sciences de la Matière Chimie Cours Chimie des Solutions
acide dans l'eau comme le nombre de mol d'ion H3O+ susceptible d'être libérés par un litre de solution De même la normalité oxydo-réductrice d'une
 [PDF] Chapitre 11 Formule Nom Test didentification Couleur en solution Io
[PDF] Chapitre 11 Formule Nom Test didentification Couleur en solution Io
H3O+ Ion oxonium solution acide incolore Na+ Ion sodium incolore Mg2+ Ion magnésium Ag++Cl- ? AgCl incolore Zn2+ Ion zinc incolore Formule Nom
 [PDF] H+ ou H3O+
[PDF] H+ ou H3O+
Mais l'ion H+ qui est un simple proton ne se promène pas seul en solution On utilise donc la notation H+ pour écrire le lien entre un acide et sa base
 [PDF] Transformations chimiques en solution aqueuse - Chimie en PCSI
[PDF] Transformations chimiques en solution aqueuse - Chimie en PCSI
L'eau peut accepter un proton pour donner l'ion oxonium H3O+ mais c'est aussi un acide NOM FORMULE MOLECULAIRE NATURE Acide sulfurique
 [PDF] Les acides et les bases Corrigés des exercices F2School
[PDF] Les acides et les bases Corrigés des exercices F2School
Donnez la formule et le nom de l'acide conjugué correspondant aux Quel est le nom des acides suivants : Ions : H3O+ Cl– et très peu de OH–
Comment s'appelle l'ion H3O+ ?
L'ion hydronium est le plus simple des ions oxonium ; sa formule chimique est H3O+ ou H+(aq). En solution aqueuse, il est solvaté par plusieurs molécules d'eau et peut être écrit H7O3+, H9O4+ etc. Il résulte de la protonation d'une molécule d'eau soit par un acide, soit par autoprotolyse de l'eau.C'est quoi H3O Cl ?
Il est un ion hydrogène hydraté.Quelle est la base de H3O+ ?
L'eau se comporte comme une base vis-à-vis d'un acide. Le couple considéré est: H3O+ / H2O (l'eau est la base du couple).- L'acide conjugué d'une base très faible ou nulle est un acide fort (les couples chlorure/acide chlorhydrique, bromure/acide bromhydrique et iodure/acide iodhydrique par exemple). Pour les cas intermédiaires, plus la base est forte, plus l'acide conjugué est faible et inversement.
Définitions
proton H proton H Quand un acide cède un proton, il se transforme en sa base conjuguée. Quand une base capte un proton, elle se transforme en son acide conjugué.Les deux forment un couple acide-base.
Écriture
à gauche et la base toujours à droite.
Exemples
L'acide éthanoïque CH
COOH peut céder un proton H
et se transformer en CH COO , l'ion éthanoate, qui est sa base conjuguée.Le couple s'écrit CH
COOL'ammoniac NH
qui est une base peut capter un proton H et se transformer en NH , l'ion ammonium, qui est son acide conjugué.Le couple s'écrit NH
Pourquoi un proton s'écrit-il H
Un noyau d'hydrogène
est composé d'un proton et de zéro neutron. Un atome d'hydrogène H est donc composé d'un proton et d'un électron.Un ion hydrogène H
, qui a perdu un électron, ne sera donc plus composé que d'un proton d'où l'écriture H pour un proton.Les ions H
que combinés à des molécules d'eau, sous forme d'ions oxonium H O .9782340-038325_001_224.indd 6TOP CHRONO
C'est l'interro !
Exercice 1.1
Parmi les espèces chimiques suivantes, écrire les couples acide-base conjugués HNO , Na , NH , H O, H O , NO , Cl , OH , NHExercice 1.2
VraiFaux
1. L'acide conjugué de OH
est H O2. La base conjuguée de HS
est H S.3. L'acide conjugué de HSO
est H SO4. La base conjuguée de H
CO est HCO 5. H PO est un couple acide-base.Exercice 1.3
1. Écrire la base conjuguée des espèces suivantes puis écrire les couples
a. C H NH b. HCO c. HS2. Écrire l'acide conjugué des espèces suivantes puis écrire les couples acide-
a. C H O b. H PO9782340-038325_001_224.indd 7
2Définition
Un ampholyte (nom) ou une espèce amphotère (adjectif) est une espèce chimique pouvant se comporter soit comme un acide soit comme une base.Conséquence
dans l'autre couple sous forme de base.Exemples
• L'eau H H OO et H
Acide Base Acide Base
• L'ion hydrogénocarbonate HCO CO , H et HCOAcide Base Acide Base
puisse soit capter soit céder un proton H H 3 O HO ou OH CO 2 , H 2O ou H
2 CO 3 HCO 3 CO 3 2- H 29782340-038325_001_224.indd 8
TOP CHRONO
C'est l'interro !
Exercice 2.1
Parmi les espèces écrites ci-dessous, indiquer les espèces amphotères en précisant les couples acide-base correspondants HS H NH H POExercice 2.2
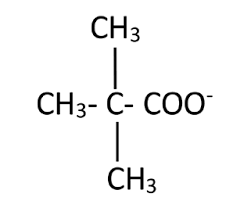
Les acides α-aminés existent majoritairement en solution sous forme d'amphions ou zwitterions qui sont des espèces amphotères. Ainsi la glycine NH CH COOH existe majoritairement sous la forme NH CH COO Écrire les deux couples correspondant à l'espèce amphotère en précisant à chaque fois quel est l'acide et quelle est la base.Exercice 2.3
1. Donner les formules des trois produits obtenus par perte successive de
proton.2. Écrire les couples acide-base correspondants.
3. Parmi toutes les espèces obtenues successivement, lesquelles sont des
9782340-038325_001_224.indd 9
3COMMENT ÉCRIRE
Deux acides ne peuvent pas réagir ensemble.
Deux bases ne peuvent pas réagir ensemble.
Une réaction acide-base correspond à un transfert de proton H entre l'acide d'un couple et la base d'un autre couple.L'acide va céder un proton H
et se transformer en sa base conjuguée.Ce proton H
va être récupéré par la base qui, elle, va se transformer en son acide conjugué.Exemples
COOH et l'eau H
O. CH COO H O O et l'acide méthanoïque HCOOH. NH O + Cl ) et une solution d'hydroxyde de sodium (Na +OH H O O H9782340-038325_001_224.indd 10
TOP CHRONO
C'est l'interro !
Exercice 3.1
1. NH O ...................................................................................... 2. C H3. HCOO
O 4. CH COO 5. CH NH H OH ............................................................................Exercice 3.2
1. Acide propanoïque CH
CHCOOH et ammoniac NH
2. Solution d'acide chlorhydrique (H
O + Cl ) et ion butanoate CH CH CH COO3. Acide phosphorique H
PO et eau H O.4. Acide ascorbique C
H O et ion hydrogénocarbonate HCO5. Acide lactique C
H O et ion carbonate COExercice 3.3
Écrire les réactions acide-base éventuelles correspondant aux expériences1. On réalise le titrage entre une solution d'acide nitrique (H
quotesdbs_dbs44.pdfusesText_44[PDF] cas cliniques
[PDF] autoprotolyse de l'eau
[PDF] une maladie a incidence sociale c'est quoi
[PDF] zone de virage phénolphtaléine
[PDF] caractéristique d'une maladie a incidence sociale
[PDF] acide sulfanilique
[PDF] pourquoi peut-on affirmer qu'une mcv est une maladie sociale
[PDF] bleu de bromothymol
[PDF] maladie incidence sociale définition
[PDF] maladies sociales
[PDF] bbt
[PDF] liste maladie rare
[PDF] interpretation graphique d'une equation
[PDF] rouge de crésol zone de virage