 Les réactions acido-basiques
Les réactions acido-basiques
1) Pour les acides forts. Les solutions d'acides chlorhydrique nitrique et sulfurique contiennent en très grande quantité l'ion oxonium H3O+ appartenant au
 TD1 : Acides et bases
TD1 : Acides et bases
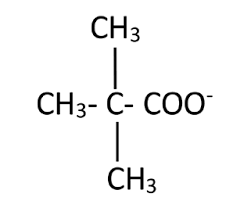
Son nom IUPAC complet est acide 2- amino-4-méthylpentanoïque. 11. a) Dans ce HCl + H2O→Cl– + H3O+. Donc on peut assimiler l'eau de pluie testée à un ...
 Fiche de présentation et daccompagnement - Chapitre
Fiche de présentation et daccompagnement - Chapitre
Nom de l'activité : L'acidité d'une solution (Python). Type d'activité Concentration obtenue [H3O+] (mol/L). 0100. Volume de la fiole (mL). Volume de ...
 Tableau de certains ions polyatomiques Formules Constantes et
Tableau de certains ions polyatomiques Formules Constantes et
dans l'eau à 25 °C. Ions -. 1. Ions -. 2. Ions -. 3. Formule Nom. Formule Nom. Formule Nom. H2PO4. –. H2PO3. –. HCO3. –. HSO4. –. HSO3. –. BrO3. –. CH3COO–.
 Chapitre 1 Acides et bases
Chapitre 1 Acides et bases
Nom. Teinte acide. Zone de virage. Teinte basique. Hélianthine rouge. 31 < pH < 4
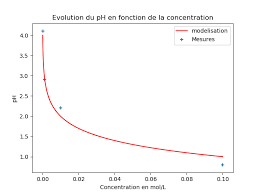
 Mesures de pH
Mesures de pH
de formule HCℓ était connu sous le nom d'acide muriatique ou encore d'esprit de sel. À l'aide de Régressi
 COMMENT ÉCRIRE UN COUPLE ACIDE‑BASE ?
COMMENT ÉCRIRE UN COUPLE ACIDE‑BASE ?
Les affirmations suivantes sont‑elles vraies ou fausses ? 1. L'acide conjugué de OH– est H3O+. 2. La base conjuguée de HS– est H2S. 3
 Untitled
Untitled
H3O* est [H3O+]= 10³ mol.L¨¹. II. Théorie de Bronsted des acides et des bases ... Nom du couple. Ammoniac/ion ammonium. Acick Ethancque / Ethanoate. ICN). Auck.
 CORRECTION EXERCICE C9
CORRECTION EXERCICE C9
A partir de la valeur de pH mesurée on trouve : [H3O+] = 10-3
 Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
solutions acides utilisées sont d'une part une solution d'acide chlorhydrique (H3O+ (aq) + Cl− Le nom « ascorbique » vient du préfixe grec a (privatif) et ...
 nomeclature miné
nomeclature miné
Pour être à l'aise en chimie il est nécessaire de connaître le nom
 Mesures de pH
Mesures de pH
l'acide sulfurique sur le chlorure de sodium d'où son nom «muriatique» appartenant au Plus le pH est petit
 Les réactions acido-basiques
Les réactions acido-basiques
Les solutions d'acides chlorhydrique nitrique et sulfurique contiennent en très grande quantité l'ion oxonium H3O+ appartenant au couple H3O+(aq) / H2O(l).
 Chapitre 1 Acides et bases
Chapitre 1 Acides et bases
où H3O+ est l'ion hydronium ou oxonium
 Les acides et les bases + H+ + H3O+ + H+ + NH4
Les acides et les bases + H+ + H3O+ + H+ + NH4
étant plus faible que celle en H3O+ ; c'est l'ion hydronium H3O+ qui présente un danger. Justifier le mot acide dans le nom acide nitrique.
 COMMENT ÉCRIRE UN COUPLE ACIDE?BASE ?
COMMENT ÉCRIRE UN COUPLE ACIDE?BASE ?
Un ampholyte (nom) ou une espèce amphotère (adjectif) est une espèce Réaction entre une solution d'acide chlorhydrique (H3O+ + Cl–) et une solution.
 TD1 : Acides et bases
TD1 : Acides et bases
Application numérique : [H3O+] = 40.10?8 mol.L?1. 2. a) La réaction qui a lieu est la dissociation de la soude dans l'eau : NaOH +
 pKa de divers couples acido-basiques
pKa de divers couples acido-basiques
Nom de l'acide. Base conjuguée Cl- ion chlorure. -3. H2SO4 acide sulfurique. HSO4. - ion hydrogénosulfate ... H3O+ ion hydronium.
 Transformations chimiques en solution aqueuse
Transformations chimiques en solution aqueuse
L'eau peut accepter un proton pour donner l'ion oxonium H3O+ mais c'est aussi un acide NOM. FORMULE MOLECULAIRE. NATURE. Acide sulfurique.
 Lacide chlorhydrique : une solution dangereusem ent efficace
Lacide chlorhydrique : une solution dangereusem ent efficace
L'acide chlorhydrique aussi connu sous le nom acide muriatique
 [PDF] TD1 : Acides et bases - UTC
[PDF] TD1 : Acides et bases - UTC
a) La concentration [H3O+] est donnée par le pH de cette solution : [H3O+] = 10?pH Application numérique : [H3O+] = 631 10?5 mol L?1
 [PDF] Chapitre 1 Acides et bases
[PDF] Chapitre 1 Acides et bases
où H3O+ est l'ion hydronium ou oxonium aussi appelé “proton hydraté” puisqu'il s'agit d'un proton (H+) attaché à une molécule d'eau La concentration [H3O+]
 [PDF] Les réactions acido-basiques
[PDF] Les réactions acido-basiques
Les solutions d'acides chlorhydrique nitrique et sulfurique contiennent en très grande quantité l'ion oxonium H3O+ appartenant au couple H3O+(aq) / H2O(l)
 [PDF] Mesures de pH - Labo TP
[PDF] Mesures de pH - Labo TP
TPC1 Chapitre C1 Mesures de pH Noms : On désire mesurer le pH de différentes solutions d'acide chlorhydrique (H3O+ (aq) C??
 [PDF] COURS DE CHIMIE GENERALE Semestre 1 SVI
[PDF] COURS DE CHIMIE GENERALE Semestre 1 SVI
Chaque atome est désigné par son nom et son symbole Exemple : Oxygène : O Chlore : Cl Les atomes diffèrent par leurs structures et leurs masses
 [PDF] Filière Sciences de la Matière Chimie Cours Chimie des Solutions
[PDF] Filière Sciences de la Matière Chimie Cours Chimie des Solutions
acide dans l'eau comme le nombre de mol d'ion H3O+ susceptible d'être libérés par un litre de solution De même la normalité oxydo-réductrice d'une
 [PDF] Chapitre 11 Formule Nom Test didentification Couleur en solution Io
[PDF] Chapitre 11 Formule Nom Test didentification Couleur en solution Io
H3O+ Ion oxonium solution acide incolore Na+ Ion sodium incolore Mg2+ Ion magnésium Ag++Cl- ? AgCl incolore Zn2+ Ion zinc incolore Formule Nom
 [PDF] H+ ou H3O+
[PDF] H+ ou H3O+
Mais l'ion H+ qui est un simple proton ne se promène pas seul en solution On utilise donc la notation H+ pour écrire le lien entre un acide et sa base
 [PDF] Transformations chimiques en solution aqueuse - Chimie en PCSI
[PDF] Transformations chimiques en solution aqueuse - Chimie en PCSI
L'eau peut accepter un proton pour donner l'ion oxonium H3O+ mais c'est aussi un acide NOM FORMULE MOLECULAIRE NATURE Acide sulfurique
 [PDF] Les acides et les bases Corrigés des exercices F2School
[PDF] Les acides et les bases Corrigés des exercices F2School
Donnez la formule et le nom de l'acide conjugué correspondant aux Quel est le nom des acides suivants : Ions : H3O+ Cl– et très peu de OH–
Comment s'appelle l'ion H3O+ ?
L'ion hydronium est le plus simple des ions oxonium ; sa formule chimique est H3O+ ou H+(aq). En solution aqueuse, il est solvaté par plusieurs molécules d'eau et peut être écrit H7O3+, H9O4+ etc. Il résulte de la protonation d'une molécule d'eau soit par un acide, soit par autoprotolyse de l'eau.C'est quoi H3O Cl ?
Il est un ion hydrogène hydraté.Quelle est la base de H3O+ ?
L'eau se comporte comme une base vis-à-vis d'un acide. Le couple considéré est: H3O+ / H2O (l'eau est la base du couple).- L'acide conjugué d'une base très faible ou nulle est un acide fort (les couples chlorure/acide chlorhydrique, bromure/acide bromhydrique et iodure/acide iodhydrique par exemple). Pour les cas intermédiaires, plus la base est forte, plus l'acide conjugué est faible et inversement.
Transformations
chimiques en solution aqueuseChapitre SA1_PC : Réactions acide-base
Cours de chimie de seconde période de PCSI PC
2PCSI-option PC
RĠactions en solution
Chapitre SA_1 Acido-basicitĠ
I QUE SONT LES ACIDES ET LES BASES ? 4
1. ACIDE ET BASE : DEFINITIONS SELON LA THEORIE DE BRÖNSTED ET LOWRY 4
2. ACIDES ET BASES CONJUGUEES 5
3. QUELQUES EXEMPLES DE COMPORTEMENT ACIDO-BASIQUE : POLYACIDE ET POLYBASE ; COMPOSE
AMPHOTERE. 5
3.1. ECHANGE DE PROTON ENTRE LES MOLECULES DǯEAU 5
3.2. ESPECES AMPHOTERES 6
3.3. POLYACIDES ET POLYBASES 6
4. ǯECHELLE DES PH 7
4.1. LA DEFINITION DU PH DǯUNE SOLUTION AQUEUSE 7
4.2. QUELQUES VALEURS TYPIQUES DE PH DE SOLUTIONS AQUEUSES COURANTES. 8
5. ACIDES ET BASES COURANTS DU LABORATOIRE ET DE LA VIE COURANTE, AU PROGRAMME 8
II Ȃ LA REACTION ACIDE/BASE 8
1. LES ACIDES FORTS ET LES BASES FORTES 8
2. LES ACIDES FAIBLES ET LES BASES FAIBLES : CONSTANTE DǯACIDITE ASSOCIEE 10
3. CLASSEMENT DES ACIDES ET DES BASES SUR UNE ECHELLE DE PKA 11
4. PREVISION DU CARACTERE TOTAL OU TRES LIMITE DES REACTIONS 12
III. DIAGRAMME DE PREDOMINANCE DES FORMES ACIDE ET BASE ET DIAGRAMME DEDISTRIBUTION 13
1. DIAGRAMME DE PREDOMINANCE 13
2. DIAGRAMME DE DISTRIBUTION 16
IV Ȃ ETABLISSEMENT DE LA COMPOSITION DE QUELQUES SOLUTIONS " SIMPLE » ;METHODE DE LA REACTION PREPONDERANTE 17
V Ȃ LES SOLUTIONS TAMPON 20
1. PROPRIETES ET DEFINITION 20
2. EXEMPLES 20
3. PREPARATION 21
VI Ȃ LES TITRAGES ACIDO-BASIQUES 22
3 nécessaire à la vie : tu es la vie.A. de Saint Exupéry, Terre des hommes
4I Que sont les acides et les bases ?
En 1923, le chimiste danois Johannes Nicolaus BRÖNSTED (chimiste danois né en 1879 Ȃ mort en 1947) proposa de définir un acide et une base ainsi : Un acide est un donneur de proton (ou une espèce capableUne base est un accepteur de proton
Ces mêmes définitions ont été données indépendamment par le chimiste anglais Thomas
Martin LOWRY (chimiste anglais né en 1874 Ȃ mort en 1936), et la théorie fondée sur ces " Un acide est un donneur de proton et une base un accepteur de proton. » 52. Acides et bases conjuguées
accepte un proton. - sont des espèces conjuguées. AH et A- constituent un couple acide-base. On peut associer à ce couple une " demi-équation-protonique » :Exemples :
ESPECE ESPECE CONJUGUEE
Acide conjugué de la base HCO3-
donneur et un accepteur ; la réaction acide-base implique donc toujours deux couples acide-base.3. Quelques exemples de comportement acido-basique : polyacide et polybase ;
composé amphotère. Nous dirons que ǯ est amphiprotique, ou bien amphotère :2 H2O(l) = H3O+(aq) + HO-(aq) KE
AH+A-H+
Donneur Accepteur Particule
6"" - 7 :
KE = aéq(H3O+(aq)). aéq(HO-(aq))/ a2éq(H2O(l)) Solution diluée idéale : KE = [H3O+][ HO-]/c°2 température T.Ainsi, à 25°C, KE = 1,0.10-14
KE = 1,9.10-14
Rem : on utilise souvent pKE : pKE = -Log(KE) alors : KE = 1,0.10-14 pKE = 143.2. Espèces amphotères
amphotère, ou un ampholyte. du couple H2PO4- / HPO42-.2 H2PO4- = H3PO4 + HPO42-
D1 A1
A2 D2
3.3. Polyacides et polybases
phosphorique H3PO4 peut céder 3 protons, en impliquant successivement les 3 couples suivants : H3PO4 / H2PO4- : H3PO4 = H2PO4- + H+H2PO4- / HPO42- : H2PO4- = HPO42- + H+
HPO42- / PO43- : HPO42- = PO43- + H+
De même, une polybase est une espèce susceptibl ǯ......"-" "" ""-
(successivement le plus souvent, parfois simultanément) ǣ ǯ ""- 0C43- ci-
dessus est une polybase. 74. ǯ±... des pH
énormément, de plusieurs ordres de grandeurs : elles peuvent atteindre 1 mol.L-1 dans4.1. La définition du " ǯ lution aqueuse
Le pH (" potentiel Hydrogène ») ǯ - ±-±
hydrogène, puis quelques années plus tard, en fonction de leur activité : pH = - Log(aH3O+) dans le cadre de notre étude : solution aqueuse diluée idéale pH= - Log([H3O+]/c°)Soren Peter Lauritz
Sßrensen
1868-1939
des ions oxonium est Rem : on peut aussi définir le "C ǯ solution : pOH = - Log(aHO-)On établit alors sans difficulté :
pH + pOH = pKE = 14,0 (à 25°C) 84.2. Quelques valeurs typiques de pH de solutions aqueuses courantes.
Voir Figure 14.11 ci-dessus
5. Acides et bases courants du laboratoire et de la vie courante, au programme
NOM FORMULE MOLECULAIRE NATURE
Acide sulfurique H2SO4 Diacide
Première acidité forte
Acide nitrique HNO3 Acide fort
Acide chlorhydrique HCl Acide fort
Acide phosphorique H3PO4 Triacide
Première acidité faible
assez forteAcide acétique = acide
éthanoïque
CH3COOH Acide faible
Potasse KOH Base forte
Soude NaOH Base forte
Ammoniac NH3 Base faible
Ion hydrogénocarbonate
(ou bicarbonate/eaux minérales)HCO3- Espèce amphotère
II - la réaction acide/base
1. Les acides forts et les bases fortes
Nous pouvons appliquer le même raisonnement aux bases fortes. 9 conjugué, et HO-. On peut alors dire que AH est un donneur de proton plus faibleDans une solution de base forte, le seul accepteur de proton " survivant » - ǯ C-.
définirons ainsi un acide fort : Un acide fort est un acide dont la rĠaction d'hydrolyse est totale ͗ l'acide fortAH est entiğrement dissociĠ dans l'eau.
Un acide fort appartient à un couple acide/base pour lequel pKA <0.Ainsi :
solutions aqueuses de chacun de ces acides sont équivalentes du point de vue la base NO3- dans le premier cas, et la base Cl- dans le second. que :Ainsi :
est totale et les solutions qui contiennent ces bases fortes sont équivalentes du point de vue acido-basiques : elles contiennent toutes les deux la base HO- à la mêmeCH3CH2OH, et NH3.
10 = - Log KA. hydrolysé et cela se produit par la réaction chimique : AH(aq) + H2O(l) = A-(aq) + H3O+(aq) constante d'équilibre K° = KA. KA est la constante d'acidité du couple acide base AH/A- on associe pKA au couple acide/base AH/A- pKA = Log(KA) soit : KA = 10-pKAConstante d'acidité des couples acide-base :
ǯ " : pKA(H3O+/H2O) = 0 de température T. BH+. totale, il reste des molĠcules d'acide AH, prĠsent aǀec A- partiellement hydrolysé et cette transformation se produit par la réaction chimique :AH(aq) + H2O(l) = A-(aq) + H3O+(aq)
11On retiendra que :
exemple 1 : exemples de couples acide/base3. Classement des acides et des bases sur une échelle de pKA
Les couples acide-base peuvent être placés sur une échelle verticale de pKA, les basesétant placés à gauche, de plus en plus fortes de bas en haut et les acides à droite, de plus
en plus forts de haut en bas.Acides de
plus en plus forts 12 Nous avons déjà dit que tous les acides forts ont le même comportement dans l'eau : il par l'eau. Il en est de même pour les bases fortes.On dit que des forts, et les bases fortes.
4. Prévision du caractère total ou très limité des réactions
Notons pKA1 = KA(A1H/A1-) et pKA2 = KA(A2H/A2-) :
ǯ±"" Ąι α ĄA1/KA2 soit : A1H + A2- = A1- + A2H K° = 10(pKA2 - pKA1) 13Si pKA = pKA2 Ȃ pKA1 > 0 : A1H est un acide plus fort que A2 - ǯ±-- ǯ±"" -
déplacé vers la droite. Si pKA = pKA1 Ȃ pKA2 > 3 : la réaction est considérée quantitative.Si pKA = pKA2 Ȃ pKA1 < 0 : A2H est un acide plus fort que A1 - ǯ±-- ǯ±"" -
déplacé vers la gauche.Si pKA = pKA1 Ȃ pKA2 < -3 : la réaction est considérée comme très très peu déplacée
Ainsi :
maximal max.A ǯ"ǡ réaction dont la constante est inférieure à 10-3 ne modifie pas la
composition de la solution ǣ ǯ a pas modification des concentrations des réactifs. Cela
III. Diagramme de prédominance des formes Acide et Base et diagramme de distribution1. Diagramme de prédominance
- ... ǯ±-"" relation suivante, qui lie pH, pKA et les concentrations [A-] et [AH]
Si pH = pKA [AH] = [A-]
Si pH > pKA [A-] > [AH] la base est l'espèce prédominante Si pH < pKA [AH] > [A-] l'acide est l'espèce prédominante On peut alors tracer un diagramme de prédominance " simple »A[A ]pH=pK +Log( )[AH]
14 diagramme de prédominance à 10 % On admet que [A-] est négligeable devant [AH] si [A-] < 1/10. [AH] i.e pH < pKA Ȃ1 diagramme de prédominance à 1 % On admet que [A-] est négligeable devant [AH] si [A-] < 1/100. [AH] i.e pH < pKA Ȃ2Remarque importante pour la suite
Habituellement, on néglige une espèce Y devant X lorsque [X]>10[Y] 15 Avec ce critère, indiquer sur quel domaine de pH une solution contient en quantités notables les deux espèces conjuguées AH et A- : pH entre pKA Ȃ 1 et pKA + 1 Un diagramme de prédominance permet également de voir rapidement si deux espèces peuvent ou non coexister en solution aqueuse : Des diagrammes de distribution, on en déduit que deux espèces qui ont des domaines de stabilité disjoints ne peuvent coexister en quantité notable. Exemple : pKA1(PhCOOH / PhCOO-) = 4,2 et pKA2(NH4+ / NH3) = 9,2 à 25°quantités notables ils réagissent selon une réaction quantitative en donnant leur espèces
conjuguées, qui, elles, peuvent coexister en solution aqueuse.PhCOOH + H2O = PhCOO- + H3O+ ...-- ǯ±"" KA1
NH4+ + H2O = NH3 + H3O+ ...-- ǯ±"" KA2
Et la réaction qui a lieu est :
PhCOOH + NH3 = PhCOO- + NH4+ ...-- ǯ±"" Ąι
162. Diagramme de distribution
Par ailleurs, l'utilisation de logiciels de simulation (tel que le logiciel dozzaqueux) ou tout simplement de calculs (comme EXCEL, MAPLE) permet d'obtenir des diagrammes de distribution, donnant le pourcentage des différentes formes des espèces en fonction du pH. Ainsi, dans le cas de l'acide phosphorique, on obtient le diagramme de distribution suivant : 1).Exemple :
% de la forme H3PO4 % de la formeH2PO4(-)
% de la formeHPO4(2-)
% de la formePO4(3-)
17 (1)(2)(3) Déterminer à partir des trois courbes de distribution les valeurs numériques des constantes d'acidité associées aux couples acido-basiques HiSeO3i-2 / Hi-1SeO3i-3, avec i = 1 ou 2. IV - Etablissement de la composition de quelques solutions " simple » ; méthode de la Réaction Prépondérante La méthode de la réaction prépondérante Repérer les acides, les bases, les espèces indifférentes Repérer la réaction prépondérante, notée RP, qui est dans le plus souvent celle pKA construite comme précédemment. 2 situations : réaction totale : en tenir compte et reprendre le raisonnement avec la nouvelle solution obtenue, appelée " solution équivalente ». facilement déduit. Vérifier la cohérence du résultat, et, éventuellement, la validité des approximations faites. 18 Faire l'Inventaire des espèces introduites dans la solution et calculer leurs concentrations. Appliquer la méthode de la réaction prépondérante (RP), afin de déterminer envisageant des solutions intermédiaires dites équivalentes à la solution initiale. Les réactions prépondérantes quantitatives (RQ) : quantitatives, elles entraînent la Les réactions prépondérantes de contrôle (RC) : non quantitatives, elles ne modifient que partiellement la quantité de certaines espèces, et permettent de déterminer la composition de la solution. Lorsque deux devront être envisagées, celle de plus grand avancement volumique est appelée réaction prépondérante instructions du programme, seule une RRP sera à prendre en compte. Vérifier la validité des hypothèses faites : le résultat est-il cohérent ? 19 Schéma 1 :algorithme présentant la méthode de la R.PPage | 35
Dmarche gnrale :
Faire le bilan des espces
introduites en les plaant sur une chelle verticale A / DRechercher la RP : Donneur
le plus fort et Accepteur le plus fortCalculer sa constante
d'quilibre KLa raction est-elle quantitative ?
Faire un bilan de
matire partir de cette RP et tudier la solution quivalenteOUI NON
Rsoudre l'quation
pose en effectuant d'ventuelles simplifications et approximations avant la rsolution. Vrifier posteriori la validit des hypothses faites : le rsultat obtenu est-il cohrent ? OUIConclure
NONReprendre le e en tenant compte de
secondaires ou en revoyant certaines approximations qui ne se justifient pas. 20V - Les solutions tampon
1. Propriétés et définition
Une solution tampon est une solution dont le pH varie peu par un apport fort(e) uniquement, ou soit par dilution uniquement : on dit que ces solutions sont des pseudo-tampon.2. Exemples
Le sang et les autres fluides cellulaires sont tamponnés à pH = 7,4Les océans sont maintenus à pH=8,4
21la tangente se confond bien avec la courbe lorsque l'on se situe autour de la Au voisinage de la demi-équivalence, le pH ne varie pas beaucoup : lors d'un ajout de modĠrĠ de base forte, lors d'un ajout modĠrĠ d'acide fort ou bien par dilution : la solution obtenue est une solution tampon.
3. Préparation
voisinage du pKA du couple AH/A- que les propriétés tampon sont les meilleures. Par conséquent, on préparera une solution tampon de pH connu en utilisant un couple acide/base dont le pKA a une valeur proche du pH recherché. Les quantités de matièreExemples de solutions tampon typiques
Composition
TAMPONS ACIDES TAMPONS BASIQUES
CH3COOH/CH3COO- 4,74 NH4+/NH3 9,25
HNO2/NO2- 3,37 (CH3)3NH+/(CH3)3NH 9,81
HClO2/ClO2- 2,00 H2PO4-/HPO42- 7,21
22VI - Les titrages acido-basiques
Cette partie sera développée en travaux pratiques.quotesdbs_dbs44.pdfusesText_44[PDF] cas cliniques
[PDF] autoprotolyse de l'eau
[PDF] une maladie a incidence sociale c'est quoi
[PDF] zone de virage phénolphtaléine
[PDF] caractéristique d'une maladie a incidence sociale
[PDF] acide sulfanilique
[PDF] pourquoi peut-on affirmer qu'une mcv est une maladie sociale
[PDF] bleu de bromothymol
[PDF] maladie incidence sociale définition
[PDF] maladies sociales
[PDF] bbt
[PDF] liste maladie rare
[PDF] interpretation graphique d'une equation
[PDF] rouge de crésol zone de virage
