 Action de lalcool amylique tertiaire (hydrate damylène) sur la
Action de lalcool amylique tertiaire (hydrate damylène) sur la
L'alcool amylique tertiaire ou hydrate d'amylène
 Préparation de Quelques Dihydrocholestérols Alkylés (3â
Préparation de Quelques Dihydrocholestérols Alkylés (3â
A I'etat solide ces alcools tertiaires
 Réaction destérification
Réaction destérification
acide carboxylique + alcool ? ester + eau. pour un alcool tertiaire ? = 0
 Chimie organique
Chimie organique
PASSAGE DE L'ALCOOL A SA BASE CONJUGUEE L'ION ALCOOLATE
 UE1 – CHIMIE PIFO FICHE N°8 : LES ALCOOLS
UE1 – CHIMIE PIFO FICHE N°8 : LES ALCOOLS
Acidité et basicité d'un alcool. Réactivité due à la basicité des alcools. ... D'un alcool tertiaire.
 Alcools et étheroxydes
Alcools et étheroxydes
Un alcool tertiaire est plus réactif qu'un alcool secondaire ou qu'un alcool primaire. Ceci peut s'expliquer par les différences de polarité de la liaison C-O
 Chapitre 23
Chapitre 23
Oxyder les alcools en phase aqueuse. I – Les produits des oxydations 3) Alcool tertiaire ... II – Équation des oxydations d'alcool en solution aqueuse.
 ??????? ????????? ???? ????? ?????? - ?????? ?????? 2021 2020 – ???????? ?
??????? ????????? ???? ????? ?????? - ?????? ?????? 2021 2020 – ???????? ?
(a) et (c) sont des alcools secondaires. c. (b) est l'isomère de fonction de (a). d. Le nom de l'alcool tertiaire isomère
 Recherches sur la formation et la transformation des esters XXXV
Recherches sur la formation et la transformation des esters XXXV
les acides polyphosphoriques2) a pu &re appliquke avec sucds aux alcools u-tri-. halogCnCs primaires et secondaires utilisCs. Le seul alcool tertiaire de ce
 ÉTUDES CONFORMATIONNELLES EN SÉRIE
ÉTUDES CONFORMATIONNELLES EN SÉRIE
SUR LA STEREOCHIMIE DES ALCOOLS TERTIAIRES DERIVES DE LA configuration relative de chaque alcool tertiaire obtenu par rkaction de Grignard sur la.
 [PDF] Les alcools en chimie organique Table des matières - ENS Lyon
[PDF] Les alcools en chimie organique Table des matières - ENS Lyon
20 jan 2020 · tertiaire Plusieurs propriétés des alcools sont importantes à retenir : — La liaison O-H est une liaison polarisée du fait de la forte
 [PDF] alcools sujet - Master Prépa Santé
[PDF] alcools sujet - Master Prépa Santé
A Un alcool primaire est plus acide qu'un alcool tertiaire B Les alcools tertiaires ont un rendement plus important lors d'une réaction d'estérification
 [PDF] C2 - Les alcoolspdf
[PDF] C2 - Les alcoolspdf
Un alcool est un composé organique dans lequel un hydroxyde « -OH » est On distingue trois catégories d'alcools (primaire secondaire et tertiaire)
 Les alcools - Cours de chimie - Lycée Faidherbe de Lille
Les alcools - Cours de chimie - Lycée Faidherbe de Lille
Un alcool tertiaire comme le 2-méthylpropan-2-ol (tertiobutanol) est transformé en chlorure par simple agitation avec l'acide chlorhydrique concentré à froid
 [PDF] Alcools et étheroxydes
[PDF] Alcools et étheroxydes
trois autres atomes de carbone l'alcool est tertiaire revanche une molécule comportant une fonction alcool et une fonction aldéhyde cétone ou acide
 [PDF] Les alcools - Chimie Physique
[PDF] Les alcools - Chimie Physique
Parmi les fonctions monovalentes la fonction alcool présente la réactivité la 1- Lorsque le dérivé halogéné est secondaire ou tertiaire on observe
 [PDF] Oxyder les alcools en phase aqueuse
[PDF] Oxyder les alcools en phase aqueuse
3) Alcool tertiaire Oxydation ménagée en solution aqueuse II – Équation des oxydations d'alcool en solution aqueuse 1) Quels sont les réactifs ?
 Réactivité de la Fonction Alcool - 2ATP
Réactivité de la Fonction Alcool - 2ATP
Un alcool tertiaire n'est pas sensible dans les conditions classiques à l'action d'un oxydant Un alcool secondaire est quant à lui oxydé en cétone
 [PDF] Chimie organique
[PDF] Chimie organique
Alcools secondaires et tertiaires : trop de risques ! La réaction de déshydratation d'un alcool tertiaire est effectuée en présence d'un acide
Quels sont les alcools tertiaire ?
En chimie, un alcool est dit tertiaire lorsque le groupe hydroxyle -OH est porté par un atome de carbone tertiaire, c'est-à-dire lié à trois atomes de carbone.Comment reconnaître un alcool tertiaire ?
Un alcool est tertiaire si sur un même carbone se trouvent une ramification et la fonction alcool.Quelles sont les trois classes d'alcool ?
Les alcools sont classés en trois classes :
primaire,secondaire.et tertiaire.- Réaction : Oxydation d'un alcool primaire en un aldéhyde
Les alcools tertiaires ne peuvent pas être oxydés par ces méthodes sans rompre une liaison carbone-carbone. En effet, l'oxydation se déroule en éliminant un atome d'hydrogène de l'atome de carbone auquel le groupe hydroxyle est attaché.
 0 2 4 6 8 10 12 14
0 2 4 6 8 10 12 14 0510152025
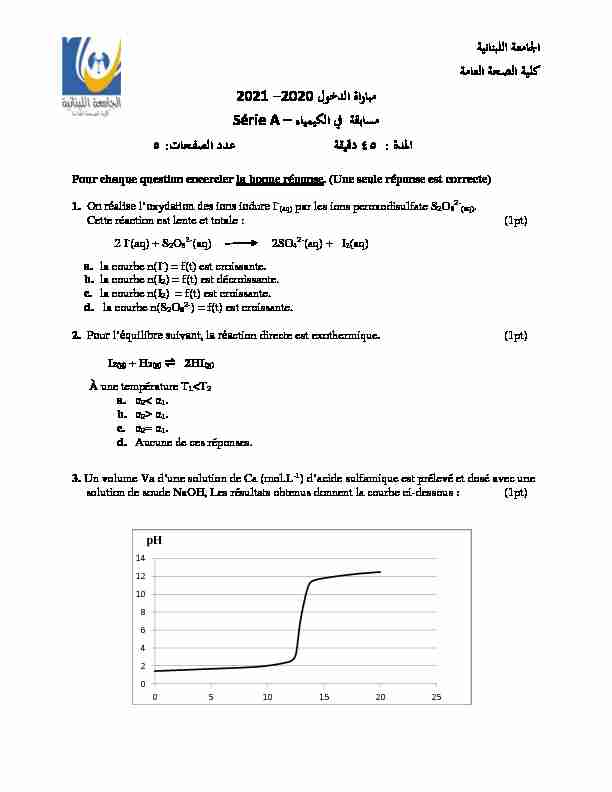
pH Pour chaque question encercler la bonne réponse. (Une seule réponse est correcte)1. -(aq) par les ions peroxodisulfate S2O82-(aq).
Cette réaction est lente et totale : (1pt)2 I-(aq) + S2O82-(aq) 2SO42-(aq) + I2(aq)
a. la courbe n(I-) = f(t) est croissante. b. la courbe n(I2) = f(t) est décroissante. c. la courbe n(I2) = f(t) est croissante. d. la courbe n(S2O82-) = f(t) est croissante.2. ction directe est exothermique. (1pt)
I2(g) + H2(g) ֖
À une température ǵ1 a. Į2< Į1. b. Į2Į1. c. Į2Į1. d. Aucune de ces réponses. 3. Un volume Va dune solution de Ca (mol.L-1) dacide sulfamique est prélevé et dosé avec une
solution de soude NaOH, Les résultats obtenus donnent la courbe ci-dessous : (1pt) ϊΑΎΗϲϓΔϘΑΎγϣ ˯ΎϳϣϳϛϟSérie A -˻ a. Lacide sulfamique est un acide fort car la courbe montre un point dinflexion et pHE = 7. b. Lacide sulfamique est un acide fort car Ca = 10-2 mol.L-1 et pHE = 7. c. Lacide sulfamique est un acide faible car Ca< 10-2 mol.L-1 et pHE> 7. d. E< 7. 4. Dans le cas du dosage colorimétrique d'un acide faible par une solution de soude, il est
nécessaire de choisir un indicateur dont la zone de virage est: (1pt) a. Entre 7 et 10. b. Entre 6 et 7. c. Entre 4 et 6. d. Entre 3 et 5. 5. é A constitué de C, H et O a donné les
pourcentages en masse suivants: C = 60% and H = 13.3%. Sachant que la masse molaire de A est de 60 g.mol-1, la formule moléculaire de A est : (1pt) a. C4H10O. b. C3H8O. c. C3H6O. d. C4H8O2 Masse molaire atomique en g.mol-1 : C=12, O=16 et H=1 6. Une dilution est effectuée en utilisant une solution commerciale de peroxyde d'hydrogène S0
de concentration molaire C0 = 7,5 mol.L-1. La solution S0 est diluée 125 fois dans le but de préparer une solution S de volume de 1 L. Les verreries nécessaires pour obtenir cette dilution
sont: (1.5pt) a. Pipette graduée de 10 mL et fiole jaugée de 1000 mL. b. Pipette jaugée de10mL et fiole jaugée de 1L. c. Pipette graduée de 5 mL et fiole jaugée de 1000 mL. d. Eprouvette graduée de 8 mL et fiole jaugée de 1L. 7. (1.5pt)
ϊΑΎΗϲϓΔϘΑΎγϣ ˯ΎϳϣϳϛϟSérie A -˼ a. La vitesse initiale de la réaction est inférieure t = 2 h b. La vitesse initiale de la réaction est le double de h c. La vitesse initiale de la réaction est égale à h t = 2 h est égale à zéro 8. Pour le système du graphique (n) mole = f (t) suivant qui montre le nombre maximum de
moles de produit formé lorsque la réaction correspondante se termine à t = 30 min, le temps de demi-vie de cette réaction est d'environ: (1.5pt) a. 2 minutes. b. 15 minutes. c. 5 minutes. d. 10 minutes. 9. Dans une ampoule de volume 15L, on introduit 0,6 mole de monoxyde d'azote NO et 0,3 mole
de brome gazeux Br2 à une température t1 = 700 °C. L'équilibre suivant est établi: (1.5pt)
2 NO (g) + Br2 (g)֖
gazeux est de 0,85mol. a. La constante b. La constante c. La constante d. La constante 10. La courbe ci-dessous (Document 1) montre l'évolution du pH en fonction du volume de
solution d'hydroxyde de sodium de concentration Cb versée pour le dosage de 20mL de solution d'acide chlorhydrique 0,1mol.L-1. (1.5pt) ϊΑΎΗϲϓΔϘΑΎγϣ ˯ΎϳϣϳϛϟSérie A -˽ a. Cb = 0,1mol.L-1. b. Cb = 0,2mol.L-1. c. Cb>0,1mol.L-1. d. Cb>0,2mol.L-1. 11. On dissout un acide HA (Ca = 10-3 mol.L-1
pH=3,9. La valeur de la constante (1.5pt) a. 10-1. b. <10-1. c. > 10-1. d. 10-3. 12. On donne : pKa (NH4+/ NH3) = 9,2 ; pKa(CH3COOH/CH3COO- ) = 4,8 (1.5pt)
a. La base NH3 est plus forte que la base CH3COO- b. 4+ 3COOH c. NH4+ et CH3COOH sont deux acides forts d. NH3 et CH3COO- sont deux bases fortes 13. Deux solutions S1 et S2 d'acide de concentration C sont disponibles. Ces solutions sont
ensuite diluées 100 fois. Le pH est mesuré avant et après dilution (Document 1). (1.5pt) C C /100
pH de S1 2 4 pH de S2 3 4,5 Document 1
Document 1
ϊΑΎΗϲϓΔϘΑΎγϣ ˯ΎϳϣϳϛϟSérie A -˾ a. Les deux acides sont forts. b. La concentration C de la solution S1 est 0,01 mol.L-1. c. Les deux acides sont faibles. d. L'acide de la solution S2 est plus fort que l'acide de la solution S1. 14. On donne les formules semi-développées 4H10O suivantes : (1.5pt)
a. (a) et (c) sont des isomères de position. b. (a) et (c) sont des alcools secondaires. c. fonction de (a). d. Le nom ire isomère de (a), (b) et (c) est 2-méthylpropan-2-ol. 15. rendement de cette estérification est : (1.5pt) a. 5% b. 60% c. 67% d. 80% N.B : dans un
- : rendement = 67% - : rendement = 60% - : rendement = 5% Bonne Chance
CH3-CH2-CH2-CH2-OH
(a) CH3-CH-CH2-CH3
OH (b)
CH3-CH-CH2-OH
CH3 (c)
quotesdbs_dbs30.pdfusesText_36
3. Un volume Va dune solution de Ca (mol.L-1) dacide sulfamique est prélevé et dosé avec une
solution de soude NaOH, Les résultats obtenus donnent la courbe ci-dessous : (1pt) ϊΑΎΗϲϓΔϘΑΎγϣ ˯ΎϳϣϳϛϟSérie A -˻ a. Lacide sulfamique est un acide fort car la courbe montre un point dinflexion et pHE = 7. b. Lacide sulfamique est un acide fort car Ca = 10-2 mol.L-1 et pHE = 7. c. Lacide sulfamique est un acide faible car Ca< 10-2 mol.L-1 et pHE> 7. d. E< 7.4. Dans le cas du dosage colorimétrique d'un acide faible par une solution de soude, il est
nécessaire de choisir un indicateur dont la zone de virage est: (1pt) a. Entre 7 et 10. b. Entre 6 et 7. c. Entre 4 et 6. d. Entre 3 et 5.5. é A constitué de C, H et O a donné les
pourcentages en masse suivants: C = 60% and H = 13.3%. Sachant que la masse molaire de A est de 60 g.mol-1, la formule moléculaire de A est : (1pt) a. C4H10O. b. C3H8O. c. C3H6O. d. C4H8O2 Masse molaire atomique en g.mol-1 : C=12, O=16 et H=16. Une dilution est effectuée en utilisant une solution commerciale de peroxyde d'hydrogène S0
de concentration molaire C0 = 7,5 mol.L-1. La solution S0 est diluée 125 fois dans le but depréparer une solution S de volume de 1 L. Les verreries nécessaires pour obtenir cette dilution
sont: (1.5pt) a. Pipette graduée de 10 mL et fiole jaugée de 1000 mL. b. Pipette jaugée de10mL et fiole jaugée de 1L. c. Pipette graduée de 5 mL et fiole jaugée de 1000 mL. d. Eprouvette graduée de 8 mL et fiole jaugée de 1L.7. (1.5pt)
ϊΑΎΗϲϓΔϘΑΎγϣ ˯ΎϳϣϳϛϟSérie A -˼ a. La vitesse initiale de la réaction est inférieure t = 2 h b. La vitesse initiale de la réaction est le double de h c. La vitesse initiale de la réaction est égale à h t = 2 h est égale à zéro8. Pour le système du graphique (n) mole = f (t) suivant qui montre le nombre maximum de
moles de produit formé lorsque la réaction correspondante se termine à t = 30 min, le temps de demi-vie de cette réaction est d'environ: (1.5pt) a. 2 minutes. b. 15 minutes. c. 5 minutes. d. 10 minutes.9. Dans une ampoule de volume 15L, on introduit 0,6 mole de monoxyde d'azote NO et 0,3 mole
de brome gazeux Br2 à une température t1 = 700 °C. L'équilibre suivant est établi: (1.5pt)
2 NO (g) + Br2 (g)֖
gazeux est de 0,85mol. a. La constante b. La constante c. La constante d. La constante10. La courbe ci-dessous (Document 1) montre l'évolution du pH en fonction du volume de
solution d'hydroxyde de sodium de concentration Cb versée pour le dosage de 20mL de solution d'acide chlorhydrique 0,1mol.L-1. (1.5pt) ϊΑΎΗϲϓΔϘΑΎγϣ ˯ΎϳϣϳϛϟSérie A -˽ a. Cb = 0,1mol.L-1. b. Cb = 0,2mol.L-1. c. Cb>0,1mol.L-1. d. Cb>0,2mol.L-1.11. On dissout un acide HA (Ca = 10-3 mol.L-1
pH=3,9. La valeur de la constante (1.5pt) a. 10-1. b. <10-1. c. > 10-1. d. 10-3.12. On donne : pKa (NH4+/ NH3) = 9,2 ; pKa(CH3COOH/CH3COO- ) = 4,8 (1.5pt)
a. La base NH3 est plus forte que la base CH3COO- b. 4+ 3COOH c. NH4+ et CH3COOH sont deux acides forts d. NH3 et CH3COO- sont deux bases fortes13. Deux solutions S1 et S2 d'acide de concentration C sont disponibles. Ces solutions sont
ensuite diluées 100 fois. Le pH est mesuré avant et après dilution (Document 1). (1.5pt)C C /100
pH de S1 2 4 pH de S2 3 4,5Document 1
Document 1
ϊΑΎΗϲϓΔϘΑΎγϣ ˯ΎϳϣϳϛϟSérie A -˾ a. Les deux acides sont forts. b. La concentration C de la solution S1 est 0,01 mol.L-1. c. Les deux acides sont faibles. d. L'acide de la solution S2 est plus fort que l'acide de la solution S1.14. On donne les formules semi-développées 4H10O suivantes : (1.5pt)
a. (a) et (c) sont des isomères de position. b. (a) et (c) sont des alcools secondaires. c. fonction de (a). d. Le nom ire isomère de (a), (b) et (c) est 2-méthylpropan-2-ol. 15. rendement de cette estérification est : (1.5pt) a. 5% b. 60% c. 67% d. 80%N.B : dans un
- : rendement = 67% - : rendement = 60% - : rendement = 5%Bonne Chance
CH3-CH2-CH2-CH2-OH
(a)CH3-CH-CH2-CH3
OH (b)
CH3-CH-CH2-OH
CH3 (c)
quotesdbs_dbs30.pdfusesText_36[PDF] les alcools pdf
[PDF] exercices resolues de cinetique chimique
[PDF] cinétique formelle exercices corrigés
[PDF] chimie des eaux naturelles cours
[PDF] chimie des eaux exercices corrigés
[PDF] calcul balance ionique de leau
[PDF] chimie et environnement cours études de cas et exercices corrigés
[PDF] cours physique chimie 1ere s nouveau programme
[PDF] balance ionique définition
[PDF] de la molécule ? l'odeur
[PDF] molécules odorantes oxygénées
[PDF] molécules odorantes de synthèse
[PDF] palette mélange couleurs
[PDF] tableau melange couleur peinture
