 Polycopié de Cinétique Chimique Cours et Exercices Corrigés
Polycopié de Cinétique Chimique Cours et Exercices Corrigés
Polycopié de Cinétique Chimique. Cours et Exercices Corrigés. Présenté par : Dr. Nouairi Mohammed El-Amine. Ce polycopié est destiné aux étudiants de génie
 Thème : Cinétique chimique Fiche 5 : Vitesse de réaction
Thème : Cinétique chimique Fiche 5 : Vitesse de réaction
CHIMIE. Série S. Nº : 37005. Fiche Corrigés. Thème : Cinétique chimique. Fiche 5 : Vitesse de réaction. ? Exercice n°1.
 Exercices : cinétique macroscopique corrigés
Exercices : cinétique macroscopique corrigés
Conclusion : l'ordre de la réaction est bien 1. Exercice 3 : loi d'Arrhénius. Svante Arrhénius. La constante de vitesse de la réaction. 2 N2O5
 Exercices: CINÉTIQUE CHIMIQUE CORRECTION
Exercices: CINÉTIQUE CHIMIQUE CORRECTION
EXERCICE 10 p.94: TEMPERATURE COMME FACTEUR CINETIQUE Les espèces chimiques responsables de la conductivité de la solution sont toutes les espèces.
 Exercices corrigés de cinétique chimique Série 1 Exercice 1 : A 270
Exercices corrigés de cinétique chimique Série 1 Exercice 1 : A 270
Exercices corrigés de cinétique chimique. Série 1. Exercice 1 : A 270 °C le chlorure de sulfuryle SO2Cl2 noté A se dissocie totalement selon l'équation
 Copie de chi541.xlsx
Copie de chi541.xlsx
3 Exercices résolus de chimie physique. Arnaud Paul 7 Cours et exercices corrigés de chimie générale ... thermodynamique et cinétique chimiques.
 Chimie (problèmes et exercices) Indice 540.76 Nombres de Titres
Chimie (problèmes et exercices) Indice 540.76 Nombres de Titres
cinétique chimique thermodynamique chimique. Kiel
 Fiche dexercices 10 : Cinétique chimique
Fiche dexercices 10 : Cinétique chimique
Physique – Chimie terminale S obligatoire - Année scolaire 2017/2018. Fiche d'exercices 10 : Cinétique chimique. Cinétique chimique. Exercice 1
 Cinétique chimique Cinétique chimique
Cinétique chimique Cinétique chimique
Transformations chimiques 1 – Travaux dirigés. Langevin-Wallon PTSI 2017-2018. Cinétique chimique. Exercices. Exercice 1 : Analyse de courbes.
 [PDF] Thème : Cinétique chimique Fiche 5 : Vitesse de réaction - Studyrama
[PDF] Thème : Cinétique chimique Fiche 5 : Vitesse de réaction - Studyrama
Thème : Cinétique chimique Fiche 5 : Vitesse de réaction ? Exercice n°1 1) On trace la tangente à la date considérée pour les deux courbes et on choisit
 Cinétique chimique : Cours-Résumés-Exercices-Examens - F2School
Cinétique chimique : Cours-Résumés-Exercices-Examens - F2School
Cinétique chimique : Cours-Résumés-Exercices-Examens · La vitesse des réactions : · Vitesse de réaction · Les facteurs déterminants de la vitesse d'une réaction :
 [PDF] Exercices de cinétique chimique - Blablareau Chimie
[PDF] Exercices de cinétique chimique - Blablareau Chimie
Exercices de cinétique chimique Important : les liens vers la correction des cinq premiers exercices sont donnés à la fin de ce document
 [PDF] Exercices : cinétique macroscopique corrigés
[PDF] Exercices : cinétique macroscopique corrigés
Exercice 2 : détermination d'un ordre à l'aide de la méthode différentielle On admet que la réaction de décomposition du pentaoxyde de diazote N2O5
 (PDF) Exercices et Problèmes Résolus de Cinétique Chimique
(PDF) Exercices et Problèmes Résolus de Cinétique Chimique
27 fév 2018 · Ce polycopié d'exercices résolus est destiné aux étudiants du premier cycle universitaire ayant dans leurs programmes un cours de cinétique
 [PDF] cinétique chimique - Chimie - PCSI
[PDF] cinétique chimique - Chimie - PCSI
CINÉTIQUE CHIMIQUE Svante August Arrhenius EXERCICES Chapitre 1 1 LOI DsARRHENIUS L'expérience montre que à la température de ? 150?
 Série dexercices corrigés Cinétique chimique pdf - Web Education
Série dexercices corrigés Cinétique chimique pdf - Web Education
26 déc 2015 · Série d'exercices corrigés Cinétique chimique pdf a- Donner la définition de la vitesse instantanée d'une réaction chimique
 Cinétique et Catalyse Exercices Corrigés PDF - eBoikcom
Cinétique et Catalyse Exercices Corrigés PDF - eBoikcom
Télécharger gratuitement TD QCM exercices et examens corrigés de Cinétique et Catalyse PDF S5 Bachelor / Licence Chimie SMC (3ème année L3)
 [PDF] Fiche dexercices 10 : Cinétique chimique - Plus de bonnes notes
[PDF] Fiche dexercices 10 : Cinétique chimique - Plus de bonnes notes
Physique – Chimie terminale S obligatoire - Année scolaire 2017/2018 Fiche d'exercices 10 : Cinétique chimique Cinétique chimique Exercice 1
 [PDF] Exercices – Cinétique chimique
[PDF] Exercices – Cinétique chimique
Exercices – Cinétique chimique ? Loi d'Arrhénius CC2 Ex-CC2 1 Synth`ese de Williamson (pour apprendre `a se servir de sa calculatrice)
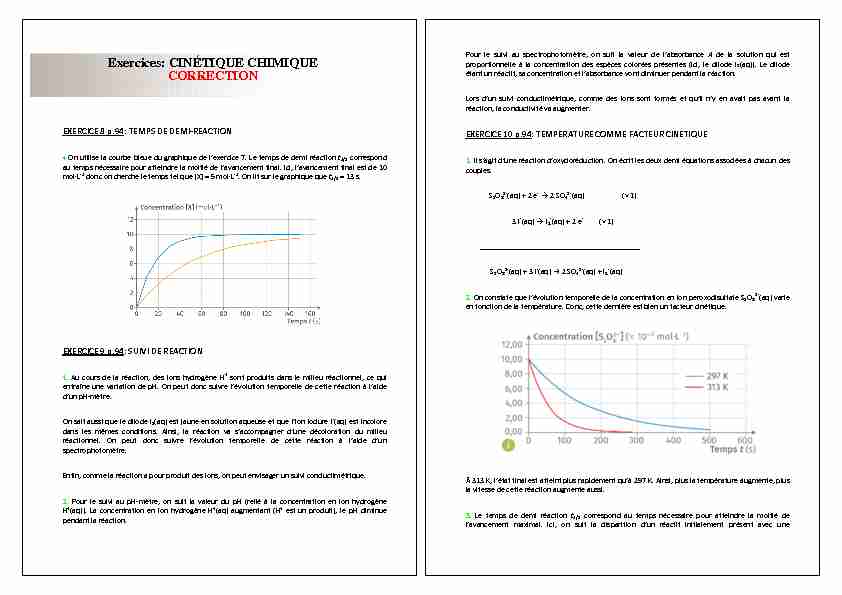
EXERCICE8p.94: TEMPSDEDEMI-REACTION ◆Onutiliselacourbebleuedugraphiquedel'exercice7.Letempsdedemiréactiont1/2correspondautempsnécessairepouratteindrelamoitiédel'avancementfinal.Ici,l'avancementfinalestde10mol·L-1donconchercheletempstelque[X]=5mol·L-1.Onlitsurlegraphiquequet1/2=13s.EXERCICE9p.94:SUIVIDEREACTION1.Aucoursdelaréaction,desionshydrogèneH+sontproduitsdanslemilieuréactionnel,cequientraîneunevariationdepH.Onpeutdoncsuivrel'évolutiontemporelledecetteréactionàl'aided'unpH-mètre.OnsaitaussiquelediiodeI2(aq)estjauneensolutionaqueuseetquel'ioniodureI-(aq)estincoloredanslesmême sconditions .Ainsi,laréaction vas'accompagnerd'unedé colorationdumilie uréactionnel.Onpeutdoncsuivrel' évolution temporelled ecetteréactionàl 'aided'unspectrophotomètre.Enfin,commelaréactionapourproduitdesions,onpeutenvisagerunsuiviconductimétrique.2.PourlesuiviaupH-mètre,onsuitlavaleurdupH(reliéàlaconcentrationenionhydrogèneH+(aq)).LaconcentrationenionhydrogèneH+(aq)augmentant(H+estunproduit),lepHdiminuependantlaréaction.Exercices: CINÉTIQUE CHIMIQUE CORRECTION Pourlesuiviau spectrop hotomètre,onsuitl avaleur del'absorbanceAdelasolu tionq uiestproportionnelleàlaconcentrationdesespècescoloréesprésentes(ici,lediiodeI2(aq)).Lediiodeétantunréactif,saconcentrationetl'absorbancevontdiminuerpendantlaréaction.Lorsd'unsuiviconductimétrique,commedesionssontformésetqu'iln'yenavaitpasavantlaréaction,laconductivitévaaugmenter.EXERCICE10p.94:TEMPERATURECOMMEFACTEURCINETIQUE1.Ils'agitd'uneréactiond'oxydoréduction.Onécritlesdeuxdemiéquationsassociéesàchacundescouples.S2O82-(aq)+2e-!2SO42-(aq)(×1)3I-(aq)!I3-(aq)+2e-(×1)_________________________________________S2O82-(aq)+3I-(aq)→2SO42-(aq)+I3-(aq)2.Onconstatequel'évolutiontemporelledelaconcentrationenionperoxodisulfateS2O82-(aq)varieenfonctiondelatempérature.Donc,cettedernièreestbienunfacteurcinétique.À313K,l'étatfinalestatteintplusrapidementqu'à297K.Ainsi,pluslatempératureaugmente,pluslavitessedecetteréactionaugmenteaussi.3.Letempsd edemiréaction t1/2co rrespondautempsnécessairepouratte indre lamoitiédel'avancementmaximal.Ici,onsuitl adisparitiond'unréacti finitialement présentav ecune
concentrationde10,00×10-2mol·L-1,ettotalementdisparuenfinderéaction.Ilfautdonctrouverletempsauquellaconcentrationestde5,00×10-2mol·L-1.Onlitsurlegraphiquebleuquet1/2=100s.EXERCICE11p.94:ORDREETTEMPERATURE1.Lestroiscou rbesreprésentan tl'évolutiondelavitessevolumiqueenfonctiondelaconcentrationsontdesdroites. Onpeutdoncécrirepour lestroi ssituations:Ainsi,laréactionétudiéeàdifférentestempératuresestbienuneréactiond'ordre1.2.Ondéterminelecoefficientdirecteurdeladroitebleueaveclespointsdecoordonnées(1;11)et(0;0):AN:€
k bleu 11 1,00 =11s -1 k rouge 431,00 =43s -1 k orange 64
1,00 =64s -1
EXERCICE21p.99:DECOMPOSITIONDEL'IODURED'HYDROGENE1.L'énoncénousindiquequelediiodeI2(g)estdecouleurviolette.Ainsi,onpeutsuivrel'évolutiontemporelledesaconcentrationàl' aided'un spectr ophotomètre.Eneffet,enmesurantl'absorbanceaucoursdelaréaction,onpeut,parlaloideBeer-Lambert,obtenirlavaleurdelaconcentrationendiiode[I2]tellequ'elleestdéfiniedansl'énoncé.Ilestànoterqu'ilfautquelediiodesoitlaseuleespècecolorée.2.Parlecture graphique,laconcentr ationfi naleendiiodeI2(g)estégaleà[I2]f=1,00mol·L-1.3.Pourcela,oncommenceparécrirel'équationbilandelaréactiondedécompositiondel'iodured'hydrogène:2HI(g)→I2(g)+H2(g)D´aprèsl´équationdelaréaction:€
n(I 2 f n 0 (HI) 2Onadonc:€
n 0 (HI)=2×n(I 2 fLesdifférentsgazoccupentlemême volum eV,onp eutdonc écrirelamêm erelationavecl esconcentrations:€
[HI] 0 =2×[I 2 fAN:€
[HI] 0 =2×1,00=2,00mol.L -1 [I 2 [I 2 f 2 =5,00×10 -1 mol.L -1Onlitsurlegraphiquequet1/2=0,4s.
[HO-]=σ-(λ(Cl
)+λ(Na ))×c 0λ(HO
)+λ(Cl v= d[HO dt =k×[HO dσ dt (t 1 t 2 t 1 t 2 -t 1EXERCICE27p.101:VITESSEVOLUMIQUEETABSORBANCE1.LaloideBeer-Lambertstipulequ'ilyaproportionnalitéentrel'absorbanceAd'unesolutiondueàuneespè cechimieetlaconcen trationdecetteespèceX( aq).Ce lasetr aduitparlaformule:Siplusieursespèceschimiquesprésentesdanslasolutionsontcolorées,laloideBeer-Lambertestadditiveetonpeutécrire:Onappliquecelaàlasituationdécriteparl'énoncé:.Or,lesionschromeCr3+(aq)initialementintroduitsdanslemilieuréactionnelontsoitréagiavecl'EDTApourformerCr-EDTA3+,soitn'ontpasréagietsonttoujoursprésentssousformeionique.Onpeutdoncécrire:Enremplaçant[Cr-EDTA3+]dansl'équationdel'absorbance,onarriveà:€
A=k 1 [Cr 3+ ]+k 2 (c-[Cr 3+2.Onendéduitque:€
A=(k 1 -k 2 )[Cr 3+ ]+k 2 ×c [Cr 3+ A-k 2 ×c k 1 -k 2 v= d[Cr 3+ dt donc:€ v= d dt A k 1 -k 2 k 2 .c k 1 -k 2 donc:€ v= d dt A k 1 -k 2 d dt k 2 .c k 1 -k 2 v= d dt A k 1 -k 2etenfin:Silaréacti ones tbiend'ordre1,l avitesse volumi quevdedisparitiondesionsCr3+(aq)doitêtre proportionne lleàlaconcentration[Cr3+].Comptetenudecequel'onadit,lavitessevolumiquev,etparconséquentladérivéedel'absorbance,doiventdoncsuivreégal ementunefonctionaffineen fonctiondel'absorbanceA.Àpartirdesmesures,onpeutcalculerladérivéedel'absorbanceAiàchaqueinstanttiLetracédeladérivéedel'absorbanceenfonctiondel'absorbancedonne:Ilapparaî tqueladérivée temporelled el'absorbanceetl'absorbancesontli éespar unmodèleaffine.Onpeut doncvaliderl'ordre 1,d'aprèslesargumentsénoncésprécédemment.
quotesdbs_dbs29.pdfusesText_35[PDF] chimie des eaux naturelles cours
[PDF] chimie des eaux exercices corrigés
[PDF] calcul balance ionique de leau
[PDF] chimie et environnement cours études de cas et exercices corrigés
[PDF] cours physique chimie 1ere s nouveau programme
[PDF] balance ionique définition
[PDF] de la molécule ? l'odeur
[PDF] molécules odorantes oxygénées
[PDF] molécules odorantes de synthèse
[PDF] palette mélange couleurs
[PDF] tableau melange couleur peinture
[PDF] td chimie en solution pdf
[PDF] chimie des solutions : résumés de cours et exercices corrigés pdf
[PDF] exercices corrigés chimie des solutions pdf
