 NOMENCLATURE EN CHIMIE ORGANIQUE 1. Hydrocarbures (HC
NOMENCLATURE EN CHIMIE ORGANIQUE 1. Hydrocarbures (HC
NOMENCLATURE EN CHIMIE ORGANIQUE. La nomenclature permet de : a - Les différents groupes fonctionnels sont classés dans le Tableau 1 selon l'ordre de priorité.
 Chapitre 3: Nomenclature en chimie organique
Chapitre 3: Nomenclature en chimie organique
Chapitre 3: Nomenclature en chimie organique. Avant propos: Ce cours Les groupes présentés dans ce tableau sont rangés dans l'ordre décroissant de priorité.
 Nomenclature organique: Règles I.U.P.A.C.
Nomenclature organique: Règles I.U.P.A.C.
La nomenclature des fonctions ainsi que l'ordre de priorité pour le suffixe (de haut en bas) sont donnés par le tableau suivant: 3nomenclature non
 Chapitre 3 : Nomenclature en chimie organique: Règles I.U.P.A.C.
Chapitre 3 : Nomenclature en chimie organique: Règles I.U.P.A.C.
priorité. Page 10. UNIVERSITÉ MENTOURI 1. INSTITUT DES SCIENCES VÉTÉRINAIRES. DÉPARTEMENT PRÉCLINIQUE. CHIMIE 2022-2023. 10. Fonction. Formule. Si la Fonction n ...
 Partie II : Chimie Organique / Chapitre III
Partie II : Chimie Organique / Chapitre III
I.La nomenclature des hydrocarbures : Les hydrocarbures sont des composés organiques constitués uniquement d'atomes de carbone et d'hydrogène.
 2ATP
2ATP
La nomenclature officielle en chimie organique est la nomenclature IUPAC priorité (Voir tableau page suivante). Sachant que la cétone est prioritaire par ...
 NOMENCLATURE ET ISOMERIE
NOMENCLATURE ET ISOMERIE
En Chimie Organique bien souvent les atomes de Carbone sont au centre d'un tétraèdre
 Stéréochimie
Stéréochimie
On détermine la priorité sur chaque atome de carbone de la liaison double. Lorsque le composé possède une double liaison disubstituée (chaque atome de carbone
 Nomenclature des carbo- et hétérocycles
Nomenclature des carbo- et hétérocycles
➢ priorité des radicaux → fonction de la taille (nombre de C de chaque radical) entité la plus petite substituant de la plus grande. CH2. CH2. CH2. CH3. 1
 Nomenclature organique: Règles I.U.P.A.C.
Nomenclature organique: Règles I.U.P.A.C.
La nomenclature des fonctions ainsi que l'ordre de priorité pour le suffixe (de haut en bas) sont donnés par le tableau suivant: 2nomenclature non
 NOMENCLATURE EN CHIMIE ORGANIQUE 1. Hydrocarbures (HC
NOMENCLATURE EN CHIMIE ORGANIQUE 1. Hydrocarbures (HC
Les groupes présentés dans ce tableau sont rangés dans l'ordre décroissant de priorité. Classe. Formule*. Préfixe : groupe secondaire. Suffixe : groupe.
 NOMENCLATURE EN CHIMIE ORGANIQUE 1. Hydrocarbures (HC
NOMENCLATURE EN CHIMIE ORGANIQUE 1. Hydrocarbures (HC
Les groupes présentés dans ce tableau sont rangés dans l'ordre décroissant de priorité. Classe. Formule*. Préfixe : groupe secondaire. Suffixe : groupe.
 Nomenclature organique: Règles I.U.P.A.C.
Nomenclature organique: Règles I.U.P.A.C.
Nomenclature organique: Règles I.U.P.A.C. ainsi que l'ordre de priorité pour le suffixe (de haut en bas) sont donnés par le tableau suivant:.
 LES COMPOSÉS FONCTIONNELS 1- Définitions 1-1- Fonction
LES COMPOSÉS FONCTIONNELS 1- Définitions 1-1- Fonction
Les Cahiers de Chimie Organique pour les Étudiants en Licences fondamentales ou Le classement des groupements fonctionnels par ordre de priorité ...
 COURS DE CHIMIE ORGANIQUE Semestre 2 SVI
COURS DE CHIMIE ORGANIQUE Semestre 2 SVI
II/ NATURE ELECTRONIQUE DES LIAISONS EN CHIMIE ORGANIQUE Tableau 2 : Nomenclature des fonctions classées par ordre de priorité. PREFIXE. FONCTION.
 Chapitre 3: Nomenclature en chimie organique
Chapitre 3: Nomenclature en chimie organique
CHIMIE GÉNÉRALE 2019-2020. 1. Chapitre 3: Nomenclature en chimie organique présentés dans ce tableau sont rangés dans l'ordre décroissant de priorité.
 2ATP
2ATP
La nomenclature officielle en chimie organique est la nomenclature IUPAC (Union internationale de chimie pure et appliquée). C'est ainsi qu'entre en vigueur
 20 Chapitre 2 : Nomenclature des composés organiques méthanol
20 Chapitre 2 : Nomenclature des composés organiques méthanol
Entre le ou les substituants et la triple liaison c'est cette dernière qui a la priorité pour l'affectation du plus petit indice de position. Pour l'exemple.
 Chimie Organique
Chimie Organique
Leur nomenclature est très simple il suffit de remplacer le mot acide par anhydride et de conserver le reste de la nomenclature de l'acide de base. Page 14
 2ATP
2ATP
et Prélog afin de déterminer l'ordre de priorité et le sens de rotation QCM 5 : Déterminez la (les) nomenclature(s) exacte(s) de la molécule suivante :.
 [PDF] Nomenclature en chimie organique - UniNE
[PDF] Nomenclature en chimie organique - UniNE
- Les différents groupes fonctionnels sont classés dans le Tableau 1 selon l'ordre de priorité - On choisit comme groupe principal celui qui se trouve le plus
 [PDF] Chapitre 3: Nomenclature en chimie organique
[PDF] Chapitre 3: Nomenclature en chimie organique
Les groupes présentés dans ce tableau sont rangés dans l'ordre décroissant de priorité Fonction Formule Si la Fonction n'est pas Prioritaire (préfixe) Si
 [PDF] Nomenclature organique: Règles IUPAC
[PDF] Nomenclature organique: Règles IUPAC
Nomenclature organique: Règles I U P A C (remplace 5 2 5 3 et 6 ) 1 ) Représentation des molécules Le modèle à calottes est la représentation la plus
 [PDF] Chapitre 2 REGLES DE NOMENCLATURE EN CHIMIE ORGANIQUE
[PDF] Chapitre 2 REGLES DE NOMENCLATURE EN CHIMIE ORGANIQUE
Le choix est défini par la priorité de la fonction De même le choix de la chaîne principale est lié à la position de la fonction prioritaire La numérotation
 [PDF] NOMENCLATURE ET ISOMERIE - Faculté des Sciences de Rabat
[PDF] NOMENCLATURE ET ISOMERIE - Faculté des Sciences de Rabat
Support de Cours de Chimie Organique NOMENCLATURE ET ISOMERIE Filières : SMC et SMP Pr K Bougrin Année 2003/2004 Université Mohammed V-Agdal
 [PDF] COURS DE CHIMIE ORGANIQUE Semestre 2 SVI
[PDF] COURS DE CHIMIE ORGANIQUE Semestre 2 SVI
Tableau 2 : Nomenclature des fonctions classées par ordre de priorité PREFIXE FONCTION FORMULE SUFFIXE ACIDE CARBOXYLIQUE ESTER HALOGENURE d'ACIDE
 [PDF] [PDF] Nomenclature en chimie organique
[PDF] [PDF] Nomenclature en chimie organique
26 jan 2016 · La nomenclature est un ensemble de règles permettant de nommer de façon univoque un composé donné en précisant l'enchaînement de ses atomes de
 [PDF] Nomenclature des molécules organiques - Chimie PCSI
[PDF] Nomenclature des molécules organiques - Chimie PCSI
Le tableau suivant donne les différentes fonctions par ordre de priorité décroissante Groupe caractéristique Structure générale Suffixe Préfixe acide
 [PDF] Chimie Organique - univ-ustodz
[PDF] Chimie Organique - univ-ustodz
Leur nomenclature est très simple il suffit de remplacer le mot acide par anhydride et de conserver le reste de la nomenclature de l'acide de base Page 14
Comment savoir si une fonction est prioritaire ?
- La fonction prioritaire est désignée par un suffixe et on numérote la chaîne principale de façon à attribuer à cette fonction l'indice le plus petit possible. - Les autres fonctions sont désignées par des préfixes.Qui est prioritaire double ou triple liaison ?
S'il n'y a pas de liaisons multiples, on passe à la règle 3. elle comprend le maximum d'atomes de carbone. En cas de compétition, une liaison double l'emporte sur une triple.Quelles sont les règles de nomenclature d'une molécule organique ?
Le nom d'une molécule organique (essentiellement constituée d'atomes de carbone et d'hydrogène) dépend du nombre d'atomes de carbone de la chaîne linéaire principale, du ou des groupes caractéristiques présents dans la structure ainsi que des éventuelles ramifications.- Nommer la molécule
On détermine le nom de la molécule avec : La position sur le squelette et le nom de la ramification. En préfixe, le nom de l'alcane correspondant au nombre de carbones du squelette. En suffixe, la terminaison identifiant la famille chimique.
![[PDF] COURS DE CHIMIE ORGANIQUE Semestre 2 SVI [PDF] COURS DE CHIMIE ORGANIQUE Semestre 2 SVI](https://pdfprof.com/Listes/17/30340-17site-164-6e824e122565f6edd512da59c9167777-332650830.pdf.pdf.jpg)
UNIVERSITE CADI AYYAD
Faculté Polydisciplinaire
SafiDépartement de Chimie
COURS DE CHIMIE ORGANIQUE
Semestre 2
SVIPréparé par :
Moulay Rachid LAAMARI
2016-2017
SOMMAIRE
Chapitre I : INTRODUCTION A LA CHIMIE ORGANIQUE
I/ COMPOSES ORGANIQUES
II/ NATURE ELECTRONIQUE DES LIAISONS EN CHIMIE ORGANIQUEII-1- Orbitales atomiques (OA)
II-2- Valence du carbone
II-3- Hybridation du carbone
II-4- Liaisons covalentes
II-5- Comparaison entre sp3, sp2 et sp du carbone
II-6-Chapitre II : ECRITURE DES FORMULES ET FONCTIONS
EN CHIMIE ORGANIQUE
I/ ECRITURE DES FORMULES
I-1- Formule brute
I-2- Formule développée plane (FDP)
I-3- Formule semi-développée (FSD)
I-4- Formule simplifiée (FS)
II/ DIVERSES FONCTIONS ET GROUPEMENT FONCTIONNELS
II-1-II-2- Principales fonctions organiques
II-2-4- Fonctions tétravalentes
Chapitre III : PRINCIPALES REGLES DE NOMENCLATURE
DES COMPOSES ORGANIQUES
I/ NOMENCLATURE DES ALCANES ACYCLIQUES
I-1- Alcanes à chaîne linéaire
I-2- Alcanes à chaîne ramifiée
II/ NOMENCLATURE DES HYDROCARBURES ACYCLIQUES INSATURESII-1- Les alcènes : CnH2n
II-2- les alcynes : CnH2n-2
III/ NOMENCLATURE DES DERIVES HALOGENES (R-X)
IV/ NOMENCLATURE DES COMPOSES CYCLIQUES
IV-1- Les homocycles
IV-2- Les cycles aromatiques
IV-3- Les hétérocycles
V/ NOMENCLATURE DES FONCTIONS SIMPLES ET MULTIPLESV-1- Les alcools : R-OH
V-2- Les éthers (oxydes) : R-O-
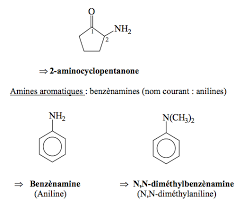
V-3- Les amines
V-4- Les cétones : R-COR' avec R et R'
HV-5- Les aldéhydes : R-CHO
V-6- Acides carboxyliques : R-COOH
V-7- Dérivées des acides carboxyliques
VI/ NOMENCLATURE DES COMPOSES A PLUSIEURS FONCTIONSChapitre IV : ISOMERIE PLANE
I/ ISOMERIE DE CONSTITUTION
I-1-I-2- Isomérie de position
I-3- Isomérie de fonction
II/ ISOMERIE TAUTOMERIE
II-1-Tautomérie des aldéhydes et des cétonesII-2-Tautomérie des amides
II-3-Tautomérie des imines
Chapitre V : STEREOCHIMIE ISOMERIE CONFORMATIONNELLEI/ REPRESENTATION DES MOLECULES ACYCLIQUES
I-1- Molécule contenant un carbone sp3
I-2- Molécule contenant deux carbones sp3
I-3- Analyse conformationnelle des chaînes saturées aliphatiques II/ REPRESENTATON DES MOLECULES CYCLIQUES SATUREESII-1- Cyclopropane
II-2- Cyclobutane
II-3- cyclopentane
II-4- Cyclohexane
Chapitre VI : ISOMERIE OPTIQUE
I/ CHIRALITE
II/ MOLECULES CONTENANT UN SEUL CARBONE ASYMETRIQUEIII/ CONFIGURATIONS ABSOLUES R ET S
III-1- Règles de Cahn-Ingold et Prelog
III-2- Examen de la molécule
III-3- Projection de Fischer
IV/ Composés CONTENANT deux carbones asymétriques IV-1- Molécules possédant deux *C différents IV-2- Molécules possédant deux *C identiques CHAPITRE VII : ISOMERIE GEOMETRIQUE CISTRANS OU Z-EI/ ISOMERIE GEOMETRIQUE POUR LES ALCENES
I-1- ISOMERIE CIS-TRANS
I-2- ISOMERIE Z-E
II/ ISOMERIE GEOMETRIQUE CIS-TRANS POUR LES CYCLOALCANESII-1-DIMETHYLCYCLOBUTANE
II-2- DIMETHYLCYCLOHEXANE
CHAPITRE VIII : EFFETS ELECTRONIQUES
I/ EFFET INDUCTIF
I-1- E-I)
I-2-I-3- CONSEQUENCES DES EFFETS INDUCTIFS
II/ CONJUGAISON ET AROMATICITE
II-1- CONJUGAISON
II-2- AROMATICITE
III/ EFET MESOMERE
III-1- EFFET MESOMERE ATTRACTEUR (-M)
III-2- EFFET MESOMERE DONNEUR (+M)
Chapitre I : INTRODUCTION A LA CHIMIE ORGANIQUE
I/ COMPOSES ORGANIQUES
Les composés organiques sont des composés qui contiennent essentiellement du carbone sauf le monoxyde de carbone (CO), le dioxyde de carbone (CO2), les carbonates (K2CO3, Na2CO3, NaHCO3), les cyanures (KCN, NaCN), le dissulfure (CS2) et les carbures (CaC2) qui sont des composés inorganiques. Les composés organiques sont formés de liaisons covalentes. Ils sont rarement soluble dans l'eau et se décomposent facilement par la chaleur.Leurs densités sont voisines de l'unité.
II/ NATURE ELECTRONIQUE DES LIAISONS EN CHIMIE ORGANIQUE Pour décrire la nature des liaisons C-C et/ou C-H, on utilise la notion dépendent des nombres quantiques n, l et m (voir cours de chimie généraleI S1).
n : nombre quantique principale n>0, il détermine la distance moyenne entre l : 0< l < n, nombre quantique secondaire ou azimutal, il définit la sous couche, l = 0 orbitale s l = 1 orbitale p, etc. m : -l < m < l, nombre quantique magnétique, il définit la case quantique, à un niveau l correspond (2l + 1) valeurs (cases) de m.II-1- Orbitales atomiques (OA)
y a une grande proba organique sont s et p.II-1-1-
de la classification périodique des éléments. Il a sa couche externe à moitié remplie. Pour compléter sa couche périphérique, il pourra se lier à lui mêmeH He
Li Be B 6C N O F Ne
Na Mg Al Si P S Cl Ar
Le numéro atomique du carbone est 6 par conséquent sa structureélectroniques est 1s22s22p2.
II-1-2- Formes des OA du carbone
O. s y z x -1, 0, 1) correspond à 3 orbitales px, py et pz. Ces dernières ont chacune deux lobes et leurs axes de symétrie respectifs Ox, Oy et Oz sont perpendiculaires entre eux.Remarque: Le noyau se tr
II-2- Valence du carbone
r avec La configuration électronique externe du carbone à l'état fondamental est 2s22p2.2p22s2
Cette valence (VC = 2) permet la formation des molécules instables car la couche périphérique du carbone est incomplète (6e-, il faut 8e-).Exemple : CCl2
Octet (8e- sur la couche externe), le carbone
doit faire 4 liaisons donc il doit avoir 4 électrons célibataires sur sa couche externe (VC = 4). Pour cela, le carbone doit être dans un état excité c-à-d un électron de la sous couche 2s passe à la sous couche 2p.2p22s22p32s1
Excitation
Etat fondamentalEtat excité
Exemple : CH4 (8e- autour du carbone donc sa couche périphérique est saturée).Cette hypothèse tétravalence du
carbone (VC = 4) mais non pas sa géométrie qui se traduit parII-3- Hybridation du carbone
Une combinaison linéaire des OA conduit aux orbitales dites orbitales hydrides (OH) spatialement et énergétiquement équivalentes entre elles.2px 2py 2pz2s1
Etat excité
Par des différentes combinaisons linéaires des OA du carbone, on peut avoir3, sp2 et sp.
II-3-1- Hybridation sp3
re que les quatre liaisons C-H du méthane (CH4) sont identiques et indiscernables. Chacune forme avec les trois autres le même 2py et 2pz) du carbone subissent une combinaison linéaire pour donner 4 orbitales hybrides (OH). Cette combinaison met en jeu une orbitale s et 3 orbitales p pour conduire à quatre orbitales hybrides sp3 équivalentes.1 s+3 p4 sp3(4 OH)
px y z x pypz109°28'
sp3sp3 sp3 sp3 s Le carbone hybridé sp3 possède une géométrie tétraédrique.Remarque
II-3-2- Hybridation sp2
La combinaison linéaire met en jeu une orbitale s et deux orbitales p pour conduire à trois orbitales hybrides sp2 équivalentes dont leurs axes de inchangée et son axe de symétrie est perpendiculaire au plan des axes des orbitales hybrides sp2.1 s+2 p3 sp2(3 OH)
z pz120°
sp2 sp2 sp2 Le carbone hybridé sp2 possède une géométrie triangulaire.II-3-3- Hybridation sp
Elle met en jeu une orbitale s et une orbitale p pour conduire à deux orbitales hybrides sp dont les axes forment un angle de 180° et sont confondus. Les deux autres orbitales atomiques p (py et pz) restent naturelles et sont perpendiculaires aux deux orbitales hybrides sp.1 s+1 p2 sp(2 OH)
py pz spsp Le carbone hybridé sp possède une géométrie linéaire.II-4- Liaisons covalentes
Le carbone, situé sur la colonne centrale de la classification périodique, peut se lier à peut se lier à lui même, aux éléments de la mê des liaisons covalentes et . Une liaison covalente vient du recouvrement axial de deux orbitales hybrides (sp, sp2, sp3) dans le cas de la liaison C- et une orbitale s dans le cas de la liaison C-H. Une liaison covalente vient du recouvrement latéralII-4-1- Recouvrement axial
par rapport à ce même axe. Il aboutit à la formation de liaison covalente .Exemple 1 : méthane CH4 (4)
sp3sp3 sp3 sp3 s Csp3H HH H109°28'
La géométrie de CH4est tétraédrique
C H H H H +4H Conclusion : Un atome de carbone entouré de 4 liaisons est hybridé en sp3.Exemple 2 : éthane CH3-CH3
Chaque carbone est entouré de 3 liaisons (C-H) et une liaison (C-C). HH HH HHRecouvrement axial
Csp3Csp3
6H Le recouvrement axial C-C ié par rotation de la molécule autour de la liaison C-C; il y a la libre rotation autour de la liaisonII-4-2- Recouvrement latéral
Exemple 1 : éthylène CH2=CH2
pz' sp2sp2 sp2 pz sp2 sp2 sp2Recouvrement axial
Recouvrement latéral
H H H H 4H pour former une orbitale moléculaire (OM) correspondant à une liaison de type lèles. la liaison bloque la rotation autour de la liaison C-C. Conclusion : Un carbone hybridé sp2 est entouré de 3 liaisons et une liaison . Le carbone sp2 se trouve dans les molécules insaturés (doubles liaisons :C=O, C=S, C=N, C=C).
Exemple 2 : acétylène HCCH
conduire respectivement à deux liaisons perpendiculaires entre elles. Les trois liaisons Conclusion Un carbone hybridé sp est entouré de 2 et 2 . Il se trouve dans les molécules avec triple liaison et des molécules du genre C=C=C, C=C=O,C=C=N-, C=C=S.
II-5- Comparaison entre sp3, sp2 et sp du carbone
L'orbitale hybride sp3 est constituée de 25% de caractère s et de 75% de caractère p. Lorsque le caractère s de l'OH augmente on constate : - Aspect énergétiqueOA ns est plus faible que
- Aspect géométrique180°.
II-6-Le tableau ci-dessous rassemble les différe
sp3 sp2 spC 4 3 + 1 2 + 2
N 3 + 1 doublet libre 2 + 1 + 1 doublet libre 1 + 2 + 1 doublet libreO 2 + 2 doublets
libres1 + 1 + 2 doublets
libresChapitre II : ECRITURE DES FORMULES ET FONCTIONS
EN CHIMIE ORGANIQUE
Pour écrire une molécule organique, il faut respecter la valence des atomes qui constitue cette molécule. VC = 4, VN = 3, VO = 2, VH = V(F, Cl, Br, I) = 1.I/ ECRITURE DES FORMULES
En c - Formule brute, - Formule développée plane, - Formule semi-développée, - Formule simplifiée.I-1- Formule brute
que contient la molécule, elle est de la forme CxHyOzNtXw avec X = Cl, Br, I, F.Exemple :
- CH4N2O, elle contient (1C, 4H, 2N, 1O). - C3H6O, elle contient 3C, 6H et 1O. ne indication sur la façon dont les atomes sont disposés entre eux. En fait, il rapport aux autres.I-2- Formule développée plane (FDP)
Tous les atomes et toutes les liaisons sont représentés sur la surface plane d'une feuille. HCC H C H Cl H H H Cl HCN H C H H H H HHCO H H H ces atomes dans une molécule, mais non pas leur orientation réelle dansI-3- Formule semi-développée (FSD)
Dans cette écriture, on élimine les liaisons C-H, N-H et O-H.Exemples: CH3-CH3, CH3CH2-CH2-NH2, CH3-CH2-OH
Si en plus, on élimine les liaisons C-C, C-N, C- deviennent des formules compactes. Exemples: CH3CH2CH2CH3, CH3CH2OH, CH3NHOHI-4- Formule simplifiée (FS)
Du point de vue pratique et de simplification des écritures, on utilise pour les chaînes carbonées et les cycles des formules simplifiées. Dans ces formules, on ne garde que le squelette carboné sans nt porter. Par contre, on représente les hétéroatomes (N, O, S), les hydrogènes liés aux hétéroatomes et les halogènes (Cl, Br, I, F). Chaque extrémité et intersection du squelette correspondent à un carbone. Dans ces représentations, on respecte les angles de valence.CH3CH2CHCH2CH2C
O OHOH OCH2CHCHCHCH2C
NH2 CH ClCl NH2 H2CH2CCH2
CH2 CH2quotesdbs_dbs29.pdfusesText_35[PDF] qcm chimie organique pdf
[PDF] qcm paces ue1
[PDF] atomistique cours et exercices corrigés pdf
[PDF] les alcools exercices corrigés pdf
[PDF] cours de chimie organique generale pdf
[PDF] chimie organique terminale s exercice
[PDF] chimie terminale d pdf
[PDF] fiche chimie terminale s
[PDF] tout en un physique psi pdf
[PDF] fiche chimie organique pcsi
[PDF] cours de chimie pcsi
[PDF] exercices corrigés sur la structure de l atome pdf
[PDF] atkins physical chemistry 9th edition pdf
[PDF] technico science secondaire 4
