 Atomistique et Chimie Organique Cours et Exercices Corrigés
Atomistique et Chimie Organique Cours et Exercices Corrigés
Atomistique et Chimie Organique. Cours et Exercices Corrigés. (Chimie 1 en Génie Industriel). Page 2. République Algérienne Démocratique et Populaire. Ministère
 SUPPORT PAPIER DU COURS NECESSAIRE TRES UTILE
SUPPORT PAPIER DU COURS NECESSAIRE TRES UTILE
Queyrel Atomistique et Structures
 EXERCICES-ATOMISTIQUE.pdf
EXERCICES-ATOMISTIQUE.pdf
La disparition de la matière est compensée par une libération d'énergie au cours de la formation du noyau. 8 l. LAASRI. Série 1 : QCM - Tester yotre
 Atomistique Corrigé
Atomistique Corrigé
Feb 20 2019 PREMIER EXERCICE. L'ANTIMOINE Sb. Le numéro atomique de l'antimoine est ... cours de remplissage) : Sb possède 5 électrons de valence : 5s2 5p3 ...
 LES FONDAMENTAUX
LES FONDAMENTAUX
Le nombre de ces exercices tous intégralement corrigés
 CHIMIE GENERALE-d
CHIMIE GENERALE-d
Chimie ( Cours et exercices corrigés) ch gle 15/1-2. 168. 169. 16. Chimie 1 ( 1ère année PCST. ) ch gle 16/1-2. 993. 994. 17. Toute la chimie en 151 exercices
 Untitled
Untitled
Exercices corrigés d'atomistique et liaison chimique pdf. Atomistique cours et exercices corrigés pdf. Atomistique et liaison chimique exercices corrigés pdf.
 COURS Atomistique 1er Semestre
COURS Atomistique 1er Semestre
http://www.wontu.fr/COURS/RADIOACTIVITE.pdf · http://lpsc.in2p3.fr/schien Dunod. - Cours et Exercices Corrigés Paul Arnaud Ed. Dunod. - Chimie Générale ...
 COURS DE CHIMIE-PCSI/MPSI/TSI- elfilalisaid@yahoo.fr Page -2
COURS DE CHIMIE-PCSI/MPSI/TSI- elfilalisaid@yahoo.fr Page -2
H. ◮ Le numéro atomique Z représente le nombre de protons et N le nombre de neutrons. ◮ On appelle nombre de masse A la somme des nucleons (A = Z + N).
 COURS DE CHIMIE ATOMISTIQUE
COURS DE CHIMIE ATOMISTIQUE
∆E (MeV) = ∆m (uma) 931. Page 10. Cours Atomistique. DR G. Merabet. 10. Exercice 4 : Calculer pour le noyau 24 Mg : sa masse en Kg son volume en m3 et sa
 Atomistique et Chimie Organique Cours et Exercices Corrigés
Atomistique et Chimie Organique Cours et Exercices Corrigés
Remarque : Chaque orbitale atomique est donc caractérisée par une combinaison des trois nombres quantiques n l et m. Page 14. Chapitre I: Atomistique. Chimie 1
 X A Rb Rb
X A Rb Rb
Cours Darwin. Exercices Corrigés. Corrigé de Série n°1 : Exercices d'atomistique. Données à utiliser en cas de besoin : Intitulé. Symbole. Valeur en M.K.S.A.
 COURS Atomistique 1er Semestre
COURS Atomistique 1er Semestre
http://lpsc.in2p3.fr/schien/PHY113a/Cours%20radioactivite%202009-2010.pdf Cours et Exercices Corrigés Paul Arnaud Ed. Dunod.
 SUPPORT PAPIER DU COURS NECESSAIRE TRES UTILE
SUPPORT PAPIER DU COURS NECESSAIRE TRES UTILE
Cours de Chimie Dunod
 TOUT LE COURS EN FICHES
TOUT LE COURS EN FICHES
Chapitre 2 Atomistique pour s'auto-évaluer exercices d'application corrigés
 Rappels atomistiques structure des métaux
Rappels atomistiques structure des métaux
http://campus.cerimes.fr/odontologie/enseignement/chap1/site/html/cours.pdf
 COURS DE CHIMIE ATOMISTIQUE
COURS DE CHIMIE ATOMISTIQUE
Cours Atomistique. DR G. Merabet Exercice n°1: Donner les mélanges et les corps purs des éléments suivants : le fer H2
 COURS DE CHIMIE Avec EXERCICES
COURS DE CHIMIE Avec EXERCICES
chapitre aux questions des exercices d'auto-évaluation. Il faut rappeler que cet ouvrage Chimie Organique « Cours & Exercices corrigés » Melania Kiel.
 Chimie (problèmes et exercices) Indice 540.76 Nombres de Titres
Chimie (problèmes et exercices) Indice 540.76 Nombres de Titres
Omar Bouh Abdillahi 541.2/78. 10. 2. 2729869743. Chimie générale .Tome1
 Cours de Chimie Structure de la matière
Cours de Chimie Structure de la matière
Les bases théoriques sont présentées de manière logique et progressive au fil des chapitres avec des exercices corrigés dans chaque chapitre. Le premier
 Atomistique - Cours-Résumés-Exercices et Examens corrigés
Atomistique - Cours-Résumés-Exercices et Examens corrigés
Atomistique: cours Résumés Exercices et examens corrigés I- Généralités sur l'atome L'atome est l'élément fondamental de la matière à cause de sa
 [PDF] Atomistique et Chimie Organique Cours et Exercices Corrigés
[PDF] Atomistique et Chimie Organique Cours et Exercices Corrigés
Dr ZENASNI Mohamed Amine Dr MEROUFEL Bahia 2019/2020 Atomistique et Chimie Organique Cours et Exercices Corrigés (Chimie 1 en Génie Industriel)
 TD et Exercices corrigés Atomistique Smpc 1 PDF - EPrePare
TD et Exercices corrigés Atomistique Smpc 1 PDF - EPrePare
21 jui 2018 · TD et Exercices: PDF 1:TD et Exercices avec Corrigés Atomistique SMP1-SMC1 S1 Cours Atomistique filière SMPC S1 PDF · Examens Corrigés
 Atomistique cours et exercices corrigés PDF - GooDPrepA
Atomistique cours et exercices corrigés PDF - GooDPrepA
Télécharger 6 Fichier PDF qui contient des Traveaux pratiques et des Exercices corrigés de la Atomistique Et n'oubliez pas de partager cette article et
 Examens Exercices Corrigés Atomistique PDF L1 Gratuit - eBoikcom
Examens Exercices Corrigés Atomistique PDF L1 Gratuit - eBoikcom
Télécharger gratuitement TD QCM exercices et examens corrigés de Atomistique PDF S1 Bachelor / Licence Chimie SMPC SMIA (1ère année L1) Pour les cours
 [PDF] Atomistique Corrigé - Chimie en PCSI
[PDF] Atomistique Corrigé - Chimie en PCSI
20 fév 2019 · mol-1 Donner le symbole de l'isotope le plus abondant et préciser la composition de son noyau Cette masse molaire est
 Licence 1 Atomistique Cours et Exercices Corrigés PDF
Licence 1 Atomistique Cours et Exercices Corrigés PDF
Atomistique et Chimie Organique Cours et Exercices Corrigés PDF: Ce document de la Faculté de Technologie de Tlemcen est destiné aux étudiants de Chimie
 Exercices corrigés de Atomistique ( Excellent ) smpc s1 pdf
Exercices corrigés de Atomistique ( Excellent ) smpc s1 pdf
Atomistique exercice corrigé smpc S1 sciences de la matière physique et chimie Semestre 1 Science travaux dirigés exercice corrigé
 Examens Corrigés Atomistique - exomaroc
Examens Corrigés Atomistique - exomaroc
À première vue la théorie de la liaison chimique semble un bel exercice consacré à cette construction Examens Corrigés N°1 Atomistique PDF cliquez ici
 TD Et Séries Atomistique SMPC S1 + Corrigés - Pdf-Cours
TD Et Séries Atomistique SMPC S1 + Corrigés - Pdf-Cours
5 nov 2019 · TD 10 (Plusieurs Exercices Atomistique Avec Les Corrections - SMPC S1) ===> Cliquer ici TD 7 (TD Atomistique 2011 avec corrigées
Université AbouBakr Belkaid t Tlemcen t
Faculté de Technologie,
Département de Génie Electrique et ElectroniqueFilière Génie Industriel Productique
Présenté par
Dr. ZENASNI Mohamed Amine
Dr. MEROUFEL Bahia
2019/2020
Atomistique et Chimie Organique
Cours et Exercices Corrigés
(Chimie 1 en Génie Industriel) République Algérienne Démocratique et PopulaireUniversité AbouBakr Belkaid ± Tlemcen
Faculté de Technologie
Département de GEE
Filière Génie Industriel Productique
Table des Matières
SURSRV"""""""""""""""""""""""""""""
$WRPLVWLTXH""""""""""""""""""""""""" $WRPH""""""""""""""""""""""""""""""" ,QWURGXFWLRQ""""""""""""""""""""""""""""1R\DX""""""""""""""""""""""""""""""
(OHFWURQ"""""""""""""""""""""""""""""5HSUpVHQWDWLRQ""""""""""""""""""""""""""
,VRWRSHV""""""""""""""""""""""""""""" 'HVFULSWLRQFDVGHOHGH%RKU"""""""""""""""""
$EVRUSWLRQHWpPLVVLRQG pQHUJLH"""""""""""""""""""HFKORZVNL""""""""""""""""""""""""
3ULQFLSHG
H[OXVLRQGH3DXOL""""""""""""""""""""""
5qJOHGH+XQG"""""""""""""""""""""""""""
H/(:,6"""""""""""""""""""""""""
5qJOHGHO
RFWHW"""""""""""""""""""""""""""
,QWURGXFWLRQ""""""""""""""""""""""""""""FRPSRVpV""""""""""""
1RPEUHDWRPLTXH"""""""""""""""""""""""""
9DOHQFH""""""""""""""""""""""""""""
0pWDX["""""""""""""""""""""""""""""
$OFDOLQV"""""""""""""""""""""""""""""WHUUHX[""""""""""""""""""""""""""
7HUUHX["""""""""""""""""""""""""""""
$]RWLGHV"""""""""""""""""""""""""""""6XOIXULGHV""""""""""""""""""""""""""""
+DORJHQV"""""""""""""""""""""""""""" *D]UDUHVRXLQHUWHV"""""""""""""""""""""""3pULRGHV"""""""""""""""""""""""""""""
GDWLYH""""""""""""""""""""""
/LDLVRQLRQLTXH"""""""""""""""""""""""""" 'pILQLWLRQ""""""""""""""""""""""""""""0RPHQWVGHOLDLVRQ""""""""""""""""""""""""
RUJDQLTXHV"""""""""""""""""""""
6XSSRVLWLRQ""""""""""""""""""""""""""""
1RWDWLRQV"""""""""""""""""""""""""""""
0pWKRGH$;("""""""""""""""""""""""""""
+\EULGDWLRQVS"""""""""""""""""""""""""""0pVRPpULH"""""""""""""""""""""""""""""
(IIHWLQGXFWLI"""""""""""""""""""""""""" (IIHWPpVRPqUH""""""""""""""""""""""""""DYHFFRUUHFWLRQV"""""""""""""""""""""""
)RUPXOHEUXWH""""""""""""""""""""""""""" pYHORSSpH""""""""""""""""""""""""GpYHORSSpH""""""""""""""""""""""
1RPHQFODWXUH""""""""""""""""""""""""""""
,QWURGXFWLRQ"""""""""""""""""""""""""""" $OFDQHV""""""""""""""""""""""""""""" &\FORDOFDQHV""""""""""""""""""""""""""" Dénomination : alcanol, Symbole ROH"""""""""""" dénomination : alkoxyalcane, Symbole ROR'""""""""""" $QK\GULGHV""""""""""""""""""""""""""" (VWHUV""""""""""""""""""""""""""""" $PLGHV"""""""""""""""""""""""""""" $OFDQHQLWULOHV"""""""""""""""""""""""""" $PLQHV"""""""""""""""""""""""""""" +pWpURF\FOHV""""""""""""""""""""""""""QRQFRXUDQWV"""""""
6WpUpRFKLPLH""""""""""""""""""""""""
,VRPpULH"""""""""""""""""""""""""""""" )LVFKHU"""""""""""""""""""""""" 'pILQLWLRQ"""""""""""""""""""""""""""" &KLUDOLWp""""""""""""""""""""""""""""" RSGXQFHQWUHFKLUDO&RQILJXUDWLRQ$EVROXH"""""
D&RQILJXUDWLRQUHODWLYHDXWRXUG
XQHGRXEOHOLDLVRQ""""""""""""""
5pIpUHQFHV""""""""""""""""""""""""""""""
Avant-Propos Chimie 1 en Génie Industriel
Cours et travaux dirigés Atomistique et chimie organique Page 1Avant-Propos
Ce polycopié a été élaboré pour les étudiants de la première année Génie Industriel.
module de chimie du 1er semestre nommé Chimie 1, qui peut également être destiné pour autres spécialités en première année telles que : Sciences de la nature et de vie (Biologie), Pharmacie, Médecine, chimie... etc.Au cours du 1er Semestre Universitaire du L1
éléments de décision quant à leur orientation future. Le programme proposé reprend des
notions déjà abordées dans le secondaire. Deux objectifs seront poursuivis à savoir :9 Formaliser ces notions essentielles en montrant que la chimie est susceptible de
déductions logiques et rigoureuses.9 méthodes pédagogiques actuellement utilisées à
Concernant spécialement cette matière chimie 1en utilisant les particules élémentaires constitutifs et quantifier la matière. Aussi, il doit être
élément chimique dans une classification périodique et distinguer puis classer leurs propriétés
Le module chimie 1 est divisé en quatre chapitres: 9 9 9 fonction de leurs fonctions.9 Chapitre 4
Ces chapitres doivent être complétés dans cet ordre spécifique. Les étudiants seront
questionnés à différents moments pour mesurer leur degré de compréhension, avant de
passer au niveau suivant.Chapitre I: Atomistique Chimie 1 en Génie Industriel
Cours et travaux dirigés Atomistique et chimie organique Page 2Chapitre I
Atomistique
1. Atome :
1.1. Introduction
La matière est formée à partir de grains élémentaires: les atomes. 126 atomes ou éléments
ont été découverts et chacun d'eux est désigné par son nom et son symbole.Exemple : Carbone : C ; Azote : N.
L'atome est un ensemble électriquement neutre comportant une partie centrale, le noyau(protons + neutrons), où est centrée pratiquement toute sa masse, et autour duquel se
trouvent des électrons.En fait, l'atome n'existe pas souvent à l'état libre, il s'associe avec d'autres pour former des
molécules.1.2. Noyau
Le noyau est formé de particules élémentaires stables appelées nucléons, qui peuvent se
présenter sous deux formes à l'état libre, le neutron et le proton. - Les protons sont chargés positivement : qp = +e = 1,602 .10-19 C - La masse du proton : mp = 1,673 .10-27 - Les neutrons sont de charge nulle, leur masse est : mn = 1,675 .10-27 kg. Conclusion : Toute la masse de l'atome est concentrée dans le noyau.Chapitre I: Atomistique Chimie 1 en Génie Industriel
Cours et travaux dirigés Atomistique et chimie organique Page 31.3. Electron
L'électron porte une charge électrique fondamentale négative égale à -1,6×10-19 coulombs. La
masse d'un électron est d'environ 9,11 × 10-31 kg, ce qui correspond à environ 1/1 800 de la
masse d'un proton. L'électron fait partie de la famille de particules appelées " leptons "1.4. Identification des éléments
1.4.1. Représentation
A chaque élément chimique, on a associé un symbole. Il s'écrit toujours avec une majuscule,
éventuellement suivie d'une minuscule :
XA ZZ est appelé numéro atomique ou nombre de c
aussi le nombre d'électrons pour un atome neutre). Pour un élément quelconque, la charge du noyau (protons) est +Ze. De même la charge des électrons sera -Ze. A est appelé nombre de masse, il désigne le nombre de nucléons (protons + neutons). Si N représente le nombre de neutrons, on aura la relation : A = Z + N1.4.2. Isotopes
Ce sont des atomes de même numéro atomique Z et de nombre de masse A différent. Un élément peut avoir un ou plusieurs isotopes.Il n'est pas possible de les séparer par des réactions chimiques, par contre cela peut être réalisé
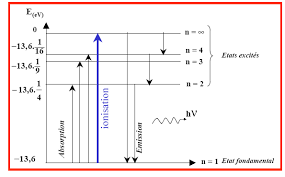
en utilisant des techniques physiques notamment la spectroscopie de masse.Bohr propose quatre hypothèses :
Dans l'atome, le noyau est immobile alors que l'électron de masse m se déplace autour du noyau selon une orbite circulaire de rayon r.L'électron ne peut se trouver que sur des orbites privilégiées sans émettre de l'énergie ;
on les appelle "orbites stationnaires".Lorsqu'un électron passe d'un niveau à un autre il émet ou absorbe de l'énergie :
¨( K
Chapitre I: Atomistique Chimie 1 en Génie Industriel
Cours et travaux dirigés Atomistique et chimie organique Page 4 Le moment cinétique de l'électron ne peut prendre que des valeurs entières (quantification du moment cinétique) : PYU QKOE h : constante de Planck et n : entier naturel.1.5.2. Aspect quantitatif de l'atome de Bohr
Le système est stable par les deux forces
aF et cF 2 0 2 4r eFaForce centrifuge :
r mvFc 2Le système est en équilibre si :
caFF o c.à.d r emv 0 2 2 4 (1)Energie totale du système :
ET = Ec + Ep Ec : énergie cinétique (Ec = mv2/2) et Ep : énergie potentielle, elle est due à
l'attraction du noyau (Ep = Fa.dr = - e2ʌİ0r) Donc r eETquotesdbs_dbs11.pdfusesText_17[PDF] cours de chimie organique generale pdf
[PDF] chimie organique terminale s exercice
[PDF] chimie terminale d pdf
[PDF] fiche chimie terminale s
[PDF] tout en un physique psi pdf
[PDF] fiche chimie organique pcsi
[PDF] cours de chimie pcsi
[PDF] exercices corrigés sur la structure de l atome pdf
[PDF] atkins physical chemistry 9th edition pdf
[PDF] technico science secondaire 4
[PDF] math sn definition
[PDF] math forte secondaire 5
[PDF] cours l'air qui nous entoure
[PDF] controle chimie 4ème l'air qui nous entoure
