 Atomistique et Chimie Organique Cours et Exercices Corrigés
Atomistique et Chimie Organique Cours et Exercices Corrigés
Atomistique et Chimie Organique. Cours et Exercices Corrigés. (Chimie 1 en Génie Industriel). Page 2. République Algérienne Démocratique et Populaire. Ministère
 SUPPORT PAPIER DU COURS NECESSAIRE TRES UTILE
SUPPORT PAPIER DU COURS NECESSAIRE TRES UTILE
Queyrel Atomistique et Structures
 EXERCICES-ATOMISTIQUE.pdf
EXERCICES-ATOMISTIQUE.pdf
La disparition de la matière est compensée par une libération d'énergie au cours de la formation du noyau. 8 l. LAASRI. Série 1 : QCM - Tester yotre
 Atomistique Corrigé
Atomistique Corrigé
Feb 20 2019 PREMIER EXERCICE. L'ANTIMOINE Sb. Le numéro atomique de l'antimoine est ... cours de remplissage) : Sb possède 5 électrons de valence : 5s2 5p3 ...
 LES FONDAMENTAUX
LES FONDAMENTAUX
Le nombre de ces exercices tous intégralement corrigés
 CHIMIE GENERALE-d
CHIMIE GENERALE-d
Chimie ( Cours et exercices corrigés) ch gle 15/1-2. 168. 169. 16. Chimie 1 ( 1ère année PCST. ) ch gle 16/1-2. 993. 994. 17. Toute la chimie en 151 exercices
 Untitled
Untitled
Exercices corrigés d'atomistique et liaison chimique pdf. Atomistique cours et exercices corrigés pdf. Atomistique et liaison chimique exercices corrigés pdf.
 COURS Atomistique 1er Semestre
COURS Atomistique 1er Semestre
http://www.wontu.fr/COURS/RADIOACTIVITE.pdf · http://lpsc.in2p3.fr/schien Dunod. - Cours et Exercices Corrigés Paul Arnaud Ed. Dunod. - Chimie Générale ...
 COURS DE CHIMIE-PCSI/MPSI/TSI- elfilalisaid@yahoo.fr Page -2
COURS DE CHIMIE-PCSI/MPSI/TSI- elfilalisaid@yahoo.fr Page -2
H. ◮ Le numéro atomique Z représente le nombre de protons et N le nombre de neutrons. ◮ On appelle nombre de masse A la somme des nucleons (A = Z + N).
 COURS DE CHIMIE ATOMISTIQUE
COURS DE CHIMIE ATOMISTIQUE
∆E (MeV) = ∆m (uma) 931. Page 10. Cours Atomistique. DR G. Merabet. 10. Exercice 4 : Calculer pour le noyau 24 Mg : sa masse en Kg son volume en m3 et sa
 Atomistique et Chimie Organique Cours et Exercices Corrigés
Atomistique et Chimie Organique Cours et Exercices Corrigés
Remarque : Chaque orbitale atomique est donc caractérisée par une combinaison des trois nombres quantiques n l et m. Page 14. Chapitre I: Atomistique. Chimie 1
 X A Rb Rb
X A Rb Rb
Cours Darwin. Exercices Corrigés. Corrigé de Série n°1 : Exercices d'atomistique. Données à utiliser en cas de besoin : Intitulé. Symbole. Valeur en M.K.S.A.
 COURS Atomistique 1er Semestre
COURS Atomistique 1er Semestre
http://lpsc.in2p3.fr/schien/PHY113a/Cours%20radioactivite%202009-2010.pdf Cours et Exercices Corrigés Paul Arnaud Ed. Dunod.
 SUPPORT PAPIER DU COURS NECESSAIRE TRES UTILE
SUPPORT PAPIER DU COURS NECESSAIRE TRES UTILE
Cours de Chimie Dunod
 TOUT LE COURS EN FICHES
TOUT LE COURS EN FICHES
Chapitre 2 Atomistique pour s'auto-évaluer exercices d'application corrigés
 Rappels atomistiques structure des métaux
Rappels atomistiques structure des métaux
http://campus.cerimes.fr/odontologie/enseignement/chap1/site/html/cours.pdf
 COURS DE CHIMIE ATOMISTIQUE
COURS DE CHIMIE ATOMISTIQUE
Cours Atomistique. DR G. Merabet Exercice n°1: Donner les mélanges et les corps purs des éléments suivants : le fer H2
 COURS DE CHIMIE Avec EXERCICES
COURS DE CHIMIE Avec EXERCICES
chapitre aux questions des exercices d'auto-évaluation. Il faut rappeler que cet ouvrage Chimie Organique « Cours & Exercices corrigés » Melania Kiel.
 Chimie (problèmes et exercices) Indice 540.76 Nombres de Titres
Chimie (problèmes et exercices) Indice 540.76 Nombres de Titres
Omar Bouh Abdillahi 541.2/78. 10. 2. 2729869743. Chimie générale .Tome1
 Cours de Chimie Structure de la matière
Cours de Chimie Structure de la matière
Les bases théoriques sont présentées de manière logique et progressive au fil des chapitres avec des exercices corrigés dans chaque chapitre. Le premier
 Atomistique - Cours-Résumés-Exercices et Examens corrigés
Atomistique - Cours-Résumés-Exercices et Examens corrigés
Atomistique: cours Résumés Exercices et examens corrigés I- Généralités sur l'atome L'atome est l'élément fondamental de la matière à cause de sa
 [PDF] Atomistique et Chimie Organique Cours et Exercices Corrigés
[PDF] Atomistique et Chimie Organique Cours et Exercices Corrigés
Dr ZENASNI Mohamed Amine Dr MEROUFEL Bahia 2019/2020 Atomistique et Chimie Organique Cours et Exercices Corrigés (Chimie 1 en Génie Industriel)
 TD et Exercices corrigés Atomistique Smpc 1 PDF - EPrePare
TD et Exercices corrigés Atomistique Smpc 1 PDF - EPrePare
21 jui 2018 · TD et Exercices: PDF 1:TD et Exercices avec Corrigés Atomistique SMP1-SMC1 S1 Cours Atomistique filière SMPC S1 PDF · Examens Corrigés
 Atomistique cours et exercices corrigés PDF - GooDPrepA
Atomistique cours et exercices corrigés PDF - GooDPrepA
Télécharger 6 Fichier PDF qui contient des Traveaux pratiques et des Exercices corrigés de la Atomistique Et n'oubliez pas de partager cette article et
 Examens Exercices Corrigés Atomistique PDF L1 Gratuit - eBoikcom
Examens Exercices Corrigés Atomistique PDF L1 Gratuit - eBoikcom
Télécharger gratuitement TD QCM exercices et examens corrigés de Atomistique PDF S1 Bachelor / Licence Chimie SMPC SMIA (1ère année L1) Pour les cours
 [PDF] Atomistique Corrigé - Chimie en PCSI
[PDF] Atomistique Corrigé - Chimie en PCSI
20 fév 2019 · mol-1 Donner le symbole de l'isotope le plus abondant et préciser la composition de son noyau Cette masse molaire est
 Licence 1 Atomistique Cours et Exercices Corrigés PDF
Licence 1 Atomistique Cours et Exercices Corrigés PDF
Atomistique et Chimie Organique Cours et Exercices Corrigés PDF: Ce document de la Faculté de Technologie de Tlemcen est destiné aux étudiants de Chimie
 Exercices corrigés de Atomistique ( Excellent ) smpc s1 pdf
Exercices corrigés de Atomistique ( Excellent ) smpc s1 pdf
Atomistique exercice corrigé smpc S1 sciences de la matière physique et chimie Semestre 1 Science travaux dirigés exercice corrigé
 Examens Corrigés Atomistique - exomaroc
Examens Corrigés Atomistique - exomaroc
À première vue la théorie de la liaison chimique semble un bel exercice consacré à cette construction Examens Corrigés N°1 Atomistique PDF cliquez ici
 TD Et Séries Atomistique SMPC S1 + Corrigés - Pdf-Cours
TD Et Séries Atomistique SMPC S1 + Corrigés - Pdf-Cours
5 nov 2019 · TD 10 (Plusieurs Exercices Atomistique Avec Les Corrections - SMPC S1) ===> Cliquer ici TD 7 (TD Atomistique 2011 avec corrigées

Cours Atomistique DR G. Merabet
1Département de Médecine Dentaire
COURS DE CHIMIE
ATOMISTIQUE
1ERE ANNEE DE MEDECINE DENTAIRE
ANNEE 2021 2022
DR G. MERABET
Cours Atomistique DR G. Merabet
2Chapitre I
Structure de la matière
Objectifs
Comprendre de quoi et comment est composée la matière.physique, y compris les organismes vivants, est constitué de matière .Celle-ci est caractérisée par sa
masse et son énergie qui mesure sa capacité à produire du travail.I-1 Structure de la matière
La matière est formée à partir de grains élémentaires, ce sont les atomes.quantité de matière infiniment petite de masse égale à environ 10-27 Kg et de dimensions de quelques
112 atomes ou éléments ont été découverts et chacun d'eux est désigné par son nom et son symbole.
Exemple : Hydrogène: H ; Fer: Fe ; Oxygène ; Carbone : C L'atome n'existe pas souvent à l'état libre, il s'associe avec d'autres atomes pour former des molécules. On a des molécules monoatomiques diatomiques (H2, O2, poly atomiques (H2O, NaOH, H2SO4La matière se trouve sous trois états
Glace Eau V
Solide Liquide Gaz Ordonné DésordonnéI-2 Mlanges et Corps purs
A- Mélanges
Un mélange est formé de molécules non identiques. Exemple : Une solution de NaOH ; les composés présents sont : H2O, H+, OH-, Na+ Il existe deux types de mélange : homogène et hétérogèneMélange homogène
Exemple : de mer
Mélange hétérogène : on est en présence de plusieurs phases.Exemple :
B- Corps purs : un corps pur est formé de molécules identiques.Exemple : le gaz oxygène O2.
Il existe deux types de corps purs : simple et composé. Corps pur simple : les atomes de la molécule sont identiques.Exemple : 3, H2, N2
Corps pur composé : les atomes de la molécule sont différents. Exemple : le dioxyde de Carbonne CO2, le méthane CH41A° = 10-10m = 10-8cm
Cours Atomistique DR G. Merabet
3Exercice n°1: Donner les mélanges et les corps purs des éléments suivants : le fer, H2, eau+sel,
solution de HCl, le sable, H2O, Zn.Solution :
Corps purs simples Corps purs composés Mélanges Mélanges homogènes hétérogènesFe H2O eau + sel le sable
H2 solution de HCl ZnI-3 N notion de la mole
I-3-1 N
est le nombre de molécules de gaz qui sont contenues dans un volume de 22,41 sous les conditionsnormales de température et de pression (t = O°C et P=1 atm). Ce nombre noté N est égal à :
N = 6,023 1023
I-3-2 Notion de la mole
La mole est la quantité
élémentaires (molécules, atomes ou ions) on pose :1 mole = N (molécules ou atomes)
Exemple : 1 mole de carbone N atomes de carbone1 mole de H2O N molécules de H2O
I-3-3 Masse moléculaire et Masse atomique
L la Exemple : 1 mole de NH3 N molécules de NH 3 17g1 mole de carbone N atomes de C 12g
I-4 Unité de masse atomique (uma)
Les masses des atomes étant infiniment petites, on utilise une nouvelle unité de mesure pour la masse
nité de masse atomique (uma).Définition :
Lème de la masse du carbone 12
Cours Atomistique DR G. Merabet
41 mole de carbone N atomes de C 12g Donc : x = 12 / N g
1 atome de C x g
Or, 1 uma = 1/12(la masse 12/ N ) = 1/ N g
On pose alors :
On a 1mole de Fe 56 g N atomes de Fe x 1 atome de FeDonc : x = 56/N g = 56 uma
1 mole de H2O 18 g N molécules de H2O
y 1 molécule de H2ODonc : y = 18/ N g = 18 uma
Remarque :
La masse
Chapitre II
Structure
s sauf pour les gaz est constitué de différentes particules élémentaires, dont proton et le neutron. II-1 a- : b- Le proton c- Le neutronProton Neutron Electron
Charge (coulombs) Q = 1,602 10-19 Q = 0 Q = -1,602 10-19 Masse (Kg) M = 1,673 10-27 M = 1,675 10-27 M = 9,1 10-31 Masse (uma) M = 1,007278 M = 1,008665 M = 5,5 10-4Remarque :
1uma = 1,66 10-24 g = 1,66 10-27 kg = 1/N g
Cours Atomistique DR G. Merabet
5 d- Le noyau : I Rutherford. Il a déduit que toute la : le noyau central. Les électrons négatifs gravitent autours du noyau comme les planètes autour du soleil. - Le noyau est sphérique son volume sera calculé par la relation : ɉ3 - Ra = 104 RnEn conclusion
1- est le principal composant de la matière, donc
la matière possède une structure lacunaire. 2- appelle : les nucléons.3- Un atome est caractérisé par deux nombres entiers différents de zéro notés :
A et Z
Z XLe numéro atomique Z :
Z = nombre de protons = nombre des électrons
Le nombre de masse A : il correspond à la somme des nombres de protons et des nombres de neutronsA = nombres de protons + nombre de neutrons
A = Z + N
Les nombres A, Z, et N caractérisent un atome ou son noyauExemple
23 Na protons = électrons = 11, les neutrons = 12
1183 Bi protons = électrons = 83, les neutrons = 126
A 209Cours Atomistique DR G. Merabet
6II-2 Isotopes
a- Définition: Les isotopes sont des atomes qui possèdent le même numéro atomique Z et des nombres
de masses A différents, donc des nombres de neutrons différents.Exemple Hydrogène
H11Deutérium
H21Tritium
H31 : 15O 16O 17O Les isotopes du carbone : 12C 13C 14CLa plupart des éléments existe
(%) de chacun est différente dans la nature, on définit alors : b- ( MElle est notée
M et représente la moyenne des masses isotopiques pondérées par leurs abondances (%) relatives. 1001 n iimXi M
Mi = masse
Xi = 100Exercice n°2 : le magnésium Mg se présente comme un mélange trois isotopes 24Mg 25 Mg et 26Mg
dans les pourcentages respectifs : 78,60%, 10,11% et 11,29%. Trouver la masse moyenne de MgSolution :
M = x1 m 1 + x2 m 2 + x3 m 3 / 100 = 78,60x 24 + 10,11x 25 + 11,29x 26 / 100M = 24, 32 g
Remarque :
Les isobares : ce sont des éléments qui ont le même nombre de masse A et des numéros
atomiques Z différents.Exemple 15O 15N
8 7 8 1 5 O 8 1 5 O 8 1 5 O 6 1 5 O 6 5 O 6 1 5 OCours Atomistique DR G. Merabet
7 Les isotones : Ce sont des éléments qui ont le même nombre de neutronsExemple 16O 15N 17F
Appellation Z A Nombre de
Neutrons
Isotopes Le même Différent Différent
Isobares Différent Le même Différent
Isotones Différent Différent Le même
radioactivité naturelle ou artificielleIntérêts des isotopes stables
La médecine utilise ces isotopes pour l'imagerie médicale. Les radio-isotopes sont de plus en plus
employés dans le cadre médical, en tant qu'analgésiques et traitement contre le cancer. Le
rayonnement émis tue les agents pathogènes.Quelques exemples d'imagerie médicale
Oncologie et cardiologie: technétium-99m
Poumons: Xénon-133
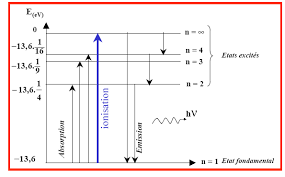
II-3 Etude du noyau atomique
entre ces nucléons sont très faibles ce qui explique la stabilité des charges positives dans le noyau.
a- Le rayon :R = R0 A 1/3
A = le nombre de masse
R0 = 2 fermis = 1,414 10-15 mètresCette relation est valable pour tous les noyaux.
Exercice n°3 : Calculer le rayon du noyau 14N
R = 2 10 15 (14)1/3 R = 3,40 10 -15m R = 3,4 10- 5 A°. b- ǻǻ : e perte de masse appelée : le défautǻ la masse réelle ou expérimentale
ǻm) = Z (masse proton) + (A-Z) (masse neutron) - la masse expérimentale 8 7 9Cours Atomistique DR G. Merabet
8Cette perte de masse se transforme spontanément en énergie, cette énergie est alors absorbée par les
cohésion du noyau, elle est donnée par la relation instein . C : la célérité ou la vitesse de la lumière dans le vide = 3 108 mètres /sRemarque
e potentiel (ddp) de 1 volt dans le vide.1eV = 1.6 10-19 joules (J)
1 Méga eV = 1 M eV = 106 eV 1MeV = 1,6 10 - 13 Joules
c- la stabilité du noyau (a): a = Energie de liaison/ Nombre de masse a = ǻE/A (MeV/nucléons)Remarque : (a) est grande.
Références bibliographiques (Bibliothèque du campus)Titre du livre Auteurs Edition
Concours PCEM1
Chimie générale
(cour et exercices)Frederick
Ravomanana Science
QCM Chimie générale
2ème édition Ayadim De boeck
Exercices de chimie
généraleChristos
Comninelli 3ème édition
Chimie générale
S.D.Bresnick Pradel
Chimie générale
R Ouahes OPU
Chimie générale PCEM Marie Gruia Ellipses
100 QCM corrigés M. Troupel Malone
Chimie générale Christian Bellec Vuibert
Chimie générale John W. Hill ERPI
PCEMLa chimie en 1001 Julien Bonin Ellipses
Abrégé de Nomenclature
pour la chimie organique Michel Duteil EllipsesChimie organique
120 QCM et exercices H. Galons Masson
ǻ E = ǻ m C2
Cours Atomistique DR G. Merabet
9REMARQUE IMPORTANTE
Il existe deux grands systèmes internationaux de mesuresSystème SI
M K S A
Mètres kilogrammes secondes ampères
1 e V = 1,6 10-19 joules
Système SII
C G S A
Centimètres grammes secondes ampères1 erg = 10 -7 joules
On rappelle que :
2 (m/s) 2 1 uma = 14,94 10 -11joules
11 1 uma = 931 MeV
Cours Atomistique DR G. Merabet
10Exercice 4 :
Calculer pour le noyau 24 Mg : sa masse en Kg, son volume en m3 et sa masse volumique.Solution :
La masse du noyau 24 Mg est : 24 uma, donc la masse du noyau en Kg sera : m = 24 x 1,66 10 27 = 3,984 10 26 Kg. Donc m = 3,984 10 26 Kg. Le volume du noyau V : Le noyau étant sphérique donc son volume sera : V = 4/3ʋR 3 Le rayon R = R0 A 1/3 R = 1,414 10-15 (24) 1/3 R = 4,078 10 15 mEn remplaçant on trouvera le volume du noyau
V = 4/3 ʋ [1,414 10-15 (24) 1/3] 3 = 2,84 10 43 m 3 V = 2,84 10 43 m 3.La masse volumique du noyau :
ʌс masse ͬ ǀolume ʌс 3,984 10 26 donc ȡ 17 Kg/ m32,84 10- 43
C'est aussi : ȡ 14 g/ cm3
Exercice 5 :
Soit le noyau du lithium : 7 Li. Calculer :
1. Son défaut de masse en uma
2. Son énergie de liaison (de cohésion) en joules et en MeV.
3. son énergie de liaison par nucléons
4. énergie de liaison par nucléons du Béryllium est 6,74 MeV/nuléons, quel sera alors le noyau le
plus stable ? Données : mp = 1,007278 uma mn = 1,008665 uma m exp = 7,001503 uma)Solution
7 Li : p = e - = 3 et les neutrons n =73 = 4
1. Le défaut de masse masse réelle = [ Zmp + (A- Z) mn ] m exp
7,001503 11 uma
2.énergie de cohésion C2 (m/s)2
27) ( 3.108) 2 12 joules
Ou bien 11
11 12 joules
= 0,054911 x 931 51,122 Mev3. :
a= / A (Mev/nucléons) a (Li) = 51,122 / 7 a (Li) = 7,303 Mev / nucléons4. Puisque a(Li) > a(Be) donc le noyau le plus stable est le lithium.
Cours Atomistique DR G. Merabet
11Chapitre III S
Rappel :
masse qui contient Z protons et (A-Z) neutrons et de Z e- Comment se situe les e- par rapport à ce noyau ? III-1 Introduction aux premiers modèles atomiquesIII-1-1 Modèle de Thomson
L - pour
Ce modèle est totalement inexact, car il ne prend pas en considération du vide qui existe dans la matière.III-1-2 Modèle de Rutherford
Ce modèle est basé sur l'existence du noyau dans lequel est pratiquement concentrée toute la masse de l'atome et autour duquel gravitent des électrons. La stabilité mécanique résulte de la compensation des forces d'attractions (F1) par les forces centrifuges (F2) dues à la rotation des électrons autour du noyau. L'avantage de cemodèle c'est qu'il ne fait appel qu'aux lois de la mécanique classique. Par contre, il présente
des faiblesses:Faiblesses du modèle de Rutherford
l'électron rayonne des ondes électromagnétiques, donc il va perdre de l'énergie et finirait par tomber sur le noyau. NoyauElectrons
quotesdbs_dbs30.pdfusesText_36[PDF] cours de chimie organique generale pdf
[PDF] chimie organique terminale s exercice
[PDF] chimie terminale d pdf
[PDF] fiche chimie terminale s
[PDF] tout en un physique psi pdf
[PDF] fiche chimie organique pcsi
[PDF] cours de chimie pcsi
[PDF] exercices corrigés sur la structure de l atome pdf
[PDF] atkins physical chemistry 9th edition pdf
[PDF] technico science secondaire 4
[PDF] math sn definition
[PDF] math forte secondaire 5
[PDF] cours l'air qui nous entoure
[PDF] controle chimie 4ème l'air qui nous entoure
