 LES ALCANES
LES ALCANES
Les alcanes sont des hydrocarbures de formule brute CnH2n+2. Tous leurs atomes Un alcane peut donc s'écrire R – H. • alcane à chaîne carbonée ramifiée. La ...
 NOMENCLATURE EN CHIMIE ORGANIQUE 1. Hydrocarbures (HC
NOMENCLATURE EN CHIMIE ORGANIQUE 1. Hydrocarbures (HC
b) Trouver la structure d'une molécule connaissant le nom. 1. Hydrocarbures (HC) saturés acycliques : les alcanes S'il y a plusieurs groupes substituants ...
 RAPPELS DE CHIMIE ORGANIQUE DE 1ERE S
RAPPELS DE CHIMIE ORGANIQUE DE 1ERE S
Alcane. Chaîne cyclique saturée. Cyclane. Chaîne comportant une double liaison. Alcène. Chaîne comportant une triple liaison. Alcyne. 2) Nomenclature des
 Les alcanes exercices corrigés
Les alcanes exercices corrigés
Exercices corrigés sur les alcanes première s pdf. Cours et exercices corrigés sur les alcanes pdf. Les alcanes exercices corrigés pdf 1ère l2. Cette page
 Exercices résolus - de chimie organique - Les cours de Paul Arnaud
Exercices résolus - de chimie organique - Les cours de Paul Arnaud
Il y a donc un atome d'hydrogène en trop par rapport au maximum autorisé. • C2H2Cl6. Formule moléculaire de l'alcane à deux atomes de carbone : C2H6. 6.
 THÈME : CHIMIE ORGANIQUE TITRE DE LA LEÇON : QUELQUES
THÈME : CHIMIE ORGANIQUE TITRE DE LA LEÇON : QUELQUES
La nomenclature des alcools est semblable à celle des alcanes : le ''e'' final du nom de l'alcane Il s'agit d'une réaction ménagée parce qu'elle conserve le ...
 Première A
Première A
14 févr. 2020 Nommer les alcanes suivants. 2-methylbutane. 3-ethyl-2-methylpentane ... A la fin de la séance du cours de chimie sur les alcanes votre ...
 THEME: CHIMIE ORGANIQUE TITRE DE LA LEÇON
THEME: CHIMIE ORGANIQUE TITRE DE LA LEÇON
8 oct. 2022 Écris l'équation-bilan de la combustion complète des alcanes. 2. Déduis la formule brute de l'alcane A. 3. Donne les formules semi-développées ...
 COURS DE CHIMIE ORGANIQUE
COURS DE CHIMIE ORGANIQUE
cour). 3-Les alcanes cycliques. On fait précéder le nom de l'alcane du terme « cyclo ». Exemples : (les exemples sont traités sur feuilles en cour). II - La ...
 cours de chimie organique(1)
cours de chimie organique(1)
cour). 3-Les alcanes cycliques. On fait précéder le nom de l'alcane du terme « cyclo ». Exemples : (les exemples sont traités sur feuilles en cour). II - La ...
 LES ALCANES
LES ALCANES
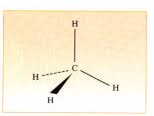
6. Modèle de Lewis : C. L'atome de carbone peut avoir 4 liaisons covalentes simples Les alcanes sont des hydrocarbures de formule brute CnH2n+2.
 Alcanes et alcools 1. Formules brute et semi-développée 2. Chaîne
Alcanes et alcools 1. Formules brute et semi-développée 2. Chaîne
SMARTCOURS » 1ère » Physique-Chimie » Chimie » Cours » Alcanes et alcools www.smartcours.com - ennoia © page 1/6. Alcanes et alcools. Objectifs.
 NOMENCLATURE EN CHIMIE ORGANIQUE 1. Hydrocarbures (HC
NOMENCLATURE EN CHIMIE ORGANIQUE 1. Hydrocarbures (HC
Hydrocarbures (HC) saturés acycliques : les alcanes S'il y a plusieurs fois le même groupe dans la molécule on utilise un préfixe : nb de substituants.
 RAPPELS DE CHIMIE ORGANIQUE DE 1ERE S
RAPPELS DE CHIMIE ORGANIQUE DE 1ERE S
On représente l'enchaînement des atomes de C par une ligne brisé qui représente les liaison simples entre les C. Chaque extrémité de segment comporte un
 Première A
Première A
Sur le chemin de l'école deux élèves de la 1ère A2 du Lycée Moderne 2 d'Agboville s'engagent
 Cours de chimie organique
Cours de chimie organique
Les 4 orbitaux « s » sphériques de 4 atomes d'hydrogène formant un système tétraédrique. Cette hybridation du carbone se retrouve dans tous les alcanes de
 ALCANES ET CYCLOALCANES 1- Définitions Les hydrocarbures
ALCANES ET CYCLOALCANES 1- Définitions Les hydrocarbures
Les noms des alcanes linéaires comportant un nombre d'atomes de carbone supérieur à alcane n alcane. 1 méthane. 6 hexane. 11 undécane. 16 hexadécane.
 COURS DE CHIMIE ORGANIQUE Semestre 2 SVI
COURS DE CHIMIE ORGANIQUE Semestre 2 SVI
II-6- Résumé des hybridations du carbone de l'azote et de l'oxygène Les alcanes sont des hydrocarbures saturés de formule brute CnH2n+2.
 PROPRIETES DES ALCANES ALCENES ET ALCYNES I
PROPRIETES DES ALCANES ALCENES ET ALCYNES I
L'équation –bilan générale de la combustion complète des alcanes s'écrit : Au cours de cette réaction les atomes de chlore ont successivement remplacé ...
 Untitled
Untitled
Cubier. Chapitre 6. ALCANES. Ce sont les constituants principaux des pétroles et du gaz naturel. Is sont encore appelés hydrocarbures saturés ou paraffines
 [PDF] LES ALCANES
[PDF] LES ALCANES
Les alcanes sont des hydrocarbures de formule brute CnH2n+2 Tous leurs atomes de carbone sont tétragonaux Le méthane CH4 est le plus simple des alcanes 2 2
 [PDF] RAPPELS DE CHIMIE ORGANIQUE DE 1ERE S - Physagreg
[PDF] RAPPELS DE CHIMIE ORGANIQUE DE 1ERE S - Physagreg
RAPPELS DE CHIMIE ORGANIQUE DE 1ERE S I Différentes formules chimiques pour une même molécule : Une molécule organique comportera donc une chaîne carbonée
 [PDF] TP cours Alcanes Alcools - Physique - Chimie
[PDF] TP cours Alcanes Alcools - Physique - Chimie
T P cours Alcanes Alcools Objectifs du TP: - Reconnaître une chaîne carbonée linéaire ramifiée ou cyclique - Nommer un alcane un alcool
 Nomenclature des alcanes et des alcools - Première - Cours - PDF à
Nomenclature des alcanes et des alcools - Première - Cours - PDF à
Cours de 1ère S - Nomenclature des alcanes et des alcools En chimie organique il existe de nombreuses familles de molécules
 Chap 2 Les Alcanes PDF Alcane Liaison chimique - Scribd
Chap 2 Les Alcanes PDF Alcane Liaison chimique - Scribd
Niveau : 1ère D OG 6 : COMPRENDRE LA STRUCTURE ET LES PROPRIETES DE CERTAINS COMPOSES ORGANIQUES TITRE : LES ALCANES Durée : 4 H Objectifs spécifiques :
 Chapitre 1 les alcanes Cours pdf
Chapitre 1 les alcanes Cours pdf
Cours Chapitre 1 les alcanes pdf Support de cours de chimie organique RAPPELS DE CHIMIE ORGANIQUE DE 1ERE S I Différentes formules chimiques pour
 [PDF] COURS DE CHIMIE ORGANIQUE Semestre 2 SVI
[PDF] COURS DE CHIMIE ORGANIQUE Semestre 2 SVI
II-6- Résumé des hybridations du carbone de l'azote et de l'oxygène Les alcanes sont des hydrocarbures saturés de formule brute CnH2n+2
 [PDF] cour-chimie-organique-S2-2017-2018pdf
[PDF] cour-chimie-organique-S2-2017-2018pdf
3 Isoméries : - Alcanes linéaires : isomérie de position et isomérie optique - Alcanes cycliques : isomérie cis-trans et isomérie optique
Cours Chimie HPE2 2012-2013
Page 1 sur 6
Alcanes et alcènes
I. Les alcanes
1. Introduction
Ce sont :
- des hydrocarbures - saturés (ils ne possèdent que des liaisons covalentes simples) - acycliques (chaînes ouvertes linéaires ou ramifiées) - de formule brute CnH2n+2.Naturellement, on extrait les alcanes du pétrole et du gaz naturel. Après raffinage et transformations
chimiques, ils sont utilisés comme matériaux de construction (asphalte), énergie fossile (fuel,
essence), matières plastiques2. Structure et nomenclature
2.1 Structure
: il possède deux liaisons dans leplan, une en avant du plan (liaison représentée en gras ci-dessous), et une en arrière du plan (liaison
représentée en tirets ci-dessous)Exemple : CH3 (CH2)3 CH3
2.2 Nomenclature
2.2.1 Alcanes linéaires
n 1 2 3 4 5 6 7 8 9 10 nom méthane éthane propane butane pentane hexane heptane octane nonane décane2.2.2 Alcanes ramifiés
i) chaîne principale.ii) On identifie les ramifications : ce sont des groupes alkyles. On écrit leur nom en remplaçant
iii) On numérote ensuite la chaîne carbonée principale. Quand il existe plusieurs possibilités, on
retient la séquence de numérotation contenant le plus petit indice. iv) Pour nomme un composé, on indique : o En 1er, les noms des ramifications alkyles (sans la terminaison e alphabétique, en les faisant précéder de leurs indices ; o e. HHH HHH H HH H HHCCCCC
Cours Chimie HPE2 2012-2013
Page 2 sur 6
o multiplicatifs : di-, tri-Exemples :
CH3CH3 CH2CH2CHCHCH2CH3
CH2CH3
3. Quelques propriétés physiques
donc fournir une plus grande énergie pour casser les liaisons intermoléculaires pour des
molécules à longues chaînes carbonées que pour des molécules à plus petites chaînes carbonées.)
ramifiés.(En effet, la distance qui sépare deux molécules voisines est plus grande pour des alcanes
ramifiés que pour des alcanes linéaires. Or les interactions de Van der Waals, étant de nature
électrostatique, diminuent quand la distance augmente.sont moins liées et plus faciles à séparer que leurs isomères linéaires. Ils sont donc plus volatils.)
Les alcanes ont une densité faible (d<1) et ne sont pas solubles dans les solvants aqueux. A température et pression ordinaires on a donc : n n 4 5 n 16 n 17Etat de CnH2n+2 gazeux liquide solide
4. Réactivité
4.1 Généralités
Les liaisons simples covalentes sont des liaisons fortes (300-500 kJ/mol). CH : donc les liaisons sont peu polarisées.
Il ne va donc pas avoir un atome qui va se retrouver avec un déficit ou un excès
parle alors de rupture homolytique (ou réaction radicalaire) des liaisons.4-éthyl-3-méthylheptane
CH2CH3
CH3 CH3 CH3C2,2-diméthylbutane
Cours Chimie HPE2 2012-2013
Page 3 sur 6
la liaison forte) : fort chauffage ou exposition à des rayonnements énergétiques.4.2 Réaction radicalaire (rupture homolytique)
Bilan global pour une molécule diatomique X-Y
X et Y récupère chacun un électron de la liaison covalente, ܺήet ܻ libres. Un radical libre est peu stable, il va donc soit chercher un autre radical pour former une nouvelle liaison, soit en se substituant à un atome dans une autre molécule.5. Réaction de substitution
5.1 Les halogènes
Les halogènes sont situés dans la 17ème colonne du tableau périodique. Cette famille
2. Le difluor étant extrêmement réactif,
normale » ne se f2, Br2 et I2. Un halogène va venir se5.2 Halogénation
Bilan global :
RH + X2 RX + HX
5.3 Exemple : fabrication du dichlorométhane
Cest un composé chimique utilisé comme constituant de décapants, dégraissant, gaz propulseur de bombe aérosol, agent moussant, pesticide gazeux, etc. i) ܥ ii) ܪܥ6. Réaction de destruction : combustion dans O2
La combustion dun alcane est une réaction doxydation destructrice entre lalcane et le dioxygène O2. Les hydrocarbures sont détruits et produisent du dioxyde de carbone CO2 et de la vapeur deau H2O. Si le dioxygène est présent dans les proportions ométriques ou en excès, on parle de combustion complète, dont le bilan sécrit :OH)1n(nCOO2
1n3HC2222n2no
QR < 0 : réaction exothermique.
QR est lenthalpie molaire (ou massique) de réaction (1 ou kJ.g1.) Une réaction exothermique va dégager de la chaleur.Cours Chimie HPE2 2012-2013
Page 4 sur 6
Si le dioxygène est en défaut, on parle alors de combustion incomplète, et dautres produits sont
alors formés, comme du monoxyde de carbone, du carbone (suie), des alcanes qui nont pas réagi, etc.II. Les alcènes
1. Introduction
Ce sont :
- des hydrocarbures - insaturés (ils possèdent une liaison double C=C) - acycliques - de formule brute CnH2n. La plupart des alcènes sont produits à partir des alcanes, et sont à la base de lindustrie des polymères.2. Structure et nomenclature
2.1. Structure.
A cause de la double liaison, la structure tétraédrique du carbone est modifiée, et devient
trigonale. Les liaisons sont maintenant dans un même plan : La double liaison empêche toute rotation autour delle, on aura donc une distinction entre deuxisomères, suivants que les ramifications soient du même côté de la liaison (isomère Z), ou au
contraire de chaque côté (isomère E)2.2.Nomenclature
2.2.1 Alcènes linéaires
La nomenclature des alcènes linéaires est construite à partir de la nomenclature des alcanes : on remplace le " ane » des alcanes (propane) par la terminaison " ène » (propène). Lorsque le nombre de carbone dans la chaîne principale est supérieur ou égal à 4, il faut indiquer par un nombre (appelé indice) le carbone où la double liaison débute. Cet indice de position doit être le plus petit possible. Exemple : CH3-CH2-CH2-CH=CH2 pent-1-ène (et non pas pent-4-ène)2.2.2 Alcènes ramifiés
Même règle que pour les alcanes, mais la double liaison est obligatoirement dans la chaîne principale !!! CCCours Chimie HPE2 2012-2013
Page 5 sur 6
Exemple :
CH3 CHCH=CCH2CH2CH3
CH3 CH2CH3
3. Propriétés physiques
ènes linéaires augmentent lorsque le
carbone croît. Un alcène a une température débullition plus basse que lalcane correspondant. Les isomères E sont plus stables que les isomères Z. Les alcanes ne sont pas solubles dans les solvants aqueux ou polaires.4. Réactivité
4.1 Généralités
La double liaison C=C possède une dissymétrie : une de ses liaison est forte, lorsque lautre va être plus facilement cassable. Ce site riche en électron est attaquable par des composés électrophiles, qui vont venir casser une des deux liaisons : on parle alors daddition électrophile. On aura donc généralement au final une molécule saturée. 4.2Schéma général :
4.2.1 : hydrogénation ou halogénation :
Bilan global dune hydrogénation :
Alcène + dihydrogène ĺ alcane
Schéma global :
Lhydrogénation conduit à former lalcane correspondant. Les hydrogènes sont ajoutés du même côté de la liaison, en présence dun catalyseur métallique (Ni, Pd, Pt)Bilan global dune halogénation :
Alcène + dihalogène ĺ dihalogénoalcane4-éthyl-2-méthylhept-3-ène
CCCCA A BBCCCCH
H H HCours Chimie HPE2 2012-2013
Page 6 sur 6
consiste à ajouter un dihalogène à un alcène :RCH=CH2 + X2
oNiRCHXCH2X
Cette réaction conduit à un mélange équimolaire de chaque isomère.4.2.2 : hydratation ou hydrohalogénation:
Bilan global dune hydratation :
Alcène + eau ĺ alcool
Schéma global :
ence est celui qui répond à la règle de MarkownikovExemple :
CH3CH=CH2 + H2O
osulfuriqueacideCH3CHOHCH3
Remarque :
dans le cas dune réaction dhydrohalogénation (alcène + HX où X est un halogène) 5.5.1 Ozonolyse
par lozone O3, avec coupure de la chaîne carbonée au niveau de la double liaison : Lozonolyse est surtout utilisée pour analyser la structure dun alcène.Les molécules formées sont des composés carbonylés appelés cétones ou aldéhydes,
facilement identifiables, ce qui permet de retrouver la structure de lalcène.5.2 Cas de la combustion.
Comme les alcanes, les alcènes peuvent subir une combustion complète dans le dioxygène selon : CCCCH H OH OHquotesdbs_dbs10.pdfusesText_16[PDF] alcane groupe caractéristique
[PDF] alcane ramifié
[PDF] oxydation des alcools exercices corrigés
[PDF] taux de sulfate dans l'eau
[PDF] teneur en sulfate dans les sols
[PDF] écrouissage isotrope et cinématique
[PDF] écrouissage isotrope linéaire
[PDF] comportement non linéaire des matériaux
[PDF] la chine et l'afrique un nouveau partenariat pour le développement
[PDF] relation chine afrique
[PDF] la chine en afrique : enjeux et perspectives
[PDF] la chine populaire et l afrique
[PDF] la chine en afrique menace ou opportunité pour le développement
[PDF] présence chinoise en afrique
