 LES ALCANES
LES ALCANES
Les alcanes sont des hydrocarbures de formule brute CnH2n+2. Tous leurs atomes Un alcane peut donc s'écrire R – H. • alcane à chaîne carbonée ramifiée. La ...
 NOMENCLATURE EN CHIMIE ORGANIQUE 1. Hydrocarbures (HC
NOMENCLATURE EN CHIMIE ORGANIQUE 1. Hydrocarbures (HC
b) Trouver la structure d'une molécule connaissant le nom. 1. Hydrocarbures (HC) saturés acycliques : les alcanes S'il y a plusieurs groupes substituants ...
 RAPPELS DE CHIMIE ORGANIQUE DE 1ERE S
RAPPELS DE CHIMIE ORGANIQUE DE 1ERE S
Alcane. Chaîne cyclique saturée. Cyclane. Chaîne comportant une double liaison. Alcène. Chaîne comportant une triple liaison. Alcyne. 2) Nomenclature des
 Les alcanes exercices corrigés
Les alcanes exercices corrigés
Exercices corrigés sur les alcanes première s pdf. Cours et exercices corrigés sur les alcanes pdf. Les alcanes exercices corrigés pdf 1ère l2. Cette page
 Exercices résolus - de chimie organique - Les cours de Paul Arnaud
Exercices résolus - de chimie organique - Les cours de Paul Arnaud
Il y a donc un atome d'hydrogène en trop par rapport au maximum autorisé. • C2H2Cl6. Formule moléculaire de l'alcane à deux atomes de carbone : C2H6. 6.
 THÈME : CHIMIE ORGANIQUE TITRE DE LA LEÇON : QUELQUES
THÈME : CHIMIE ORGANIQUE TITRE DE LA LEÇON : QUELQUES
La nomenclature des alcools est semblable à celle des alcanes : le ''e'' final du nom de l'alcane Il s'agit d'une réaction ménagée parce qu'elle conserve le ...
 Première A
Première A
14 févr. 2020 Nommer les alcanes suivants. 2-methylbutane. 3-ethyl-2-methylpentane ... A la fin de la séance du cours de chimie sur les alcanes votre ...
 THEME: CHIMIE ORGANIQUE TITRE DE LA LEÇON
THEME: CHIMIE ORGANIQUE TITRE DE LA LEÇON
8 oct. 2022 Écris l'équation-bilan de la combustion complète des alcanes. 2. Déduis la formule brute de l'alcane A. 3. Donne les formules semi-développées ...
 COURS DE CHIMIE ORGANIQUE
COURS DE CHIMIE ORGANIQUE
cour). 3-Les alcanes cycliques. On fait précéder le nom de l'alcane du terme « cyclo ». Exemples : (les exemples sont traités sur feuilles en cour). II - La ...
 cours de chimie organique(1)
cours de chimie organique(1)
cour). 3-Les alcanes cycliques. On fait précéder le nom de l'alcane du terme « cyclo ». Exemples : (les exemples sont traités sur feuilles en cour). II - La ...
 LES ALCANES
LES ALCANES
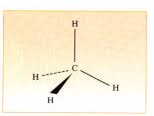
6. Modèle de Lewis : C. L'atome de carbone peut avoir 4 liaisons covalentes simples Les alcanes sont des hydrocarbures de formule brute CnH2n+2.
 Alcanes et alcools 1. Formules brute et semi-développée 2. Chaîne
Alcanes et alcools 1. Formules brute et semi-développée 2. Chaîne
SMARTCOURS » 1ère » Physique-Chimie » Chimie » Cours » Alcanes et alcools www.smartcours.com - ennoia © page 1/6. Alcanes et alcools. Objectifs.
 NOMENCLATURE EN CHIMIE ORGANIQUE 1. Hydrocarbures (HC
NOMENCLATURE EN CHIMIE ORGANIQUE 1. Hydrocarbures (HC
Hydrocarbures (HC) saturés acycliques : les alcanes S'il y a plusieurs fois le même groupe dans la molécule on utilise un préfixe : nb de substituants.
 RAPPELS DE CHIMIE ORGANIQUE DE 1ERE S
RAPPELS DE CHIMIE ORGANIQUE DE 1ERE S
On représente l'enchaînement des atomes de C par une ligne brisé qui représente les liaison simples entre les C. Chaque extrémité de segment comporte un
 Première A
Première A
Sur le chemin de l'école deux élèves de la 1ère A2 du Lycée Moderne 2 d'Agboville s'engagent
 Cours de chimie organique
Cours de chimie organique
Les 4 orbitaux « s » sphériques de 4 atomes d'hydrogène formant un système tétraédrique. Cette hybridation du carbone se retrouve dans tous les alcanes de
 ALCANES ET CYCLOALCANES 1- Définitions Les hydrocarbures
ALCANES ET CYCLOALCANES 1- Définitions Les hydrocarbures
Les noms des alcanes linéaires comportant un nombre d'atomes de carbone supérieur à alcane n alcane. 1 méthane. 6 hexane. 11 undécane. 16 hexadécane.
 COURS DE CHIMIE ORGANIQUE Semestre 2 SVI
COURS DE CHIMIE ORGANIQUE Semestre 2 SVI
II-6- Résumé des hybridations du carbone de l'azote et de l'oxygène Les alcanes sont des hydrocarbures saturés de formule brute CnH2n+2.
 PROPRIETES DES ALCANES ALCENES ET ALCYNES I
PROPRIETES DES ALCANES ALCENES ET ALCYNES I
L'équation –bilan générale de la combustion complète des alcanes s'écrit : Au cours de cette réaction les atomes de chlore ont successivement remplacé ...
 Untitled
Untitled
Cubier. Chapitre 6. ALCANES. Ce sont les constituants principaux des pétroles et du gaz naturel. Is sont encore appelés hydrocarbures saturés ou paraffines
 [PDF] LES ALCANES
[PDF] LES ALCANES
Les alcanes sont des hydrocarbures de formule brute CnH2n+2 Tous leurs atomes de carbone sont tétragonaux Le méthane CH4 est le plus simple des alcanes 2 2
 [PDF] RAPPELS DE CHIMIE ORGANIQUE DE 1ERE S - Physagreg
[PDF] RAPPELS DE CHIMIE ORGANIQUE DE 1ERE S - Physagreg
RAPPELS DE CHIMIE ORGANIQUE DE 1ERE S I Différentes formules chimiques pour une même molécule : Une molécule organique comportera donc une chaîne carbonée
 [PDF] TP cours Alcanes Alcools - Physique - Chimie
[PDF] TP cours Alcanes Alcools - Physique - Chimie
T P cours Alcanes Alcools Objectifs du TP: - Reconnaître une chaîne carbonée linéaire ramifiée ou cyclique - Nommer un alcane un alcool
 Nomenclature des alcanes et des alcools - Première - Cours - PDF à
Nomenclature des alcanes et des alcools - Première - Cours - PDF à
Cours de 1ère S - Nomenclature des alcanes et des alcools En chimie organique il existe de nombreuses familles de molécules
 Chap 2 Les Alcanes PDF Alcane Liaison chimique - Scribd
Chap 2 Les Alcanes PDF Alcane Liaison chimique - Scribd
Niveau : 1ère D OG 6 : COMPRENDRE LA STRUCTURE ET LES PROPRIETES DE CERTAINS COMPOSES ORGANIQUES TITRE : LES ALCANES Durée : 4 H Objectifs spécifiques :
 Chapitre 1 les alcanes Cours pdf
Chapitre 1 les alcanes Cours pdf
Cours Chapitre 1 les alcanes pdf Support de cours de chimie organique RAPPELS DE CHIMIE ORGANIQUE DE 1ERE S I Différentes formules chimiques pour
 [PDF] COURS DE CHIMIE ORGANIQUE Semestre 2 SVI
[PDF] COURS DE CHIMIE ORGANIQUE Semestre 2 SVI
II-6- Résumé des hybridations du carbone de l'azote et de l'oxygène Les alcanes sont des hydrocarbures saturés de formule brute CnH2n+2
 [PDF] cour-chimie-organique-S2-2017-2018pdf
[PDF] cour-chimie-organique-S2-2017-2018pdf
3 Isoméries : - Alcanes linéaires : isomérie de position et isomérie optique - Alcanes cycliques : isomérie cis-trans et isomérie optique
![[PDF] COURS DE CHIMIE ORGANIQUE Semestre 2 SVI [PDF] COURS DE CHIMIE ORGANIQUE Semestre 2 SVI](https://pdfprof.com/Listes/17/30405-17site-164-6e824e122565f6edd512da59c9167777-332650830.pdf.pdf.jpg)
UNIVERSITE CADI AYYAD
Faculté Polydisciplinaire
SafiDépartement de Chimie
COURS DE CHIMIE ORGANIQUE
Semestre 2
SVIPréparé par :
Moulay Rachid LAAMARI
2016-2017
SOMMAIRE
Chapitre I : INTRODUCTION A LA CHIMIE ORGANIQUE
I/ COMPOSES ORGANIQUES
II/ NATURE ELECTRONIQUE DES LIAISONS EN CHIMIE ORGANIQUEII-1- Orbitales atomiques (OA)
II-2- Valence du carbone
II-3- Hybridation du carbone
II-4- Liaisons covalentes
II-5- Comparaison entre sp3, sp2 et sp du carbone
II-6-Chapitre II : ECRITURE DES FORMULES ET FONCTIONS
EN CHIMIE ORGANIQUE
I/ ECRITURE DES FORMULES
I-1- Formule brute
I-2- Formule développée plane (FDP)
I-3- Formule semi-développée (FSD)
I-4- Formule simplifiée (FS)
II/ DIVERSES FONCTIONS ET GROUPEMENT FONCTIONNELS
II-1-II-2- Principales fonctions organiques
II-2-4- Fonctions tétravalentes
Chapitre III : PRINCIPALES REGLES DE NOMENCLATURE
DES COMPOSES ORGANIQUES
I/ NOMENCLATURE DES ALCANES ACYCLIQUES
I-1- Alcanes à chaîne linéaire
I-2- Alcanes à chaîne ramifiée
II/ NOMENCLATURE DES HYDROCARBURES ACYCLIQUES INSATURESII-1- Les alcènes : CnH2n
II-2- les alcynes : CnH2n-2
III/ NOMENCLATURE DES DERIVES HALOGENES (R-X)
IV/ NOMENCLATURE DES COMPOSES CYCLIQUES
IV-1- Les homocycles
IV-2- Les cycles aromatiques
IV-3- Les hétérocycles
V/ NOMENCLATURE DES FONCTIONS SIMPLES ET MULTIPLESV-1- Les alcools : R-OH
V-2- Les éthers (oxydes) : R-O-
V-3- Les amines
V-4- Les cétones : R-COR' avec R et R'
HV-5- Les aldéhydes : R-CHO
V-6- Acides carboxyliques : R-COOH
V-7- Dérivées des acides carboxyliques
VI/ NOMENCLATURE DES COMPOSES A PLUSIEURS FONCTIONSChapitre IV : ISOMERIE PLANE
I/ ISOMERIE DE CONSTITUTION
I-1-I-2- Isomérie de position
I-3- Isomérie de fonction
II/ ISOMERIE TAUTOMERIE
II-1-Tautomérie des aldéhydes et des cétonesII-2-Tautomérie des amides
II-3-Tautomérie des imines
Chapitre V : STEREOCHIMIE ISOMERIE CONFORMATIONNELLEI/ REPRESENTATION DES MOLECULES ACYCLIQUES
I-1- Molécule contenant un carbone sp3
I-2- Molécule contenant deux carbones sp3
I-3- Analyse conformationnelle des chaînes saturées aliphatiques II/ REPRESENTATON DES MOLECULES CYCLIQUES SATUREESII-1- Cyclopropane
II-2- Cyclobutane
II-3- cyclopentane
II-4- Cyclohexane
Chapitre VI : ISOMERIE OPTIQUE
I/ CHIRALITE
II/ MOLECULES CONTENANT UN SEUL CARBONE ASYMETRIQUEIII/ CONFIGURATIONS ABSOLUES R ET S
III-1- Règles de Cahn-Ingold et Prelog
III-2- Examen de la molécule
III-3- Projection de Fischer
IV/ Composés CONTENANT deux carbones asymétriques IV-1- Molécules possédant deux *C différents IV-2- Molécules possédant deux *C identiques CHAPITRE VII : ISOMERIE GEOMETRIQUE CISTRANS OU Z-EI/ ISOMERIE GEOMETRIQUE POUR LES ALCENES
I-1- ISOMERIE CIS-TRANS
I-2- ISOMERIE Z-E
II/ ISOMERIE GEOMETRIQUE CIS-TRANS POUR LES CYCLOALCANESII-1-DIMETHYLCYCLOBUTANE
II-2- DIMETHYLCYCLOHEXANE
CHAPITRE VIII : EFFETS ELECTRONIQUES
I/ EFFET INDUCTIF
I-1- E-I)
I-2-I-3- CONSEQUENCES DES EFFETS INDUCTIFS
II/ CONJUGAISON ET AROMATICITE
II-1- CONJUGAISON
II-2- AROMATICITE
III/ EFET MESOMERE
III-1- EFFET MESOMERE ATTRACTEUR (-M)
III-2- EFFET MESOMERE DONNEUR (+M)
Chapitre I : INTRODUCTION A LA CHIMIE ORGANIQUE
I/ COMPOSES ORGANIQUES
Les composés organiques sont des composés qui contiennent essentiellement du carbone sauf le monoxyde de carbone (CO), le dioxyde de carbone (CO2), les carbonates (K2CO3, Na2CO3, NaHCO3), les cyanures (KCN, NaCN), le dissulfure (CS2) et les carbures (CaC2) qui sont des composés inorganiques. Les composés organiques sont formés de liaisons covalentes. Ils sont rarement soluble dans l'eau et se décomposent facilement par la chaleur.Leurs densités sont voisines de l'unité.
II/ NATURE ELECTRONIQUE DES LIAISONS EN CHIMIE ORGANIQUE Pour décrire la nature des liaisons C-C et/ou C-H, on utilise la notion dépendent des nombres quantiques n, l et m (voir cours de chimie généraleI S1).
n : nombre quantique principale n>0, il détermine la distance moyenne entre l : 0< l < n, nombre quantique secondaire ou azimutal, il définit la sous couche, l = 0 orbitale s l = 1 orbitale p, etc. m : -l < m < l, nombre quantique magnétique, il définit la case quantique, à un niveau l correspond (2l + 1) valeurs (cases) de m.II-1- Orbitales atomiques (OA)
y a une grande proba organique sont s et p.II-1-1-
de la classification périodique des éléments. Il a sa couche externe à moitié remplie. Pour compléter sa couche périphérique, il pourra se lier à lui mêmeH He
Li Be B 6C N O F Ne
Na Mg Al Si P S Cl Ar
Le numéro atomique du carbone est 6 par conséquent sa structureélectroniques est 1s22s22p2.
II-1-2- Formes des OA du carbone
O. s y z x -1, 0, 1) correspond à 3 orbitales px, py et pz. Ces dernières ont chacune deux lobes et leurs axes de symétrie respectifs Ox, Oy et Oz sont perpendiculaires entre eux.Remarque: Le noyau se tr
II-2- Valence du carbone
r avec La configuration électronique externe du carbone à l'état fondamental est 2s22p2.2p22s2
Cette valence (VC = 2) permet la formation des molécules instables car la couche périphérique du carbone est incomplète (6e-, il faut 8e-).Exemple : CCl2
Octet (8e- sur la couche externe), le carbone
doit faire 4 liaisons donc il doit avoir 4 électrons célibataires sur sa couche externe (VC = 4). Pour cela, le carbone doit être dans un état excité c-à-d un électron de la sous couche 2s passe à la sous couche 2p.2p22s22p32s1
Excitation
Etat fondamentalEtat excité
Exemple : CH4 (8e- autour du carbone donc sa couche périphérique est saturée).Cette hypothèse tétravalence du
carbone (VC = 4) mais non pas sa géométrie qui se traduit parII-3- Hybridation du carbone
Une combinaison linéaire des OA conduit aux orbitales dites orbitales hydrides (OH) spatialement et énergétiquement équivalentes entre elles.2px 2py 2pz2s1
Etat excité
Par des différentes combinaisons linéaires des OA du carbone, on peut avoir3, sp2 et sp.
II-3-1- Hybridation sp3
re que les quatre liaisons C-H du méthane (CH4) sont identiques et indiscernables. Chacune forme avec les trois autres le même 2py et 2pz) du carbone subissent une combinaison linéaire pour donner 4 orbitales hybrides (OH). Cette combinaison met en jeu une orbitale s et 3 orbitales p pour conduire à quatre orbitales hybrides sp3 équivalentes.1 s+3 p4 sp3(4 OH)
px y z x pypz109°28'
sp3sp3 sp3 sp3 s Le carbone hybridé sp3 possède une géométrie tétraédrique.Remarque
II-3-2- Hybridation sp2
La combinaison linéaire met en jeu une orbitale s et deux orbitales p pour conduire à trois orbitales hybrides sp2 équivalentes dont leurs axes de inchangée et son axe de symétrie est perpendiculaire au plan des axes des orbitales hybrides sp2.1 s+2 p3 sp2(3 OH)
z pz120°
sp2 sp2 sp2 Le carbone hybridé sp2 possède une géométrie triangulaire.II-3-3- Hybridation sp
Elle met en jeu une orbitale s et une orbitale p pour conduire à deux orbitales hybrides sp dont les axes forment un angle de 180° et sont confondus. Les deux autres orbitales atomiques p (py et pz) restent naturelles et sont perpendiculaires aux deux orbitales hybrides sp.1 s+1 p2 sp(2 OH)
py pz spsp Le carbone hybridé sp possède une géométrie linéaire.II-4- Liaisons covalentes
Le carbone, situé sur la colonne centrale de la classification périodique, peut se lier à peut se lier à lui même, aux éléments de la mê des liaisons covalentes et . Une liaison covalente vient du recouvrement axial de deux orbitales hybrides (sp, sp2, sp3) dans le cas de la liaison C- et une orbitale s dans le cas de la liaison C-H. Une liaison covalente vient du recouvrement latéralII-4-1- Recouvrement axial
par rapport à ce même axe. Il aboutit à la formation de liaison covalente .Exemple 1 : méthane CH4 (4)
sp3sp3 sp3 sp3 s Csp3H HH H109°28'
La géométrie de CH4est tétraédrique
C H H H H +4H Conclusion : Un atome de carbone entouré de 4 liaisons est hybridé en sp3.Exemple 2 : éthane CH3-CH3
Chaque carbone est entouré de 3 liaisons (C-H) et une liaison (C-C). HH HH HHRecouvrement axial
Csp3Csp3
6H Le recouvrement axial C-C ié par rotation de la molécule autour de la liaison C-C; il y a la libre rotation autour de la liaisonII-4-2- Recouvrement latéral
Exemple 1 : éthylène CH2=CH2
pz' sp2sp2 sp2 pz sp2 sp2 sp2Recouvrement axial
Recouvrement latéral
H H Hquotesdbs_dbs30.pdfusesText_36[PDF] alcane groupe caractéristique
[PDF] alcane ramifié
[PDF] oxydation des alcools exercices corrigés
[PDF] taux de sulfate dans l'eau
[PDF] teneur en sulfate dans les sols
[PDF] écrouissage isotrope et cinématique
[PDF] écrouissage isotrope linéaire
[PDF] comportement non linéaire des matériaux
[PDF] la chine et l'afrique un nouveau partenariat pour le développement
[PDF] relation chine afrique
[PDF] la chine en afrique : enjeux et perspectives
[PDF] la chine populaire et l afrique
[PDF] la chine en afrique menace ou opportunité pour le développement
[PDF] présence chinoise en afrique
