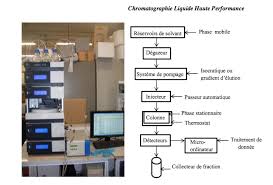
 4. CHROMATOGRAPHIE LIQUIDE
4. CHROMATOGRAPHIE LIQUIDE
• la chromatographie de partage est la technique de chromatographie liquide la plus chromatographie en phase inverse. • 4 solvants sont utilisés pour ...
 LES CHROMATOGRAPHIES
LES CHROMATOGRAPHIES
La chromatographie de partage fonctionne par partage de solutés entre deux phases non La chromatographie sur colonne présente plusieurs inconvénients :.
 TECHNIQUES: Principes de la chromatographie
TECHNIQUES: Principes de la chromatographie
La chromatographie d'adsorption est basée sur le partage des solutés entre l'adsorbant solide fixe et la phase mobile. Chacun des solutés est soumis à une force
 Extraction et séparation de la chlorophylle
Extraction et séparation de la chlorophylle
Il servira à la chromatographie de partage sur colonne. On obtient de la chlorophylle pure collée au fond de l'Erlenmeyer. • Resolubiliser la chlorophylle
 Amélioration instrumentale de la chromatographie de partage
Amélioration instrumentale de la chromatographie de partage
3 mai 2018 Pour cela nous proposons d'introduire la chromatographie liquide-liquide ou chromatographie de partage centrifuge dont le principe sera décrit ...
 Les techniques Chromatographiques 1.1. Introduction 1.3. Historique
Les techniques Chromatographiques 1.1. Introduction 1.3. Historique
La chromatographie de partage : C'est une chromatographie liquide-liquide. D. 2. Le Principe de la chromatographie d'exclusion. Cette technique permet la ...
 APPLICATIONS DE LA CHROMATOGRAPHIE DE PARTAGE SUR
APPLICATIONS DE LA CHROMATOGRAPHIE DE PARTAGE SUR
guide dans son isolement par Chromatographie de partage sur colonne d'ami- don. La figure 6 reproduit le chromatogramme en deux dimensions (réalisé. Page 17
 Master de lInstitut Supérieur des Sciences Agronomiques
Master de lInstitut Supérieur des Sciences Agronomiques
Chromatographie de partage centrifuge (CPC). 2.1. Principe. La Chromatographie de partage centrifuge est une technique de chromatographie liquide-liquide sans
 CHROMATOGRAPHIE LIQUIDE - Académie des Sciences et Lettres
CHROMATOGRAPHIE LIQUIDE - Académie des Sciences et Lettres
Représentation schématique des interactions mises en jeu dans la chromatographie en phase inverse. Le coefficient de distribution (ou coefficient de partage)
 GRADIENT DE POLARITE EN CHROMATOGRAPHIE DE
GRADIENT DE POLARITE EN CHROMATOGRAPHIE DE
de partage de BERGSTR~I
 [PDF] TECHNIQUES: Principes de la chromatographie - Eli Zysman-Colman
[PDF] TECHNIQUES: Principes de la chromatographie - Eli Zysman-Colman
La chromatographie d'adsorption est basée sur le partage des solutés entre l'adsorbant solide fixe et la phase mobile Chacun des solutés est soumis à une force
 [PDF] La chromatographiepdf
[PDF] La chromatographiepdf
Principe La chromatographie repose sur l'entraînement d'un échantillon dissous par une La phase stationnaire en chromatographie de partage doit être
 [PDF] NOTIONS FONDAMENTALES DE CHROMATOGRAPHIE
[PDF] NOTIONS FONDAMENTALES DE CHROMATOGRAPHIE
On distingue deux types de chromatographie: sur colonne et planaire CLPgreffée Groupemt lié chimiquement à un gel Partage entre liq et surface
 [PDF] 1 Définition 2 Buts de la chromatographie 21 Objectif analytique
[PDF] 1 Définition 2 Buts de la chromatographie 21 Objectif analytique
C'est une méthode de séparation non destructrice en son principe substrat agissant par partage (chromatographie liquide - liquide : CLL)
 [PDF] CHROMATOGRAPHIE - AC Nancy Metz
[PDF] CHROMATOGRAPHIE - AC Nancy Metz
Chromatographie en phase gazeuse (CPG): Le principe de la séparation par C P G consiste à partager l'échantillon à analyser entre deux phases L'une de ces
 [PDF] Chromatographie - L3 Chimie Dijon
[PDF] Chromatographie - L3 Chimie Dijon
Le principe repose sur l'équilibre de concentrations des composés présents La chromatographie liquide-liquide (CLL) ou chromatographie de partage :
 [PDF] LES CHROMATOGRAPHIES
[PDF] LES CHROMATOGRAPHIES
la chromatographie de partage (LLC GLC) lorsque la phase stationnaire est un imprègne un support en principe inerte ou est greffée par liaison
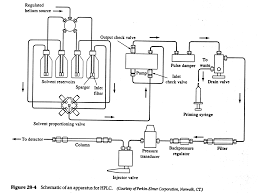
 [PDF] HPLC Principe et appareillage
[PDF] HPLC Principe et appareillage
20 jan 2010 · La chromatographie permet la séparation ou la purification d'un ou de rapport à l'équilibre est appelé coefficient de partage K
 [PDF] LES CHROMATOGRAPHIES
[PDF] LES CHROMATOGRAPHIES
La chromatographie de partage fonctionne par partage de solutés entre deux phases non miscibles ; l'une mobile et l'autre stationnaire La phase stationnaire
 [PDF] 4 CHROMATOGRAPHIE LIQUIDE
[PDF] 4 CHROMATOGRAPHIE LIQUIDE
La chromatographie de partage convient très bien à la séparation de molécules très polaires de masses moléculaires inférieures à 3000 et aux homologues d'une
 cours sur le chapitre 3: Chromatographie de partage
cours sur le chapitre 3: Chromatographie de partage
Principe de la chromatographie de partage La phase stationnaire et la phase mobile sont liquides Elle est basée sur la différence de solubilité du soluté
 [PDF] La chromatographiepdf
[PDF] La chromatographiepdf
Principe La chromatographie repose sur l'entraînement d'un échantillon dissous par une La phase stationnaire en chromatographie de partage doit être
 [PDF] TECHNIQUES: Principes de la chromatographie
[PDF] TECHNIQUES: Principes de la chromatographie
La chromatographie d'adsorption est basée sur le partage des solutés entre l'adsorbant solide fixe et la phase mobile Chacun des solutés est soumis à une force
 [PDF] [PDF] Cours de Chromatographie
[PDF] [PDF] Cours de Chromatographie
Chromatographie gazeuse : principe et appareillage Adsorption ? Partage ? Paires d'ions ? Échange d'ions ? Exclusion stérique
 Chromatographie de partage - Wikipédia
Chromatographie de partage - Wikipédia
La chromatographie de partage est une méthode de séparation de molécules par chromatographie suivant leur migration/répartition différentielle dans deux
 La chromatographie Planet-Vie
La chromatographie Planet-Vie
15 mai 2012 · La chromatographie de partage en phase gazeuse utilise comme principe de séparation le partage différentiel des molécules à séparer dans les
 [PDF] Chapitre 2 : Chromatographie - opsuniv-batna2dz
[PDF] Chapitre 2 : Chromatographie - opsuniv-batna2dz
? Le principe de la chromatographie consiste à entrainer l'échantillons à l'aide d'un éluant (gazeux ou liquide) appelé phase mobile (PM) qui se déplace au
 [PDF] Chromatographie - L3 Chimie Dijon
[PDF] Chromatographie - L3 Chimie Dijon
Principe : Le principe repose sur l'équilibre de concentrations des composés présents entre deux phases en contact : la phase stationnaire et la phase
Quel est le principe de la chromatographie de partage ?
La chromatographie de partage en phase gazeuse utilise comme principe de séparation le partage différentiel des molécules à séparer dans les deux phases stationnaires et mobiles.15 mai 2012Quel est le principe de la chromatographie ?
La chromatographie est une méthode physico-chimique qui sert à séparer les différentes substances présentes dans un mélange (échantillon en phase homogène liquide ou gazeuse).Quel est le principe CCM ?
Principe. ? Une CCM, c'est quoi ? Il s'agit d'une technique d'analyse qui s'appuie sur les différences d'affinités de substances chimiques entre une phase fixe, la plaque, et une phase mobile, l'éluant. Cette différence va permettre la séparation de ces différentes substances sur la plaque.- La CCM se déroule en trois étapes : préparation de la cuve, préparation de la plaque, et élution. Un cuve de chromatographie se compose de la cuve et d'un couvercle.
![[PDF] NOTIONS FONDAMENTALES DE CHROMATOGRAPHIE [PDF] NOTIONS FONDAMENTALES DE CHROMATOGRAPHIE](https://pdfprof.com/Listes/17/30888-17chromato1.pdf.pdf.jpg)
NOTIONS NOTIONS
FONDAMENTALESFONDAMENTALES
DE DECHROMATOGRAPHIECHROMATOGRAPHIE
MariePaule Bassez
http://chemphys.ustrasbg.fr/mpbPLAN1. Introduction
2. Grandeurs chromatographiques
2.1 Rapport de distribution K du soluté 2.2 Thermodynamique de la chromatographie
2.3 Temps de r
étention du soluté2.4 Facteur de r
étention2.5 Facteur de s
électivité ou de séparation2.6 Courbe de Gauss 2.7 Résolution des pics2.8 La th
éorie des plateaux2.9 La th
éorie cinétique2.10 Exemple d'application
Bibliographie
1. Introduction
La chromatographie est une technique analytique qui permet de séparer les constituants d'un mélange homogène liquide ou gazeux. On distingue deux types de chromatographie: sur colonne et planaire.
ou stationnaire ou éluantou phase mobile mélange à s
éparerUne colonne est remplie avec une
phase stationnaire ou fixe.Une phase mobile, ou solvant
organique (ou mélange de solvants) ou é
luant, est introduite au sommet de la colonne et entraîne les constituants (ou solut
és) du mélange. Le solvant entra
îne les molécules de solut
és. Il existe une série de transferts entre les 2 phases.Les constituants du m
élange migrent avec des vitesses diff
érentes. Ils sont
élués (déplacés) et recueillis s
éparément, en solution dans la phase mobile, dans un détecteur de concentration.
Un chromatogramme pr
ésente des pics en fonction du temps.
Fig.Chromatographie
d'élution sur colonneou détecteur détecteurFig. Séparation des constituants d'un
mélange par chromatographie
d'élution sur colonne. Ref. D.A. Skoog et http://www.unige.ch/cabe/chimie_anal/chromato.pdf
Classement des méthodes de chromatographie sur colonne1. La chromatographie en phase liquide, CPL: la phase mobile est un liquide.
2. La chromatographie en phase gaz, CPG: la phase mobile est un gaz.
3. La chromatographie en fluide supercritique, CFS: P. M. = fluide supercritique.
Chromatographie en phase liquide
phase stationnairetype de séparationCLL Liquide fix
é sur un solide Partage entre liquides non misciblesCLPgreff
ée Groupemt org. lié chimiquement à un gel Partage entre liq. et surface grefféeCLSSolide ou gel Adsorption
CLG Liq. ds les pores d'un gel de polym
ère réticulé Partage/Tamisage(sieving) (Chr. liquidegel; perm éation; size exclusion)C.Ionique Polym ère organique réticulé greffé Echange d'ionsC.Affinit
é Support greffé porteur d'ions (IMAC) Liaison donneuraccepteurElectroC gel de silice ou polym
ère organ. greffé Mobilité ds champ électr.2. Grandeurs chromatographiques
2.1 Rapport de distribution K du soluté(rappel: soluté= corps minoritaire dans un solvant; corps simple = entité moléculaire formée d'atomes identiques: ex. O2; corps compos
é = entité moléculaire formée d'atomes différents: H2O; corps pur = corps form é d'entités moléculaires identiques ).Les séparations chromatograph. sont basées sur la répartition des solutés dans deux phases: solut
é A (phase mobile) ↔ soluté A (phase stationnaire)La constante d' équilibre de cette réaction est appelée: rapport de distribution KC'est le terme recommand
é par l'UICPA ( Union Internationale de Chimie Pure et Appliqu ée) depuis 1993 au lieu de constante de distribution, coefficient de distribution et coefficient de partage encore utilisés.K est
égal au rapport des concentrations du soluté A dans les deux phases:KA = [A]stat / [A]mob [A]stat = concentration en mol.L1 du soluté dans la phase stationnaire = [A]S
ou [A]org conc. dans la phase organique greff ée sur un support.[A]mob = ......phase mobile = [A]M2.2 Thermodynamique de la chromatographie
Les relations de la thermodynamique s'appliquent aux équilibres de distribution. solut é A (phase mobile) ↔ soluté A (phase stationnaire)KA = [A]stat / [A]mobΔG° = RT. ln K
ΔG° =
ΔH° TΔS°
de la valeur de K on déduit ΔG°, ΔH° et TΔS°
Les trois fonctions sont < 0. La r
éaction est spontanée. ΔS° <0 : l'entropie diminue quand le constituant quitte la phase mobile pour se
fixer sur la phase stationnaire.Equation de van't Hoff: dlnK / dT =
ΔH° / RT2
permet de calculer l'effet de la température sur le temps de rétention.
tR tM temps signal du détecteur 2.3 Temps de rétention du solutéFig. Courbe d'
élution ou Chromatogramme d'un mélange à 2 constituantsLe pic de gauche correspond au solut é qui n'est pas retenu par la phase stationnaire et qui atteint le détecteur à la même vitesse que celle de l'éluant. Son temps de rétention tMest le temps n
écessaire pour qu'une molécule de la phase mobile traverse la colonne. tM=temps mort = t0 = temps nécessaire pour que le pic d'un constituant non retenu par la PS apparaisse (retention time of an unretained peak or solvent front).
tR = temps de r étention d'un constituant retenu par la PS (retained peak) = temps écoulé entre l'injection et le moment où le constituant sort de la colonne. t'R = tR tM = temps de rétention réduit ou corrigé (adjusted retention time) v = L / tR = vitesse moyenne de d éplacement du soluté (L=longueur de la colonne) u = L / tM = vitesse moyenne des molécules de la phase mobile (cm.s1).
v = u.f (fraction de temps passé par le soluté dans la phase mobile) VM = V0 = volume de la PM dans la col. = vol. interstitiel accessible (=vol. mort).
Il est mesur
é par introduction d'un soluté non retenu par la PS. VM = tM . D D est le d ébit de la phase mobile (flow rate) c'est un volume par unité de temps: cm3.s1 ou mL.s1
u = D / S (S= section de la colonne) ( cm3.s1/cm2). VS = volume de la PS = V (colonne vide) VM VR = volume d' élution ou de rétention du soluté = volume de la PM nécessaire pour entraîner le soluté jusqu'à la sortie de la colonne = V (P.M.) qui s'est écoulé entre le moment de l'injection et celui correspondant au sommet du pic. VR = tR . D
V'R = VR V0 = volume de r étention réduit du soluté (adjusted retention volume)Rem. d
éfinition du débit: quantité d'une grandeur, ici le volume, par unité de temps. d ébit d'information = quantité d'information transmise par unité de temps: baud=bit.s1 à 13,5% de la hauteur D'apr ès PRW Scott, Principle and Practice of Chromatography online textbook2 .4 Facteur de rétention
Un composé de masse mT se répartit en mM dans la phase mobile et mS dans la phase stationnaire. Si les conditions op ératoires ne changent pas, mM et mS restent constantes au cours de la migration dans la colonne. Leur rapport est indépendant de mT. Il est appelé facteur de r
étention (recommandé par UICPA) plutôt que facteur de capacité. Ce n'est pas une constante.
k'A = mS / mM = CS. VS / CM. VM = KA . VS / VM avec le rapport de phase = VM /VS : KA = . k'ASi K = 0, le solut
é migre aussi vite que le solvant; si K = ∞ le soluté reste sur la colonne.On d émontre: k'A = (tR tM ) / tM = t' R / tM (donc KA = . t'A / tM) rem. (2tMtM) / tM = 1 donc si tR < 2tM alors k'A < 1;élution très rapide, difficile à étudier. si k'A > 20 ou 30; dur
ée d'élution très longue.En HPLC, la s
éparation est optimale pour 2 < k' < 10 afin que le temps de passage des constituants ne soit pas trop long; k'=5=valeur "idéale". Le facteur de r
étention exprime mathématiquement la capacité plus ou moins grande de la colonneà retenir chaque constituant.
2.5 Facteur de sélectivité ou de séparation
= KB / KA = rapport de distribution du constituant B le plus retenu sur le rapport de distribution du constituant A le moins retenu (1er pic). KB = [B]S / [B]M et est toujours > 1 k'A = KA . VS / VM k'B = KB . VS / VM donc: KB / KA = k'B / k'A et = k'B / k'A = [(tR(B) tM) / tM ] . [tM / (tR (A) tM ) ] = t'R (B) / t'R (A) Le facteur de sélectivité exprime la position relative de 2 pics sur le chromatogramme. pour le solut é A: KA = [A]S / [A]M et ΔGA° = RT. ln KA enthalpie libre de dissolution du soluté A dans la phase stationnairepour le solut
é B: KB = [B]S / [B]M et ΔGB° = RT. ln KBΔGB° Δ
GA° = RT . (ln KB ln KA) = RT . (ln KB / KA) = RT . lnΔGB° Δ
GA° = RT . ln
= KB / KA = exp (ΔGA° ΔGB° ) / RT temps (min)tM4tR(A)
14tR(B)
19 facteur de rétention: k'A = (tR tM) / tM = t'R / tM = 10/4 = 2,5 k'B = 15/4 = 3,75 facteur de s électivité ou de séparation: = t'R (B) / t'R (A) = 3,75 / 2,5 = 1,5exemple tR tMexemple2.6 Courbe de Gauss
La largeur d'une courbe de Gauss est définie par ,,: écarttype = ½ largeur du pic à la hauteur des points d'inflexion, à 60,6% de la hauteur. = 2,35 = largeurà mihauteur = 4 =
1,7 = largeur mesurée à 13,5% de la hauteur = largeur à la base du picLes pics chromatographiques ont une allure gaussienneL'aire des pics est calcul
ée en assimilant le pic à un triangle. Fig. Courbe de Gauss du site: http://www.acnancymetz.fr/enseign/physique/CHIM/Jumber/Chromato/Chromato_gen.htm2.7 Résolution des pics
Facteur de résolution: R = 2 [tR (B) tR(A)] / [ (B) + (A)] Effet des facteurs de s
électivité et de rétention sur la résolution: R =[(N1/2 / 4 )] . [( 1) / ]. [k'B / (1 + k'B )] (1)
efficacit é sélectivité rétention Efet de R sur le temps de r étention: tR(B) = (16R2H/u).[ /( 1)]2. [(1+k'B)3/k'B2 ] (2) on d éduit: R1 / R2 = (N1/N2)1/2 et tR1(B) / tR2(B) = R12 / R22Une bonne s
éparation est un compromis entre une résolution suffisante des pics et un temps de s éparation raisonnable. tR (A) tR (B)La résolution est la grandeur qui caractérise l'aptitude d'un système chromatographique (colonne, solut
és, solvants) à séparer 2 solutés. Le but de la chromatographie est d'obtenir la meilleure r
ésolution dans le temps le plus court.Fig. S
éparation de 2 pics adjacentsLes pics sont r
ésolus pour R = 1,5
fig. d'après D.A. Skoog et http://www.unige.ch/cabe/chimie_anal/chromato.pdf. Fig. Effet du facteur de r
étention k'B sur le facteur de résolution R et sur le temps de rétention tR(B) k'B (sans unit
é)R/Q et tR(B)/Q'R/Q
tR(B)/Q' Leséquations 1 et 2 précédentes peuvent être réarrangées:R = Q. k'B / (1+k'B ) et tR(B) = Q' (1+k'B)3 / k'B2
Les courbes ont
été tracées avec Q et Q' cts. C'est l'influence de k' qui est évaluée indépendamment des autres termes. Il faut remarquer toutefois que Q' varie avec R. Rem. Les valeurs de k'B > 10 correspondent
à une faible augmentation de la résolution pour un temps de séparation plus long. Il vaut mieux les éviter. Les séparations sont optimales en général pour 2 < k'B< 10. En CPL, k' peut varier avec une modification de la composition du m
élange de solvants (en CPG avec la temp
érature). minimum k'B =2
Fig. Effet de la modification de la composition du solvant sur la séparation des solutés D'apr
ès D.A.Skoog et http://web.uconn.edu/rusling/StuartLC3.pdftR (min)c) est le meilleur chromatogramme :
bonne résolution et temps plus petit qu'en d)
tRa) Les conditions de l'expérience permettent aux pics 1 et 2 d'avoir une résolution optimale, avec des facteurs de r
étention 2 éparer les pics, il est parfois possible de faire varier les conditions expérimentales au cours de l' élution: au début de l'élution les conditions sont celles qui conduisent au chromatogramme a, apr ès apparition des pics 1 et 2, les conditions sont changées pour devenir celles optimales pour 3 et 4 (c) puis de nouveau chang Fig. Effet de la longueur d'une colonne CPG sur la résolutionModification de la longueur de la colonne capillaire: en doublant L, R est multipli étrique de la grandeur étudiée (nbre de molécules) de part et d'autre d'une valeur moyenne. Les mol écules subissent de très nombreux transferts entre la phase mobile et la phase stationnaire. Elles ont des comportements individuels éplacement dans la colonne et cela se répercute dans la largeur du pic du chromatogramme en fonction du temps. équilibres successifs qu'a rencontré un soluté. + N grand, + la colonne est efficace et + le pic est fin. éoriques exprime l'efficacité de la colonne.tableau: HEPT pour chromato CPG et CPL (master chimieParis Sud)cm2 C'est une description mathématique pour comprendre la forme des pics. Les 3 termes A, B et C contribuent é à l'anisotropie d'écoulement; dépend de la taille et de la répartition des particules de la PS.La largeur de la bande d écules de soluté arrivent en sortie de colonne à des instants différents. C'est le phénomène de diffusion turbulente.é écule 1. 1 arrive en B avant 2. Le trajet dépend du diamètre des particules qui remplissent la colonne. écules de soluté diffusent des régions les plus concentrées vers les plus diluées. Elles se dispersent dans toutes les directions, d'autant plus que le d ébits convenables avec des microparticules de 2 à 5 μm de diamètre. De bonnes s éparations sont ainsi obtenues en CLHP. (diffusion= quand une grandeur change de direction; ex. transfert de mati = terme de résistance au transfert de masse du soluté entre les deux phases. Le transfert de mol loignées de la PS peuvent être entraînées avant d'être transférées sur la PS. Le terme C devient important quand la vitesse d' épaisseur moyenne de la couche de PS déposée sur les particules du support solide. DS = coefficient de diffusion du solut é dans la phase stationnaireCM , terme de transfert de masse dans la phase mobile; est proportionnelésolus.c) 3 et 4 sont r
ésolus mais pas 12 ni 56.Pour bien s
éparation d'un m
élange complexes de 6
constituants d'apr ès D.A. Skoog et www.unige.ch.....
é par ⎷2 F. et A.Rouessac et soci
été Waters et http://www.unige.ch/cabe/chimie_anal/chromato.pdf 2.8 La théorie des plateaux
Elle est utilisée pour expliquer la forme des pics.En 1941, Martin et Synge ont consid éré la colonne de chromatographie comme une colonne de distillation, constitu ée de " plateaux théoriques ». Au niveau de chaque plateau, l' équilibre est réalisé entre les deux phases. Il y a é change de matière horizontalement, jusqu'à ce que KA = [A]stat / [A]mob soit atteint. Il n'y a pas d' échange vertical. En fait cet
état d'équilibre ne peut jamais
être atteint en présence d'une phase mobile en mouvement continu. La th éorie des plateaux est de plus en plus remplac ée par la théorie cin
étique. http://www.unige.ch/cabe/chimie_anal/chromato.pdf [ Description qualitative des pics chromatographiques Les pics d'un chromatogramme ont une allure de courbe de Gauss représentant une distribution sym éculesd'apr
ès D.A. SkoogLFig. Distribution des mol
écules dans la colonne au temps tR, quand le solut é atteint la sortie de la colonne.
L] Hauteur équivalente à un plateau théorique, définie par: H (cm) = 2 L/L = HEPT
Nombre de plateaux th
éoriques = L / H donc N = L2 / 2
L tR et sont dans le m ême rapport que L et L :
N = tR2 /
2 = tR2/( /4)2=16 tR2 / 2= 5,54. tR2 / 2 Nombre de plateaux th
éoriques effectifs, ou efficacité réelle: Neff = t'R2 / 2 Ce nombre correspond au nombre d'
N est une grandeur caract
éristique d'un système chromatographique. Il peut être ↑ en r éduisant le débit de la PM, mais tR est aussi ↑. Hauteur de plateau effectif: Heff=L / Neff
Hauteur de plateau r
éduite: h=H/dp= L/(N.dp)
dp= diam ètre moyen des particules sphériques des colonnes; des colonnes ayant m ême L/dp ont des efficacités ou performances semblables. Le nombre de plateaux th 2.9 La théorie cinétique
Equation de van Deemter (1956): H = A + B/u + C.u A : li
écule 2 est supérieur à celui de la mol
ètre des particules. A gd si dp gd.
Plus les particules sont petites, plus le remplissage est homog ène, plus A petit et plus l'efficacit
é de la colonne augmente. La contribution de A est nulle pour une colonne capillaire de chromatographie en phase gaz. d'apr ès D.A. Skoog et http://www.unige.ch/cabe/chimie_anal/chromato.pdf B/u : terme de diffusion moléculaire longitudinale B/u = 2. DM inversement proportionnel à la vitesse d'écoulement de la phase mobile. B/u petit si u gd. L'efficacit é d'une colonne augmente avec la vitesse de la P.M. Les mol DM = coefficient de diffusion du solut
é dans la phase mobile (en cm2.s1). Il est 5 fois + gd en CPG qu'en CPL. La contribution de la diffusion longitudinale est consid érée comme n
égligeable en CLHP.
HEPT HEPT Fig. Courbes de van Deemter
Effet de la vitesse d'écoulement de la PM sur HEPTa) pour la CPL et b) pour la CPG. La pente est < 0 pour u faible. L'effet est plus important quand la PM est un gaz (car les coefficients de diffusion dans les gaz sont > ceux en phase liq.).a: CPL b: CPGH minimum u, vitesse d' écoulement cm.s1
u, vitesse d' écoulement cm.s1
D'apr ès D.A. Skoog et http://www.unige.ch/cabe/chimie_anal/chromato.pdf Principle and Practice of Chromatography RPW Scott, online textbook C.u = ( CS + CM). u écoulement (cm.s1) de la phase mobile
ou son d ébit (cm3.s1) est trop rapide. Cette résistance empêche la formation de l' équilibre: soluté dans PMsoluté dans PS.Plus u petit, plus les mol écules pénétrent dans la PS et plus la colonne est efficace. CS , terme de transfert de masse dans la phase stationnaire; est proportionnel à df2/ DS
df = à dp2/ DM
dp = diam ètre des particules de remplissage. DM = coefficient de diffusion du solut é dans la phase mobile.Les colonnes efficaces sont r égulièrement remplies, avec un dp le plus faible possible.quotesdbs_dbs29.pdfusesText_35
[PDF] chromatographie sur colonne
[PDF] avantages inconvénients chromatographie ionique
[PDF] electrophorese
[PDF] chromatographie d'exclusion
[PDF] chromatographie d'exclusion stérique polymère
[PDF] chromatographie gel filtration
[PDF] chromatographie d'exclusion stérique exercice
[PDF] chromatographie dexclusion exercice corrigé
[PDF] volume hydrodynamique
[PDF] chromatographie par perméation de gel (gpc)
[PDF] exercice chromatographie corrigé pdf
[PDF] qcm sur la chromatographie
[PDF] qcm chromatographie chimie analytique
[PDF] qcm chromatographie phase gazeuse
