La réaction doxydoréduction
La réaction doxydoréduction
Les halogènes (F2; I2; Cl2;. O2) sont de puissants oxydants. 1.5)Etablir la demi-équation d'un couple. On étudie dans cet exemple le couple MnO4.
 Correction de lexercice « Encre sympathique »
Correction de lexercice « Encre sympathique »
C'est l'oxydant du couple I2(aq) / I-(aq). L'acide ascorbique présent dans le b) (4 pts) Demi-équations d'oxydoréduction : )(2. 2)(. 2. aqI e. aqI. −. − = +.
 Les réactions doxydo-réduction
Les réactions doxydo-réduction
➔ Pour s'entraîner : « TS oxydoréduction demi équation ». 4/ Les réactions d'oxydoréduction. ➔ Le réducteur d'un couple (noté 1) peut participer à une
 CORRIGÉ
CORRIGÉ
1 août 2020 (1) et (2). C'est la même demi-équation pour le couple I2/I- qui intervient : ... 10- Écrire les demi-équations redox dans lesquelles ...
 Méthode : cas du couple Cr2O72-/Cr3 Applications Corrections
Méthode : cas du couple Cr2O72-/Cr3 Applications Corrections
Ecrire les demi-équations relatives aux couples Redox suivants : Cu2+/Cu. Fe2+/Fe. S4O6. 2–/S2O3. 2–. I2/I–. MnO4. –/Mn2+. O2/H2O2. Ag+/Ag. Fe3+/Fe. Corrections.
 école numérique - thème : oxydoréduction titre de la leçon : couples
école numérique - thème : oxydoréduction titre de la leçon : couples
L-1 en milieu acide. 1. Écris les demi- équations électroniques et l'équation- bilan. 2. Calcule la concentration en diiode I2 et en ions
 CM80 : Examen final — corrigé 1 Aspartame et neotame (667pts)
CM80 : Examen final — corrigé 1 Aspartame et neotame (667pts)
D'où la demi-équation redox : I2 + 2e– = 2I– . — couple RCHO/RCO2. – : n.o. (C/RCHO) = +I ; n.o. (C/RCO2. – ) = +III. D'où la demi-équation redox : RCO2. – +
 Chapitre 5 : diagrammes potentiel-pH (E-pH) et potentiel-pL
Chapitre 5 : diagrammes potentiel-pH (E-pH) et potentiel-pL
Oxydoréduction (entre des espèces de n.o. différents). Ecriture de la demi-équation rédox utilisation de la formule de. Nernst puis de la convention de
 Loxydoréduction
Loxydoréduction
La demi-équation est écrite pour les deux membres d'un même couple Ox / Red + 5.I2 + 16.HO- à gauche H+ + HO- donne H2O : 2.MnO4. - +16.H2O +10.I-. 2Mn.
 La réaction doxydoréduction
La réaction doxydoréduction
Soit le couple I2/I- (diiode/ion iodure) établir la demi-équation de ce couple : qui cède des électrons et l'oxydant d'un autre couple redox qui les.
 Correction de lexercice « Encre sympathique »
Correction de lexercice « Encre sympathique »
a) (1 pt) Le diiode I2 de couleur brune en solution aqueuse
 CORRIGÉ
CORRIGÉ
1 août 2020 C'est la même demi-équation pour le couple I2/I- qui intervient : ... 10- Écrire les demi-équations redox dans lesquelles interviennent les ...
 Exercice 29 p 131 : a) Équation de la réaction : Oxydation de S2O3
Exercice 29 p 131 : a) Équation de la réaction : Oxydation de S2O3
b) Il s'agit d'une réaction d'oxydoréduction car il a un échange d'électrons entre deux espèces (I2 l'oxydant et S2O3. 2- le réducteur). c) Volume de solution
 CM80 : Examen final — corrigé 1 Aspartame et neotame (667pts)
CM80 : Examen final — corrigé 1 Aspartame et neotame (667pts)
couple I2/I– : n.o. (I/I2) = 0 ; n.o. (I/I– ) = -I. D'où la demi-équation redox : I2 + 2e– = 2I– . — couple RCHO/RCO2. – : n.o. (C/RCHO) = +I ; n.o. (C/RCO2.
 cinétique de réaction du diiode oxydoréduction
cinétique de réaction du diiode oxydoréduction
On multiplie la demi-équation d'oxydation par le nombre d'électrons intervenant dans la demi- Equation bilan : 2 Fe3+ + 2 I- ? 2 Fe2+ + I2.
 LES THIOLS.pdf
LES THIOLS.pdf
L'équation bilan s'écrit : Les couples oxydant /réducteur présents sont : - Diiode / ion iodure : I2 / I-. Demi équation : I2 + 2 e- = 2I- (1).
 école numérique - thème : oxydoréduction titre de la leçon : couples
école numérique - thème : oxydoréduction titre de la leçon : couples
captant des électrons selon la demi-équation électronique : est un réducteur et ils forment le couple redox ... On donne les couples redox I2 I?.
 Les réactions doxydo-réduction
Les réactions doxydo-réduction
On décrit cette double possibilité par une « demi-équation » électronique : oxydant + n e- Pour s'entraîner : « TS oxydoréduction demi équation ».
 Loxydoréduction
Loxydoréduction
2) Établir l'équation en milieu acide
 Lecture 11 Redox Chemistry - Stanford University
Lecture 11 Redox Chemistry - Stanford University
Redox reactions are written as half-reactions which are in the form of reductions (which means an element is transformed from a higher oxidation state (e g +II) to a lower oxidation state (e g +I)): Ox + ne- = Red; Where the more oxidized form of an element is on the left and the reduced form is on the right n is the number of electrons
 7014 Redox Chemistry Handout - Massachusetts Institute of
7014 Redox Chemistry Handout - Massachusetts Institute of
There are three ways to represent a redox reaction; these are shown below with a representative biological redox reaction: acetaldehyde + NADH + H + ethanol + NAD + (1) Overall Reaction: (2) Electron-transfer diagram: acetaldehyde NADH + H + e-NAD + ethanol (3) Half-reactions: acetaldehyde + 2 H + + 2 e-ethanol + NADH NAD + + H + + 2 e-
 Balancing REDOX Reactions: Learn and Practice
Balancing REDOX Reactions: Learn and Practice
Apr 17 2013 · Here the equation is already written in an ionic equation format so we must do some more work to assign oxidation numbers (see ebook rules) ClO3¯ (aq) + I2 (s) à IO3¯ (aq) + Cl¯(aq) Oxidation Numbers: +5 -2 0 à +5 -2 -1 Yes the Iodine (I) has been oxidized and the Chlorine (Cl) has been reduced
 Oxidation- Reduction Chemistry - WRUV
Oxidation- Reduction Chemistry - WRUV
Half-Reactions ØConsider each process indivually: Oxidation Cu (s) ? Cu2+ (aq) + 2 e-Reduction [Ag+ + e-? Ag (s) ] x 2 Overall: Cu (s) + 2Ag+ (aq) ? Cu2+ (aq) + 2Ag (s) Oxidized (reducing agent) Reduced (oxidizing agent) 4 Balancing Redox Reactions Ø The Half-Reaction Method Three Steps: 1 Determine net ionic equations for both half
 Searches related to demi equation redox i2/i PDF
Searches related to demi equation redox i2/i PDF
During a REDOX reaction electrons are transferred directly from the reducer to the oxidizer with no separation of the two reactions • If we were able to isolate the half reactions into separate containers and connected the two containers electrically using platinum wire electrodes and a volt meter we could then measure that potential •
What are half-equations in a redox reaction?
These two equations are described as "eelectron-half-equations," "half-equations," or "ionic-half-equations," or "half-reactions." Every redox reaction is made up of two half-reactions: in one, electrons are lost (an oxidation process); in the other, those electrons are gained (a reduction process).
How do you determine the direction of a redox reaction?
Note: to determine the direction of a redox reaction, you do not need to use the Nernst equation. You only need to know the sign of ?E'?. you must reverse the sign of E'? for a reaction if you reverse the direction of the reaction. Here reaction (2) must be reversed.
What is a redox reaction?
Redox reactions are a major determinant of chemical species present in natural environments. Znº - 2e- Zn2+ (an oxidation half reaction, electrons lost) Cu2++ 2e- Cuº (a reduction half-reaction, electrons gained) The two species comprising half-reactions (e.g. Znº & Zn2+) are referred to as a “couple”.
Can a redox titration be applied to a mixture of analytes?
As with acid–base titrations, we can extend a redox titration to the analysis of a mixture of analytes if there is a significant difference in their oxidation or reduction potentials. Figure 9.42 shows an example of the titration curve for a mixture of Fe 2+ and Sn 2+ using Ce 4+ as the titrant.
 Cinétique de réaction du diiode / oxydoréduction Q1
Cinétique de réaction du diiode / oxydoréduction Q1 a) Un oxydant est une espèce chimique qui peut gagner un ou plusieurs électrons. Un réducteur
peut perdre un ou plusieurs électrons.Un couple d'oxydoréduction Ox/Red est constitué par un oxydant et son réducteur conjugué, liés
par une demi-réaction d'oxydoréduction :Ox + n.e-
Red Une réaction d'oxydoréduction met en jeu deux couples d'oxydoréduction :Ox1/Red1 et Ox2/Red2.
La réaction d'oxydoréduction peut s'écrire : a.Ox1 + b.Red2 c.Red1 + d.Ox2 b) Pour voir la vidéo clique ici.Méthode pour équilibrer une 1/2 équation de réduction (il s'agit de la même méthode pour
équilibrer une 1/2 équation d'oxydation).
* Conservation du nombre d'atomes de l'élément oxydé ou réduitCr2O72-
2 Cr3+
* Conservation du nombre d'atomes de l'élément oxygène par apport de molécules d'eau :Cr2O72-
2 Cr3+ + 7 H2O
* Conservation du nombre d'atomes d'hydrogène par apport d'ions H+ (car la réaction a lieu en milieu acide)Cr2O 72- + 14 H+
2 Cr3++ 7 H2O
* Conservation des charges électriques par apport d'électrons :Cr2O7 2- + 14 H+ + 6 e -
2 Cr3++ 7 H2 O
De la même manière la demi-réaction d'oxydation de l'éthanol est :C2H6O + H 2O
C2H4O2 + 4 H+ + 4 e-
On multiplie la demi-équation d'oxydation par le nombre d'électrons intervenant dans la demi-équation de réduction
(x 6) et inversement. On fait la somme des 2 demi-équations pour obtenir l'équation bilan.4 x (Cr2O7 2-+ 14 H+ + 6 e -
2 Cr3++ 7 H2O ) +
6 x (C2H6O + H2O
C2H 4O2 + 4 H+ + 4 e-)
4 Cr2O72- + 56 H+ + 24 e- + 6 C2H6O + 6 H2O
6 C2H4O2 + 24 H+ + 24 e- + 8 Cr3+ + 28 H2O
On simplifie l'équation bilan :
4 Cr2O7 2-+ 32 H+ + 6 C 2H6O
6 C2H4O2 + 22 H 2O + 8 Cr3+ ou en divisant chaque terme par 2 :
2 Cr2O7 2-+ 16 H+ + 3 C 2H6O
3 C2H4O2 + 11 H 2O + 4 Cr3+
c) Réponse partielle pour voir la vidéo clique ici.2 MnO4- + 6H+ + 5 H2C2O4
2 Mn2+ + 8 H2O + 10 CO2
Q2 a) 1/2 équation de réduction : S2O82- + 2 e-2 SO 42-
1/2 équation d'oxydation : 2 I-
I2 + 2 e-
Equation bilan (toutes les espèces sont en solution aqueuse) :S2O8 2- + 2 I-
2 SO42- + I2
b) Première équation :1/2 équation de réduction : ( Fe3+ + 1 e-
Fe2+ ) x 2
1/2 équation d'oxydation : ( 2 I-
I2 + 2 e- ) x 1
Equation bilan : 2 Fe3+ + 2 I-
2 Fe2+ + I2
Seconde équation :
1/2 équation de réduction : ( Fe2+
Fe3+ + 1 e-) x 2
1/2 équation d'oxydation : ( S2O82- + 2 e- = 2 SO 42- ) x 1
Equation bilan : 2 Fe2+ + S 2O82-
2 Fe3+ + 2 SO4 2-
En faisant la somme de la première et de la seconde équation, on obtient :2 Fe3+ + 2 I- + 2 Fe2+ + S2O82-
2 Fe 2+ + I2+ 2 Fe 3+ + 2 SO42-
On simplifie
S2O8 2- +2 I-
2 SO42- + I2
Les 2 réactions rapides sont identiques à la réaction lente en terme d'équation bilan ! Q3 a) Réponse partielle, pour voir la vidéo clique ici. xmax = 10-3 mol , le réactif en excès est le peroxodisulfate, celui en défaut est l'ion iodure. b) M (I) = 127 g.mol-1 La masse de diiode formée est : g 254,0)127x2(x10)I(M.x)I(M.)I(n)I(m32max2formé22
Q4 a) Ne pas oublier la dilution ! Le volume du mélange est maintenant V = V1+V2 = 0,3 L ! Concentrations initiales des ions iodure et peroxodisulfate, notées respectivement C10 et C20 : b) Il suffit de reprendre le tableau d'avancement et de diviser les nombres de moles par le volumeV =V1+V2 de solution !
Tableau d'avancement en concentrations (mol.L-1)
Etat du
systèmeAvancement S2O82- 2 I- 2 SO42- I2
État initial x = 0 C20 C10 0 0
1320 132
0
L.mol10.67,62,01,0
2,0.10
2V1V2V.2C2C
L.mol10.67,62,01,0
1,0.10.2
2V1V1V.1C1C
En cours x(t)
C20- x(t)/V C10- 2x(t)/V 2.x(t)/V x(t)/V
c) Concentrations molaires finales de toutes les espèces chimiques.Pour voir la vidéo clique ici.
Etat du
systèmeAvancement S2O82- 2 I- 2 SO42- I2
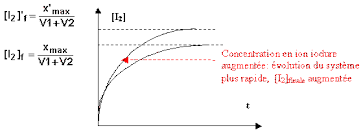
Etat final x = x(max) 3,33.10-3mol.L-1 0 6,67.10-3 mol.L-1 3,33.10-3mol.L-1 Q5 a) Allure de la courbe, si on augmente la concentration apportée en ion iodure dans la solution :2 différences importantes :
Plus la concentration des réactifs est importante, plus la vitesse de réaction est importante, et plus vite on atteint la valeur de l'avancement maximal. La concentration en ion iodure étant plus importante, l'avancement maximal est plusimportant, donc la concentration en diiode finale augmente par rapport à la première expérience.
b) On garde le mélange initial mais on diminue sa température (la réaction est considérée comme
athermique).Une différence :
Plus la température est faible, plus le système évolue lentement, plus la durée au bout de laquelle
xmax est atteint est importante. Remarque : La concentration finale de diiode est identique, xmax étant indépendant de la température.quotesdbs_dbs29.pdfusesText_35[PDF] potentiel standard cl2/cl-
[PDF] clo-/cl-
[PDF] couple redox clo-/cl-
[PDF] demi equation clo-/cl-
[PDF] hclo/cl2
[PDF] demi equation redox sn2+/sn
[PDF] couple redox dichlore
[PDF] claforan iv
[PDF] claforan dilution
[PDF] claforan posologie
[PDF] claforan per os
[PDF] claforan cp
[PDF] claforan dci
[PDF] claforan 1g