 La réaction doxydoréduction
La réaction doxydoréduction
Les halogènes (F2; I2; Cl2;. O2) sont de puissants oxydants. 1.5)Etablir la demi-équation d'un couple. On étudie dans cet exemple le couple MnO4.
 Correction de lexercice « Encre sympathique »
Correction de lexercice « Encre sympathique »
C'est l'oxydant du couple I2(aq) / I-(aq). L'acide ascorbique présent dans le b) (4 pts) Demi-équations d'oxydoréduction : )(2. 2)(. 2. aqI e. aqI. −. − = +.
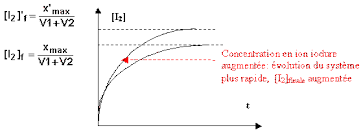 cinétique de réaction du diiode oxydoréduction
cinétique de réaction du diiode oxydoréduction
On fait la somme des 2 demi-équations pour obtenir l'équation bilan. 4 x (Cr2O7. 2-+ Equation bilan : 2 Fe3+ + 2 I- → 2 Fe2+ + I2. Seconde équation : 1/2 ...
 Les réactions doxydo-réduction
Les réactions doxydo-réduction
➔ Pour s'entraîner : « TS oxydoréduction demi équation ». 4/ Les réactions d'oxydoréduction. ➔ Le réducteur d'un couple (noté 1) peut participer à une
 CORRIGÉ
CORRIGÉ
1 août 2020 (1) et (2). C'est la même demi-équation pour le couple I2/I- qui intervient : ... 10- Écrire les demi-équations redox dans lesquelles ...
 Méthode : cas du couple Cr2O72-/Cr3 Applications Corrections
Méthode : cas du couple Cr2O72-/Cr3 Applications Corrections
Ecrire les demi-équations relatives aux couples Redox suivants : Cu2+/Cu. Fe2+/Fe. S4O6. 2–/S2O3. 2–. I2/I–. MnO4. –/Mn2+. O2/H2O2. Ag+/Ag. Fe3+/Fe. Corrections.
 école numérique - thème : oxydoréduction titre de la leçon : couples
école numérique - thème : oxydoréduction titre de la leçon : couples
L-1 en milieu acide. 1. Écris les demi- équations électroniques et l'équation- bilan. 2. Calcule la concentration en diiode I2 et en ions
 CM80 : Examen final — corrigé 1 Aspartame et neotame (667pts)
CM80 : Examen final — corrigé 1 Aspartame et neotame (667pts)
D'où la demi-équation redox : I2 + 2e– = 2I– . — couple RCHO/RCO2. – : n.o. (C/RCHO) = +I ; n.o. (C/RCO2. – ) = +III. D'où la demi-équation redox : RCO2. – +
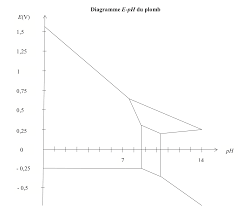
 Chapitre 5 : diagrammes potentiel-pH (E-pH) et potentiel-pL
Chapitre 5 : diagrammes potentiel-pH (E-pH) et potentiel-pL
Oxydoréduction (entre des espèces de n.o. différents). Ecriture de la demi-équation rédox utilisation de la formule de. Nernst puis de la convention de
 Loxydoréduction
Loxydoréduction
La demi-équation est écrite pour les deux membres d'un même couple Ox / Red + 5.I2 + 16.HO- à gauche H+ + HO- donne H2O : 2.MnO4. - +16.H2O +10.I-. 2Mn.
 La réaction doxydoréduction
La réaction doxydoréduction
Soit le couple I2/I- (diiode/ion iodure) établir la demi-équation de ce couple : qui cède des électrons et l'oxydant d'un autre couple redox qui les.
 Correction de lexercice « Encre sympathique »
Correction de lexercice « Encre sympathique »
a) (1 pt) Le diiode I2 de couleur brune en solution aqueuse
 CORRIGÉ
CORRIGÉ
1 août 2020 C'est la même demi-équation pour le couple I2/I- qui intervient : ... 10- Écrire les demi-équations redox dans lesquelles interviennent les ...
 Exercice 29 p 131 : a) Équation de la réaction : Oxydation de S2O3
Exercice 29 p 131 : a) Équation de la réaction : Oxydation de S2O3
b) Il s'agit d'une réaction d'oxydoréduction car il a un échange d'électrons entre deux espèces (I2 l'oxydant et S2O3. 2- le réducteur). c) Volume de solution
 CM80 : Examen final — corrigé 1 Aspartame et neotame (667pts)
CM80 : Examen final — corrigé 1 Aspartame et neotame (667pts)
couple I2/I– : n.o. (I/I2) = 0 ; n.o. (I/I– ) = -I. D'où la demi-équation redox : I2 + 2e– = 2I– . — couple RCHO/RCO2. – : n.o. (C/RCHO) = +I ; n.o. (C/RCO2.
 cinétique de réaction du diiode oxydoréduction
cinétique de réaction du diiode oxydoréduction
On multiplie la demi-équation d'oxydation par le nombre d'électrons intervenant dans la demi- Equation bilan : 2 Fe3+ + 2 I- ? 2 Fe2+ + I2.
 LES THIOLS.pdf
LES THIOLS.pdf
L'équation bilan s'écrit : Les couples oxydant /réducteur présents sont : - Diiode / ion iodure : I2 / I-. Demi équation : I2 + 2 e- = 2I- (1).
 école numérique - thème : oxydoréduction titre de la leçon : couples
école numérique - thème : oxydoréduction titre de la leçon : couples
captant des électrons selon la demi-équation électronique : est un réducteur et ils forment le couple redox ... On donne les couples redox I2 I?.
 Les réactions doxydo-réduction
Les réactions doxydo-réduction
On décrit cette double possibilité par une « demi-équation » électronique : oxydant + n e- Pour s'entraîner : « TS oxydoréduction demi équation ».
 Loxydoréduction
Loxydoréduction
2) Établir l'équation en milieu acide
 Lecture 11 Redox Chemistry - Stanford University
Lecture 11 Redox Chemistry - Stanford University
Redox reactions are written as half-reactions which are in the form of reductions (which means an element is transformed from a higher oxidation state (e g +II) to a lower oxidation state (e g +I)): Ox + ne- = Red; Where the more oxidized form of an element is on the left and the reduced form is on the right n is the number of electrons
 7014 Redox Chemistry Handout - Massachusetts Institute of
7014 Redox Chemistry Handout - Massachusetts Institute of
There are three ways to represent a redox reaction; these are shown below with a representative biological redox reaction: acetaldehyde + NADH + H + ethanol + NAD + (1) Overall Reaction: (2) Electron-transfer diagram: acetaldehyde NADH + H + e-NAD + ethanol (3) Half-reactions: acetaldehyde + 2 H + + 2 e-ethanol + NADH NAD + + H + + 2 e-
 Balancing REDOX Reactions: Learn and Practice
Balancing REDOX Reactions: Learn and Practice
Apr 17 2013 · Here the equation is already written in an ionic equation format so we must do some more work to assign oxidation numbers (see ebook rules) ClO3¯ (aq) + I2 (s) à IO3¯ (aq) + Cl¯(aq) Oxidation Numbers: +5 -2 0 à +5 -2 -1 Yes the Iodine (I) has been oxidized and the Chlorine (Cl) has been reduced
 Oxidation- Reduction Chemistry - WRUV
Oxidation- Reduction Chemistry - WRUV
Half-Reactions ØConsider each process indivually: Oxidation Cu (s) ? Cu2+ (aq) + 2 e-Reduction [Ag+ + e-? Ag (s) ] x 2 Overall: Cu (s) + 2Ag+ (aq) ? Cu2+ (aq) + 2Ag (s) Oxidized (reducing agent) Reduced (oxidizing agent) 4 Balancing Redox Reactions Ø The Half-Reaction Method Three Steps: 1 Determine net ionic equations for both half
 Searches related to demi equation redox i2/i PDF
Searches related to demi equation redox i2/i PDF
During a REDOX reaction electrons are transferred directly from the reducer to the oxidizer with no separation of the two reactions • If we were able to isolate the half reactions into separate containers and connected the two containers electrically using platinum wire electrodes and a volt meter we could then measure that potential •
What are half-equations in a redox reaction?
These two equations are described as "eelectron-half-equations," "half-equations," or "ionic-half-equations," or "half-reactions." Every redox reaction is made up of two half-reactions: in one, electrons are lost (an oxidation process); in the other, those electrons are gained (a reduction process).
How do you determine the direction of a redox reaction?
Note: to determine the direction of a redox reaction, you do not need to use the Nernst equation. You only need to know the sign of ?E'?. you must reverse the sign of E'? for a reaction if you reverse the direction of the reaction. Here reaction (2) must be reversed.
What is a redox reaction?
Redox reactions are a major determinant of chemical species present in natural environments. Znº - 2e- Zn2+ (an oxidation half reaction, electrons lost) Cu2++ 2e- Cuº (a reduction half-reaction, electrons gained) The two species comprising half-reactions (e.g. Znº & Zn2+) are referred to as a “couple”.
Can a redox titration be applied to a mixture of analytes?
As with acid–base titrations, we can extend a redox titration to the analysis of a mixture of analytes if there is a significant difference in their oxidation or reduction potentials. Figure 9.42 shows an example of the titration curve for a mixture of Fe 2+ and Sn 2+ using Ce 4+ as the titrant.
 1
1 Niveau : 1ères CDE
Discipline :
PHYSIQUE-CHIMIE
ÉCOLE NUMÉRIQUE
THÈME : OXYDORÉDUCTION
TITRE DE LA LEÇON : COUPLES OXYDANTS/RÉDUCTEURS ENSOLUTION AQUEUSE. DOSAGE.
I.Les élèves de la 1ère C du Lycée Moderne de Grand-Lahou ont découvert dans une revue scientifique,
que2O72).
Afin de vérifier cette information, ils décident sous la conduite de leur Professeur, de prévoir les
II. CONTENU DE LA LECON
1. Etude de quelques couples
1.1.1. Expérience et observations
1.1.2. Interprétation
couleur jaune orangé.équation électronique :
captant des électrons selon la demi-équation électronique : - -bilan : 21.1.3. Conclusion
La réaction entre les ions ܯܱ݊ସି et les ions ܨ ܯܱ݊ସି et le réducteur est ܨ Cette réaction était donc prévisible selon la règle de gamma :1.2.1. Expérience et observations
1.2.2. Interprétation
électrons selon la demi-équation électronique : -équation électronique : - -bilan : 31.2.3. Conclusion
et son : Cette réaction était donc prévisible selon la règle de gamma :2. Prevision des reactions chimiques a partir des potentiels normaux
Activité
réaction entre ces deux couples.Solution
-bilan est :3. Dosage par oxydoreduction
3.1.Définition
Doser une espèce chimique en solution consiste à déterminer la concentration molaire de cette espèce
dans la solution.3.2.Principe
Pour effectuer un dosage colorimétrique :
- mettre dans un bécher un volume connu de la solution à doser et on y ajoute quelques gouttes - mettre dans la burette, la solution qui sert à doser, de concentration connue; - faire tomber goutte à goutte la solution qui sert à doser dans celle à doser; 4 - arrêter : on dit3.3.e2+ MnO4-
: 5Fe2+ + MnO4- + 8H+ ื Mn2+ + 4H2O + Fe3+ on a de la teinte violette persistante de la solution qui sert à doser.Le bilan :
Voeq on permanganate versé
Activité
Des élèves veulent réaliser :
éthanol acide éthanoîque permanganate de potassium acide sulfurique - soude :1/ Les solutions :
a) éthanol permanganate de potassium acide sulfurique ; b) ethanol soude permanganate de potassium ; c) ethanom acide éthanoïque permanganate de potassium acide sulfurique.2 -bilan de la réaction chimique est :
a) MnO4- + CH3CH2OH + 6H+ ื Mn2+ + CH3CHO + H2O ; b) 2MnO4- + 5CH3CH2OH + 6H+ ื 2Mn2+ + 5CH3CHO + 8H2O ; c) MnO4- + CH3CH2OH ื Mn2+ + CH3CHO . Recopie le numéro de la bonne réponse de chaque proposition.Solution
1- a) 2- b)
Un professeur de physique-ère C de réaliser en travauxpratiques, les expériences décrites ci-dessous en vue de doser une solution de dichromate de
potassium.Expérience 1
Dans un bécher, le groupe introduit un volume V = 20 mL d'une solution de dichromate de
potassium de concentration C. Il ajoute à cette solution un volume V1 = 20 mL d'une solution d'iodure de potassium (K+ + I-) de concentration C1 = 0,4 mol.L-1. 2Solution de permanganate
de potassium acidifiéeCconnue, Và lire
1Solution contenant
les ions Fe2+Vconnu , Cinconnue
Burette graduée
Robinet
Bécher
Agitateur
magnétique 5 Les ions iodures étant en excès, le contenu du bécher prend une couleur brun jaune.Expérience 2
Le groupe ajoute à ce mélange, un volume V2 = Tu es sollicité pour aider le groupe qui éprouve des difficultés. 1.1.1) Donne et nomme les différents couples oxydant-réducteurs intervenant dans ces deux
expériences.1.2) Justifie la couleur brun jaune prise par le contenu du bécher dans la première expérience.
2. Ecris pour la première expérience :
2.1) les demi-équations électroniques ;
2.2) l'équation bilan de la réaction.
3. Ecris pour l'expérience 2 :
3.1) les demi-équations ;
3.2) l'équation bilan de cette réaction.
4. Déduis de ces expériences, la valeur de la concentration C de la solution de dichromate de
potassiumSolution
1-1.1) Les différents couples
Expérience 1 :
I2/I- iode /ion iodure
Cr2O72- / Cr3+ ion dichromate/ion chrome
Expérience 2 :
I2/I- iode /ion iodure
Cr2O72- / Cr3+ ion dichromate/ion chrome III
S4O62- / S2O32- ion tetrathionate/ion thiosulfate1.2) La présence du diiode en solution donne la couleur jaune
2-2.1) Demi-
Cr2O72- + 14H+ + 6e- ื 2Cr3+ + 7H2O2I- ื I2 + 2e-
2.2) Equation-bilan
Cr2O72- + 6I- + 14H+ ื 2Cr3+ + 3I2 + 7H2O 3-3.1) Demi-équations
3.2) Equation-bilan
4- Concentration C du dichromate de potassium
Quantité de matière de I2 :
Quantitié de matière de Cr2O72-
Cr2O72- + 6I- + 14H+ ื 2Cr3+ + 3I2 + 7H2O 6III. EXERCICES
Exercice 1
Le diiode I2 peut être oxydé en milieu acide, en acide iodique HIO3.1. Équilibre la demi- équation électronique correspondant à cette oxydation.
une solution - bilan de la réaction.Solution
1. Démi-équation correspondant à cette oxydation
I2 - + 6 H2O ื 2 HIO3 + 10 H+ + 10 e-2. Equation-bilan de la réaction
Cl2 + 2 e ื 2 Cl2
2 I- ื I2 + 2 e-
Cl2 + 2 I- ื 2 Cl2 + I2Exercice 2
1. Complète la demi-
faisant intervenir, si nécessaire, que les espèces H2O et H+CH3-CH2- CH3-COOH +
3+.Solution
1. CH3-CH2-OH + H2O ื CH3-COOH + 4 H+ 4 e- 2.2.1) Démi-équation électronique du couple Cr2O72- / Cr3+
Cr2O72- + 14 H+ + 6 e- ื Cr3+ + 7 H2O2.2) Equation-bilan de la réaction
( CH3-CH2-OH + H2O ื CH3-COOH + 4 H+ + 4 e- ) x 3 ( Cr2O72- + 14 H+ + 6 e- ื Cr3+ + 7 H2O ) x 22 Cr2O72 + 3 CH3-CH2-OH + 16 H+ ื 4 Cr3+ + 3CH3-COOH + 11 H2O
Exercice 3
dichromate de potassium K2Cr2O7 à 10-2 mol. L-10,1 mol. L-1 en milieu acide.
1. Écris les demi- - bilan.
2. Calcule la concentration en diiode I2 et en ions Cr3+ en fin de réaction.
Solution
71. Démi-équations électroniques et équation-bilan
2. Equation-bilan de la réaction
3. -bilan nous avons:
Exercice 4
Pour tester tes connaissances en chimie, tu décides de déterminer la variation de la masse de fer
métallique dans une solution aqueuse lors de son oxydation. Pour ce faire, tu dissous 10 g de sulfate
de fer III (Fe2(SO4)3 Dans cette solution aqueuse notée A, tu verse de la limaille de fer en excès.Données :
Masses molaires en g/mol : O : 16 ; S : 32 ; Fe : 56; 1) 1.11.2 Calcule la concentration en ions Fe3+ et SO42- de la solution.
2)3.1. Montre que le fer est oxydé.
3.2. -bilan de la réaction.
3) Détermine la variation de la masse de fer métallique lorsque tous les ions Fe3+ ont été réduits.
4) Calcule la concentration en ions Fe2+.
Solution
1.1.1 Fe2(SO4)3 ื 2 Fe3+ + 3 SO42-
2.Par conséquent, le fer est oxydé.
2.3) ( Fe3+ + e- ื Fe2+ ) X 2
Fe ื Fe2+ + 2 e-
2 Fe3+ + Fe ื 3 Fe2+
3. La variation de masse du fer est égale à la masse de fer transformée en ions
84. Calculons la concentration des ions Fe2+ dans la solution
Exercice 5
2+ par
une solution de permanganate de potassium afin de connaître la concentration molaire volumique inconnue de la solution de Fe2+ .Cette solution de permanganate a été obtenue par dissolution de m = 0,2g de permanganate de
On donne : M( KMnO4) = 158 g/mol.
1. Donne les couples oxydant / réducteur présents dans la solution au cours du dosage.
2. Ecris les demi-bilan de la réaction chimique.
3. Détermine :
3.1 la concentration molaire volumique de la solution de permanganate de potassium;
3.2 la concentration molaire volumique de la soluti
Solution
1. MnO4-/Mn2+ et Fe3+/Fe2+
2. Demi-équations et équation-bilan
MnO4- + 8H+ + 5e- ื Mn2+ + 4H2O ( Fe2+ ื Fe3+ + e-) x 5 MnO4- + 5Fe2+ + 8H+ ื Mn2+ + 5Fe3+ + 4H2O3.1 La concentration molaire de la solution de permanganate de potassium
C = ୬
donc C = ୫ ǡଵൈଵହ଼= 0,0126 mol/L 3.2 ହ CoxVox = n CredVredIV. DOCUMENTATION
Le fer dans les eaux souterraines
en métaux assez variable.En fonction de leur concentration, les éléments métalliques peuvent être essentiels ou toxiques
Il est donc important de déterminer régulièrement la quantité en éléments métalliques dans ces
eaux. 9 un changement de couleur.quotesdbs_dbs30.pdfusesText_36[PDF] potentiel standard cl2/cl-
[PDF] clo-/cl-
[PDF] couple redox clo-/cl-
[PDF] demi equation clo-/cl-
[PDF] hclo/cl2
[PDF] demi equation redox sn2+/sn
[PDF] couple redox dichlore
[PDF] claforan iv
[PDF] claforan dilution
[PDF] claforan posologie
[PDF] claforan per os
[PDF] claforan cp
[PDF] claforan dci
[PDF] claforan 1g
