 La réaction doxydoréduction
La réaction doxydoréduction
Les halogènes (F2; I2; Cl2;. O2) sont de puissants oxydants. 1.5)Etablir la demi-équation d'un couple. On étudie dans cet exemple le couple MnO4.
 Correction de lexercice « Encre sympathique »
Correction de lexercice « Encre sympathique »
C'est l'oxydant du couple I2(aq) / I-(aq). L'acide ascorbique présent dans le b) (4 pts) Demi-équations d'oxydoréduction : )(2. 2)(. 2. aqI e. aqI. −. − = +.
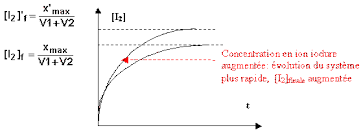 cinétique de réaction du diiode oxydoréduction
cinétique de réaction du diiode oxydoréduction
On fait la somme des 2 demi-équations pour obtenir l'équation bilan. 4 x (Cr2O7. 2-+ Equation bilan : 2 Fe3+ + 2 I- → 2 Fe2+ + I2. Seconde équation : 1/2 ...
 CORRIGÉ
CORRIGÉ
1 août 2020 (1) et (2). C'est la même demi-équation pour le couple I2/I- qui intervient : ... 10- Écrire les demi-équations redox dans lesquelles ...
 Méthode : cas du couple Cr2O72-/Cr3 Applications Corrections
Méthode : cas du couple Cr2O72-/Cr3 Applications Corrections
Ecrire les demi-équations relatives aux couples Redox suivants : Cu2+/Cu. Fe2+/Fe. S4O6. 2–/S2O3. 2–. I2/I–. MnO4. –/Mn2+. O2/H2O2. Ag+/Ag. Fe3+/Fe. Corrections.
 école numérique - thème : oxydoréduction titre de la leçon : couples
école numérique - thème : oxydoréduction titre de la leçon : couples
L-1 en milieu acide. 1. Écris les demi- équations électroniques et l'équation- bilan. 2. Calcule la concentration en diiode I2 et en ions
 CM80 : Examen final — corrigé 1 Aspartame et neotame (667pts)
CM80 : Examen final — corrigé 1 Aspartame et neotame (667pts)
D'où la demi-équation redox : I2 + 2e– = 2I– . — couple RCHO/RCO2. – : n.o. (C/RCHO) = +I ; n.o. (C/RCO2. – ) = +III. D'où la demi-équation redox : RCO2. – +
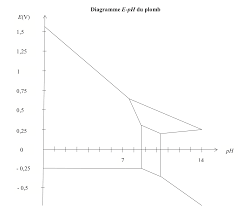
 Chapitre 5 : diagrammes potentiel-pH (E-pH) et potentiel-pL
Chapitre 5 : diagrammes potentiel-pH (E-pH) et potentiel-pL
Oxydoréduction (entre des espèces de n.o. différents). Ecriture de la demi-équation rédox utilisation de la formule de. Nernst puis de la convention de
 Loxydoréduction
Loxydoréduction
La demi-équation est écrite pour les deux membres d'un même couple Ox / Red + 5.I2 + 16.HO- à gauche H+ + HO- donne H2O : 2.MnO4. - +16.H2O +10.I-. 2Mn.
 La réaction doxydoréduction
La réaction doxydoréduction
Soit le couple I2/I- (diiode/ion iodure) établir la demi-équation de ce couple : qui cède des électrons et l'oxydant d'un autre couple redox qui les.
 Correction de lexercice « Encre sympathique »
Correction de lexercice « Encre sympathique »
a) (1 pt) Le diiode I2 de couleur brune en solution aqueuse
 CORRIGÉ
CORRIGÉ
1 août 2020 C'est la même demi-équation pour le couple I2/I- qui intervient : ... 10- Écrire les demi-équations redox dans lesquelles interviennent les ...
 Exercice 29 p 131 : a) Équation de la réaction : Oxydation de S2O3
Exercice 29 p 131 : a) Équation de la réaction : Oxydation de S2O3
b) Il s'agit d'une réaction d'oxydoréduction car il a un échange d'électrons entre deux espèces (I2 l'oxydant et S2O3. 2- le réducteur). c) Volume de solution
 CM80 : Examen final — corrigé 1 Aspartame et neotame (667pts)
CM80 : Examen final — corrigé 1 Aspartame et neotame (667pts)
couple I2/I– : n.o. (I/I2) = 0 ; n.o. (I/I– ) = -I. D'où la demi-équation redox : I2 + 2e– = 2I– . — couple RCHO/RCO2. – : n.o. (C/RCHO) = +I ; n.o. (C/RCO2.
 cinétique de réaction du diiode oxydoréduction
cinétique de réaction du diiode oxydoréduction
On multiplie la demi-équation d'oxydation par le nombre d'électrons intervenant dans la demi- Equation bilan : 2 Fe3+ + 2 I- ? 2 Fe2+ + I2.
 LES THIOLS.pdf
LES THIOLS.pdf
L'équation bilan s'écrit : Les couples oxydant /réducteur présents sont : - Diiode / ion iodure : I2 / I-. Demi équation : I2 + 2 e- = 2I- (1).
 école numérique - thème : oxydoréduction titre de la leçon : couples
école numérique - thème : oxydoréduction titre de la leçon : couples
captant des électrons selon la demi-équation électronique : est un réducteur et ils forment le couple redox ... On donne les couples redox I2 I?.
 Les réactions doxydo-réduction
Les réactions doxydo-réduction
On décrit cette double possibilité par une « demi-équation » électronique : oxydant + n e- Pour s'entraîner : « TS oxydoréduction demi équation ».
 Loxydoréduction
Loxydoréduction
2) Établir l'équation en milieu acide
 Lecture 11 Redox Chemistry - Stanford University
Lecture 11 Redox Chemistry - Stanford University
Redox reactions are written as half-reactions which are in the form of reductions (which means an element is transformed from a higher oxidation state (e g +II) to a lower oxidation state (e g +I)): Ox + ne- = Red; Where the more oxidized form of an element is on the left and the reduced form is on the right n is the number of electrons
 7014 Redox Chemistry Handout - Massachusetts Institute of
7014 Redox Chemistry Handout - Massachusetts Institute of
There are three ways to represent a redox reaction; these are shown below with a representative biological redox reaction: acetaldehyde + NADH + H + ethanol + NAD + (1) Overall Reaction: (2) Electron-transfer diagram: acetaldehyde NADH + H + e-NAD + ethanol (3) Half-reactions: acetaldehyde + 2 H + + 2 e-ethanol + NADH NAD + + H + + 2 e-
 Balancing REDOX Reactions: Learn and Practice
Balancing REDOX Reactions: Learn and Practice
Apr 17 2013 · Here the equation is already written in an ionic equation format so we must do some more work to assign oxidation numbers (see ebook rules) ClO3¯ (aq) + I2 (s) à IO3¯ (aq) + Cl¯(aq) Oxidation Numbers: +5 -2 0 à +5 -2 -1 Yes the Iodine (I) has been oxidized and the Chlorine (Cl) has been reduced
 Oxidation- Reduction Chemistry - WRUV
Oxidation- Reduction Chemistry - WRUV
Half-Reactions ØConsider each process indivually: Oxidation Cu (s) ? Cu2+ (aq) + 2 e-Reduction [Ag+ + e-? Ag (s) ] x 2 Overall: Cu (s) + 2Ag+ (aq) ? Cu2+ (aq) + 2Ag (s) Oxidized (reducing agent) Reduced (oxidizing agent) 4 Balancing Redox Reactions Ø The Half-Reaction Method Three Steps: 1 Determine net ionic equations for both half
 Searches related to demi equation redox i2/i PDF
Searches related to demi equation redox i2/i PDF
During a REDOX reaction electrons are transferred directly from the reducer to the oxidizer with no separation of the two reactions • If we were able to isolate the half reactions into separate containers and connected the two containers electrically using platinum wire electrodes and a volt meter we could then measure that potential •
What are half-equations in a redox reaction?
These two equations are described as "eelectron-half-equations," "half-equations," or "ionic-half-equations," or "half-reactions." Every redox reaction is made up of two half-reactions: in one, electrons are lost (an oxidation process); in the other, those electrons are gained (a reduction process).
How do you determine the direction of a redox reaction?
Note: to determine the direction of a redox reaction, you do not need to use the Nernst equation. You only need to know the sign of ?E'?. you must reverse the sign of E'? for a reaction if you reverse the direction of the reaction. Here reaction (2) must be reversed.
What is a redox reaction?
Redox reactions are a major determinant of chemical species present in natural environments. Znº - 2e- Zn2+ (an oxidation half reaction, electrons lost) Cu2++ 2e- Cuº (a reduction half-reaction, electrons gained) The two species comprising half-reactions (e.g. Znº & Zn2+) are referred to as a “couple”.
Can a redox titration be applied to a mixture of analytes?
As with acid–base titrations, we can extend a redox titration to the analysis of a mixture of analytes if there is a significant difference in their oxidation or reduction potentials. Figure 9.42 shows an example of the titration curve for a mixture of Fe 2+ and Sn 2+ using Ce 4+ as the titrant.

Les réactions d'oxydo-réduction
I/ L'oxydoréduction
1/ Les notions d'oxydant et de réducteur
➔un réducteur est une espèce chimique capable de libérer 1 ou plusieurs électrons. exemples : le zinc : Zn Zn2+ + 2e- le cuivre : Cu Cu2+ + 2e- ➔un oxydant est une espèce chimique capable de capter 1 ou plusieurs électrons. exemples : les ions argent : Ag+ + e- Ag les ions cuivre : Cu2+ + 2e- Cu2/ Les couples oxydant/réducteur
➔on remarque que l'atome de cuivre Cu est un réducteur et que l'ion cuivre Cu2+ est un oxydant.
➔on peut toujours associer un réducteur avec un oxydant : ces 2 espèces forment un " couple
oxydant/réducteur ». exemples : couple du cuivre : Cu2+ / Cu couple du zinc : Zn2+ / Zn couple de l'argent : Ag+ / Ag3/ Les demi-équations électroniques
➔Chaque couple oxydant-réducteur représente un transfert d'électron(s) réalisable dans les 2 sens.
exemple pour le couple Cu2+ / Cu : Cu2+ + 2e- Cu et Cu Cu2+ + 2e-
➔On décrit cette double possibilité par une " demi-équation » électronique : oxydant + n e- réducteurexemple pour le couple Cu2+ / Cu : Cu2+ + 2e- Cu également noté : Cu2+ + 2e- Cu
➔Pour s'entraîner : " TS oxydoréduction demi équation »4/ Les réactions d'oxydoréduction
➔Le réducteur d'un couple (noté 1) peut participer à une réaction chimique avec l'oxydant d'un autre couple
(noté 2).➔Au cours de cette réaction, le réducteur 1 va libérer 1 ou plusieurs électrons, qui seront ensuite captés par
l'oxydant 2. exemple : réaction entre le réducteur du couple Cu2+ / Cu et l'oxydant du couple Ag+ / Ag Cu Cu2+ + 2e- __________________________ puis _Ag+ + _e- _Ag ________________________ ➔Bilan : ✗réducteurs oxydants on écrit toujours l'oxydant à gauche et le réducteur à droite2 électrons libérés
2 électrons consommés
somme :2Ag+ + Cu 2Ag + Cu 2+une réaction d'oxydoréduction correspond à un transfert d'électron(s) entre un réducteur et un
oxydant appartenant à 2 couples différentsau cours de la réaction, il y a autant d'électrons libérés par le réducteur 1 que d'électrons captés
par l'oxydant 2 les électrons échangés n'apparaissent pas dans le bilan final2225/ L'équation d'une réaction d'oxydoréduction : méthode
a/ identifier le réducteur du couple 1 et l'oxydant du couple 2 présents b/ écrire la demi-équation électronique du couple 1 et celle du couple 2pour le couple 1, écrire cette demi-équation de sorte que le réducteur 1 se trouve à gauche, du côté des réactifs
c/ déterminer le coefficient éventuel de sorte que le nombre d'électron(s) échangé soit le même
d/ faire la somme, en vérifiant bien que : ✗la conservation des atomes est respectée ✗la conservation des charges électriques est respectée ✗les électrons n'apparaissent pas dans le bilan final6/ Pour s'entraîner : simulateur " TS oxydoréduction équation »
Déterminez l'équation d'oxydoréduction qui a lieu dans une solution contenant les ions fer II Fe2+ et les ions
permanganate MnO4- , en milieu acide (= présence d'ions H+) couple 1 : Fe3+ / Fe2+
couple 2 : MnO4- / Mn2+ ➔Entourer en rouge : les espèces présentes dans la solution et les identifier dans les couples : On écrit les 2 demi-équations électroniques correspondant à ces couples, en plaçant à gauche chaque réactif présent (il faut inverser la demi-équation du couple Fe2+ / Fe3+) :
Pour avoir autant d'électrons libérés par le réducteur 1 que d'électrons captés par l'oxydant 2, on doit coefficienter chaque demi-équation (en vert).On fait la somme : 5 x (1) + 1 x (2)
Les électrons s'annulent car il y en a autant dans les réactifs que dans les produitsx 5 x 1(1) (2) Fe2+ : réducteur du couple 1MnO4- : oxydant du couple 2
Fe2+ Fe3+ + e-
MnO4- + 8H+ + 5e- Mn2+ + 4H2O
5 Fe2+ + MnO4- + 8H+ 5 Fe3+ + Mn2+ + 4H20
quotesdbs_dbs30.pdfusesText_36[PDF] potentiel standard cl2/cl-
[PDF] clo-/cl-
[PDF] couple redox clo-/cl-
[PDF] demi equation clo-/cl-
[PDF] hclo/cl2
[PDF] demi equation redox sn2+/sn
[PDF] couple redox dichlore
[PDF] claforan iv
[PDF] claforan dilution
[PDF] claforan posologie
[PDF] claforan per os
[PDF] claforan cp
[PDF] claforan dci
[PDF] claforan 1g
