 Chimie analytique 3 ème année docteur en pharmacie Série TD 8
Chimie analytique 3 ème année docteur en pharmacie Série TD 8
Série TD 8 <La spectroscopie atomique>. Exercice 01 : En absorption atomique le Zn absorbe à 213856 nm. Son nombre quantique vaut 3. Quelle est l'énergie en
 Examen Méthodes spectroscopiques 2
Examen Méthodes spectroscopiques 2
16 déc. 2010 -‐ En absorption atomique quel(s) paramètre(s) va (vont) influencer ... -‐ En spectroscopie UV-‐visible pour mesurer l'absorbance à 250 nm d ...
 Epreuve Finale Méthodes dAnalyse Spectroscopiques 30/09/2020
Epreuve Finale Méthodes dAnalyse Spectroscopiques 30/09/2020
30 sept. 2020 Exercice 1 : 1. Quel est le principe de la spectrométrie d'absorption atomique (SAA) ainsi que la spectrométrie d'émission atomique (SEA)?. 2 ...
 TD N°6 Spectrométries dabsorption et démission atomiques
TD N°6 Spectrométries dabsorption et démission atomiques
Exercice 1 : En absorption atomique le zinc absorbe à 213.856 nm
 COURS ET EXERCICES DE CHIMIOMETRIE
COURS ET EXERCICES DE CHIMIOMETRIE
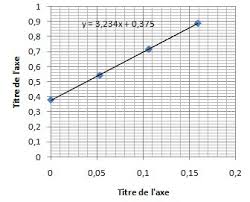
corrigé. En absence d'erreur systématique la moyenne doit 3 L'analyse d'un ensemble de solution patron de plomb par spectrométrie d'absorption atomique.
 Untitled
Untitled
1) Donner le principe de la spectroscopie d'absorption atomique. 2) 5 mL d'une solution de l'échantillon de concentration inconnue sont dilués à 100 mL. L'
 Polycopies-En: Spectroscopie Optique et RMN
Polycopies-En: Spectroscopie Optique et RMN
Une série d'exercices corrigés est donnée à la fin de chaque chapitre. Le polycopié est composé de quatre chapitres : • Chapitre I : Rappel sur la structure de
 EXERCICES ÉPREUVE CHIMIE 1
EXERCICES ÉPREUVE CHIMIE 1
On place dans un spectrophotomètre une cuve de largeur l contenant une solution d'éosine de concentration molaire c = 10.10-5 mol.L-1. A température constante
 EXERCICES ÉPREUVE CHIMIE 1
EXERCICES ÉPREUVE CHIMIE 1
On place dans un spectrophotomètre une cuve de largeur l contenant une solution d'éosine de concentration molaire c = 10.10-5 mol.L-1. A température constante
 Spectrométrie dabsorption atomique : 1. Problèmes généraux. 2
Spectrométrie dabsorption atomique : 1. Problèmes généraux. 2
spectrométrie d'absorption atomique. 30. Sources à spectres de raies. 32. Sources d ... corrigés ou d'un étalonnage défectueux. Pratiquement le contrôle de ...
 Examen Méthodes spectroscopiques 2
Examen Méthodes spectroscopiques 2
16 déc. 2010 Il est possible de doser simultanément par spectroscopie ... En absorption atomique quel(s) paramètre(s) va (vont) influencer la ...
 Chimie analytique 3 ème année docteur en pharmacie Série TD 8
Chimie analytique 3 ème année docteur en pharmacie Série TD 8
Série TD 8 <La spectroscopie atomique>. Exercice 01 : En absorption atomique le Zn absorbe à 213856 nm. Son nombre quantique vaut 3.
 Untitled
Untitled
Exercice N°3 (15 points). Spectrométrie d'absorption atomique (flamme) et méthode des ajouts dosés. Dans le vin l'ajout de cuivre (à partir des sels de
 EXERCICES ÉPREUVE CHIMIE 1
EXERCICES ÉPREUVE CHIMIE 1
c). A ? = 500 nm une solution alcoolique d'éosine de concentration molaire c' = 1
 COURS ET EXERCICES DE CHIMIOMETRIE
COURS ET EXERCICES DE CHIMIOMETRIE
C'est par exemple le cas en spectrométrie d'absorption La méthode d'analyse n'est réellement corrigée que si en l'absence de l'analyte considéré
 Untitled
Untitled
1) Donner le principe de la spectroscopie d'absorption atomique. 2) 5 mL d'une solution de l'échantillon de concentration inconnue sont dilués à 100 mL.
 Exercices : autour des spectres démission et dabsorption
Exercices : autour des spectres démission et dabsorption
Exercice 6 : spectroscopie d'émission de l'atome d'hydrogène. Un nuage peu dense d'atomes d'hydrogène est éclairé par un rayonnement UV.
 Faculté de médecine 2019/ 2020 Département de Pharmacie
Faculté de médecine 2019/ 2020 Département de Pharmacie
Exercice 1 : En absorption atomique le zinc absorbe à 213.856 nm
 Exercice n°1 : (8 points) Ici absorption de ? à partir du niveau n=2
Exercice n°1 : (8 points) Ici absorption de ? à partir du niveau n=2
1. Quelle est l'orbitale atomique associée aux nombres quantiques n=2 ; l=2 et m=0 ? Impossible car l doit
 SPÉCIALITÉ PHYSIQUE CHIMIE COURS
SPÉCIALITÉ PHYSIQUE CHIMIE COURS
1.2 Spectroscopie d'absorbance . On retrouve la masse molaire atomique de chaque ... Exemples Voir la fiche d'exercices corrigés.
 Spectrométrie d’absorption atomique - Université Laval
Spectrométrie d’absorption atomique - Université Laval
Le contact entre les atomes et la source lumineuse est assuré par la cellule d’absorption La cellule d’absorption est en fait une flamme générée par la combustion d’acétylène en présence d’oxygène L’échantillon à analyser est aspiré par l’appareil et transformé en aérosol La flamme
 Spectrométrie d’absorption atomique
Spectrométrie d’absorption atomique
Les spectroscopies IR (infrarouge) et de RMN (résonance magnétique nucléaire) en sont deux exemples 1 3 1 Donner l’origine des bandes d’absorption 1 et 2 du spectre infrarouge IR (document 1) en exploitant les données du document 2 Accès à la correction
 Exercices : autour des spectres d’émission et d’absorption
Exercices : autour des spectres d’émission et d’absorption
Exercices : autour des spectres d’émission et d’absorption Exercice 6 : spectroscopie d’émission de l’atome d’hydrogène Un nuage peu dense d’atomes d’hydrogène est éclairé par un rayonnement UV polychromatique continu qui renferme toutes les longueurs d’onde dans un intervalle
 LPro Spectro 1011 - u-bourgognefr
LPro Spectro 1011 - u-bourgognefr
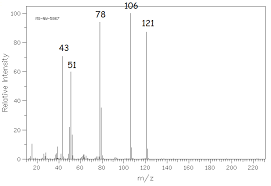
Figure’4:spectre!13C5RMN!du!composéII’ A Spectredemasse! 1D Donner!la!valeur!du!pic!de!base!et!de!l’ion!moléculaire ! 2D Déterminer!la!formule!moléculaire
 Exercices : autour des spectres d’émission et d’absorption
Exercices : autour des spectres d’émission et d’absorption
Exercices : autour des spectres d’émission et d’absorption données numériques pour l’ensemble des exercices • Constante de Planck : h = 663 10-34 J s • Célérité de la lumière : 300 108 m s-1 • Constante d'Avogadro : N = 602 1023 mol-1 • 1 eV correspond à 16 10-19 J Exercice 1 : flux de photons
 leay:block;margin-top:24px;margin-bottom:2px; class=tit maguenefste-monsitecomUniversité Cheikh Anta DIOP Faculté des Sciences & Techniques
leay:block;margin-top:24px;margin-bottom:2px; class=tit maguenefste-monsitecomUniversité Cheikh Anta DIOP Faculté des Sciences & Techniques
Exercice II Spectre d’absorption IR de l’oscillateur anharmonique de 12C=16O (8 pts) On étudie le spectre d’absorption de l’oscillateur anharmonique 12C=16O 1) Rappeler les règles de sélection en absorption dans le cas anharmonique
 Histoire de la chimie La spectroscopie d’absorption atomique
Histoire de la chimie La spectroscopie d’absorption atomique
spectroscopie d’absorption atomique (AAS) fut découverte en 1955 par Alan Walsh Or cet énoncé est assez réducteur dans la mesure où il occulte l’ampleur des tâches à accom-plir autant que l’importance de s motivations de la volonté de réussir et d’aller jusqu’au bout [1] Après avoir rappelé quelle
 2- METHODES ET TECHNIQUES - univ-paufr
2- METHODES ET TECHNIQUES - univ-paufr
2 1 4 4 - Spectrométrie d’absorption atomique Principe : L’élément à doser est dissocié le plus souvent dans une flamme et placé dans un état « fondamental » On mesure alors son absorption sur des longueurs d’onde caractéristiques
Qu'est-ce que la spectrométrie d'absorption atomique ?
- La spectrométrie d’absorption atomique permet de quantifier les éléments métalliques en solutions. Chaque élément a un nombre spécifique d’électrons associés à son noyau. La configuration orbitale normale et la plus stable des électrons est appelée état de base.
Comment fonctionne l’absorption atomique ?
- Lors du procédé d’absorption atomique l’énergie fournie à l’atome provient d’une source lumineuse appelée lampe à cathode creuse. L’atome dans son état de base absorbe l’énergie lumineuse à une longueur d’onde spécifique et passe à un état d’excitation.
Comment fonctionne une cellule d’absorption ?
- La cellule d’absorption est en fait une flamme générée par la combustion d’acétylène en présence d’oxygène. L’échantillon à analyser est aspiré par l’appareil et transformé en aérosol. La flamme atomise ensuite les éléments contenus dans l’aérosol et les place en travers du faisceau de la lampe à cathode creuse.
Comment le contact entre les atomes et la source lumineuse est assuré par la cellule d’absorption ?
- Le contact entre les atomes et la source lumineuse est assuré par la cellule d’absorption. La cellule d’absorption est en fait une flamme générée par la combustion d’acétylène en présence d’oxygène. L’échantillon à analyser est aspiré par l’appareil et transformé en aérosol.
Analyse spectrale
Spectres IR
5 Extraits de sujets corrigés du bac S
© http://labolycee.org
La spectroscopie infrarouge : un moyen de déterminer les groupes https://youtu.be/U0Hu3-J0igE Animation par Ostralo.net http://chimie.ostralo.net/spectreIR/ Les corrigés sont rédigés par les professe Ces corrigés sont accessibles gratuitement et sans inscription sur http://labolycee.org Contacts : https://twitter.com/Labolycee ; https://www.facebook.com/labolycee/ ; labolycee@labolycee.org Les exercices de bac sont conçus à partir de la colonne Compétences exigibles.Notions et contenus Compétences exigibles
Spectres IR
https://youtu.be/1ZQXEZKBKTYIdentification de liaisons à l'aide du
nombre d'onde correspondant ; détermination de groupes caractéristiques.Mise en évidence de la liaison
hydrogène. Exploiter un spectre IR pour déterminer des groupes caractéristiques à l'aide de tables de données ou de logiciels. Associer un groupe caractéristique à une fonction dans le cas des alcool, aldéhyde, cétone, acide carboxylique, ester, amine, amide. Connaître les règles de nomenclature de ces composés ainsi que celles des alcanes et des alcènes. https://youtu.be/icmXwHywn9g Identification d'une molécule organique par IR et RMNde 10 min, réalisé par la fondation Maison de la Chimie et le CNDP : https://youtu.be/swvc0fQL5RQ Extrait 1 Bac S 2013 Amérique du nord http://labolycee.org EXERCICE I : ASPIRINE ET PRÉVENTION CARDIOVASCULAIRE (8,5 points)Accès à la correction
2H4O2.
2.2.1. Donner la formule semi-
e éthanoïque.2.2.2. Les spectres infrarouges de ces deux espèces chimiques sont regroupés dans le
document 3 ci-dessous. Une table de données de spectroscopie infrarouge est également fournie (document 4). que en justifiant.Document 3 :
Document 4 : table de données pour la spectroscopie IR. famille liaison -1) cétone C = O 1705 - 1725 aldéhyde Ctri H C = O2700 -2900
1720 - 1740
acide carboxylique O H C = O2500 - 3200
1740 - 1800
ester C = O 1730 - 1750 alcool O HliéO Hlibre
3200 3450
3600 - 3700
Extrait 2 Bac S 2013 Amérique du sud http://labolycee.orgEXERCICE II. LES DANGERS DE L'ALCOOL (7,5 points)
Document 1
1. Spectroscopie
On se propose d'étudier la structure et les fonctions organiques de ces molécules par spectroscopie.
http://www.sciences-edu.net Document 2a : Spectroscopie Infrarouge en phase liquide. Spectre IR1On trouve dans un document publié par l'Institut suisse de prévention de l'alcoolisme (ISPA) les
informations suivantes : Quand une personne consomme de l'alcool, celui-ci commence immédiatement à passer dans le sang. Plus le passage de l'alcool dans le sang est rapide, plus le taux d'alcool dans le sangaugmentera rapidement, et plus vite on sera ivre. L'alcool est éliminé en majeure partie par le foie.
Dans le foie, l'alcool est éliminé en deux étapes grâce à des enzymes. Dans un premier temps,
l'alcool est transformé en éthanal par l'enzyme alcool déshydrogénase (ADH). L'éthanal est une
substance très toxique, qui provoque des dégâts dans l'ensemble de l'organisme. Il attaque les
membranes cellulaires et cause des dommages indirects en inhibant le système des enzymes.Dans un deuxième temps, l'éthanal est métabolisé par l'enzyme acétaldéhyde déshydrogénase
(ALDH). www.sfa-ispa.chAlcool pur : Ethanol : C2H6O
Enzyme ADH
Ethanal C2H4O
Dégradation ultérieure...
Synthèse du cholestérol
http://www.sciences-edu.net Document 2b : Spectroscopie Infrarouge en phase liquide. Spectre IR2Liaison C - C C - O C = O (carbonyle) C - H O - H
Nombre d'onde
(cm-1) 1000-1250 1050-1450 1650-1740 2800-3000 3200-3700 Document 2c : Table de données pour la spectroscopie IR1.1. Le document 1 évoque les molécules d'éthanol et d'éthanal : représenter en formule semi-développée
ces deux molécules et encadrer leurs fonctions caractéristiques.1.2. Quel est le nom du groupe fonctionnel porté par l'éthanol ? À quelle famille appartient cette molécule ?
1.3. Quel est le nom du groupe fonctionnel porté par l'éthanal ? À quelle famille appartient cette molécule ?
1.4. En utilisant les données spectroscopiques du document 2, associer chaque spectre infrarouge (IR) à la
molécule correspondante en justifiant.Accès à la correction
Extrait 3 Bac S 2017 Antilles http://labolycee.orgEXERCICE III : (5 points)
Table de données pour la spectroscopie IR :
Liaison -1) Intensité
OH alcool libre 35003700 forte, fine
OH alcool lié 32003400 forte, large
OH acide carboxylique 25003200 forte à moyenne, largeNH amine 31003500 moyenne
NH amide 31003500 forte
NH amine ou amide 15601640 forte ou moyenne
CH 28003300 moyenne
C=O amide 16501740 forte
C=O aldéhyde et cétone 16501730 forte
C=O acide 16801710 forte
la présence de molécules organiques. Parmi les molécules détectées sur la comète " Tchouri dans une comète. Parmi celles- C O CH2 CH3 H C OCH3NH2
propanal éthanamideAssocier, en le justifiant, chacun des spectres IR ci-dessous à une des deux molécules précédentes.
Spectre IR n°1
Spectre IR n°2 Accès à la correction
Source : National Institute of Advanced Industrial Science and Technology - http://sdbs.db.aist.go.jp
40003000
2000
1500
1000
500
100
50
0
Transmittance
-1) 40003000
2000
1500
1000
500
100
50
0
Transmittance
-1) Extrait 4 Bac S 2013 Pondichéry http://labolycee.orgExercice II Molécul
est une molécule de formule brute C13H18O2. Son nom en nomenclature officielle est acide2-(4-isobutylphényl)propanoïque.
De par ses propriétés anti-inflammatoire, antalgique et antipyrétique, elle constitue le principe actif de divers médicaments. Cet exercice comporte trois parties indépendantes conduisant à étudier la structure de la moléculeèse dans le cadre de la chimie
Partie 1 : La molécul
Les spectroscopies IR (infrarouge) et de RMN (résonance magnétique nucléaire) en sont deux
exemples.1.3.1. IR (document 1) en
exploitant les données du document 2.Accès à la correction
CH H3C C O OH CH3 CHCH3 CH2
C CH CH C HC HCFormule semi-développée
Document 2
iquesDocument 1
Extrait 5 Bac S 2013 Liban Exercice I. ACIDE LACTIQUE ET MÉDECINE ANIMALE (7 points) http://labolycee.org1. Lacide lactique
La formule semi-développée de lacide lactique est la suivante : H3C CH C1.2. Analyse spectroscopique
Accès à la correction
1.2.1. Parmi les spectres IR proposés dans le document 1 ci-après, choisir en justifiant celui
correspondant à lacide lactique. Accès à la correctionDocument 1 : Spectres IR
Spectre IR n°1
Spectre IR n°2
Donnée : bandes dabsorption en spectroscopie IRLiaison CC C=O OH (acide
carboxylique) CH OH (alcool)Nombre
1) 1000 - 1250 1700 - 1800 2500 - 3200 2800 - 3000 3200 - 3700
O OH OH Extrait 1 Bac S 2013 Amérique du nord Correction © http://labolycee.org EXERCICE I : ASPIRINE ET PRÉVENTION CARDIOVASCULAIRE (8,5 points)2.2.1. (0,5 pt)
Retour vers le sujet
Acide éthanoïque méthanoate de méthyle2.2.2. (0,5 pt)
thanoate de méthyle. Extrait 2 Bac S 2013 Amérique du sud CORRECTION © http://labolycee.orgEXERCICE II. LES DANGERS DE L'ALCOOL (7,5 points)
1. Spectroscopie
1.1. Formules semi-développées Retour vers le sujet
Éthanol Éthanal
CH3CH2OH
1.2. Groupe fonctionnel hydroxyle 1.3. Groupe fonctionnel carbonyle
Famille : alcool Famille : aldéhyde
1.4. Le spectre IR2 montre une bande large et intense autour de 3300 cm1 qui caractérise le groupe
anol.Le spectre IR1 montre une bande fine et intense autour de 1700 cm1 qui caractérise le groupe carbonyle de
thanal. CH3 C O OH CH O O CH3Bande à 2500 3200 cm-1
Caractéristique de la liaison OH
Bande à 1740 1800 cm-1
Caractéristique de la liaison C = O
Bande à 1730 1750 cm-1
Caractéristique de la liaison
C =0 de
CH3 CH
O Extrait 3 Bac S 2017 Antilles Correction © http://labolycee.orgEXERCICE III
Retour vers le sujet
3100 et 3500 cm-1. Or cette bande caractérise la fonction amide.
Le spectre IR n°1 est celui
Le spectre IR n°2 est celui du propanal.
La bande relative aux vibrations de la liaison C=O est présente dans les deux spectres mais les e de distinguer les deux molécules avec certitude sur ce critère.Spectre IR n°1
Spectre IR n°2
Extrait 4 Bac S 2013 Physique Chimie Pondichéry CORRECTION © http://labolycee.orgExercice
1.3.1. (0,5 pt) La bande n°1 est fine, de forte intensité et correspond à u
1700 cm-1 e.
(0,5 pt) La bande n°2 est large et centrée autour de = 3000 cm-1, elle peut caractériser les liaisons
C H ou/et la liaison O-
Retour vers le sujet
40003000
2000
1500
1000
500
100
50
0
Transmittance
-1) 40003000
2000
1500
1000
500
100
50
0
Transmittance
-1) Extrait 5 EXERCICE I : ACIDE LACTIQUE ET MÉDECINE ANIMALE (7 points)CORRECTION © http://labolycee.org
1.2.1. (0,5 pt) Analyse spectroscopique Retour vers le sujet
Le spectre n°1 correspond à l sente que dans le spectre n°1.Bande fine vers 1750 cm-1
caractéristique de la liaison C = OBande large qui peut englober la
liaison O H (alcool) entre 3200 et3700 cm-1 et la liaison O H de
lique (2500 3200 cm-1), non présente dans le deuxième spectrequotesdbs_dbs1.pdfusesText_1[PDF] exercices corrigés spectroscopie rmn
[PDF] exercices corrigés spectroscopie uv visible pdf
[PDF] exercices corrigés spss
[PDF] exercices corrigés stabilité des systèmes asservis
[PDF] exercices corrigés statique du solide
[PDF] exercices corrigés structure des molécules 1ere s
[PDF] exercices corrigés structures de données langage c
[PDF] exercices corrigés suites 1ere es
[PDF] exercices corrigés suites 1ere s
[PDF] exercices corrigés suites arithmético géométriques terminale es
[PDF] exercices corrigés suites arithmétiques géométriques pdf
[PDF] exercices corrigés suites numériques bac pro pdf
[PDF] exercices corrigés suites terminale s pdf
[PDF] exercices corrigés sur fichierprogrammation c
