 Chimie analytique 3 ème année docteur en pharmacie Série TD 8
Chimie analytique 3 ème année docteur en pharmacie Série TD 8
Série TD 8 <La spectroscopie atomique>. Exercice 01 : En absorption atomique le Zn absorbe à 213856 nm. Son nombre quantique vaut 3. Quelle est l'énergie en
 Examen Méthodes spectroscopiques 2
Examen Méthodes spectroscopiques 2
16 déc. 2010 -‐ En absorption atomique quel(s) paramètre(s) va (vont) influencer ... -‐ En spectroscopie UV-‐visible pour mesurer l'absorbance à 250 nm d ...
 Epreuve Finale Méthodes dAnalyse Spectroscopiques 30/09/2020
Epreuve Finale Méthodes dAnalyse Spectroscopiques 30/09/2020
30 sept. 2020 Exercice 1 : 1. Quel est le principe de la spectrométrie d'absorption atomique (SAA) ainsi que la spectrométrie d'émission atomique (SEA)?. 2 ...
 TD N°6 Spectrométries dabsorption et démission atomiques
TD N°6 Spectrométries dabsorption et démission atomiques
Exercice 1 : En absorption atomique le zinc absorbe à 213.856 nm
 COURS ET EXERCICES DE CHIMIOMETRIE
COURS ET EXERCICES DE CHIMIOMETRIE
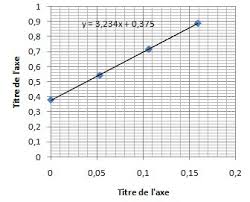
corrigé. En absence d'erreur systématique la moyenne doit 3 L'analyse d'un ensemble de solution patron de plomb par spectrométrie d'absorption atomique.
 Untitled
Untitled
1) Donner le principe de la spectroscopie d'absorption atomique. 2) 5 mL d'une solution de l'échantillon de concentration inconnue sont dilués à 100 mL. L'
 Polycopies-En: Spectroscopie Optique et RMN
Polycopies-En: Spectroscopie Optique et RMN
Une série d'exercices corrigés est donnée à la fin de chaque chapitre. Le polycopié est composé de quatre chapitres : • Chapitre I : Rappel sur la structure de
 EXERCICES ÉPREUVE CHIMIE 1
EXERCICES ÉPREUVE CHIMIE 1
On place dans un spectrophotomètre une cuve de largeur l contenant une solution d'éosine de concentration molaire c = 10.10-5 mol.L-1. A température constante
 EXERCICES ÉPREUVE CHIMIE 1
EXERCICES ÉPREUVE CHIMIE 1
On place dans un spectrophotomètre une cuve de largeur l contenant une solution d'éosine de concentration molaire c = 10.10-5 mol.L-1. A température constante
 Spectrométrie dabsorption atomique : 1. Problèmes généraux. 2
Spectrométrie dabsorption atomique : 1. Problèmes généraux. 2
spectrométrie d'absorption atomique. 30. Sources à spectres de raies. 32. Sources d ... corrigés ou d'un étalonnage défectueux. Pratiquement le contrôle de ...
 Examen Méthodes spectroscopiques 2
Examen Méthodes spectroscopiques 2
16 déc. 2010 Il est possible de doser simultanément par spectroscopie ... En absorption atomique quel(s) paramètre(s) va (vont) influencer la ...
 Chimie analytique 3 ème année docteur en pharmacie Série TD 8
Chimie analytique 3 ème année docteur en pharmacie Série TD 8
Série TD 8 <La spectroscopie atomique>. Exercice 01 : En absorption atomique le Zn absorbe à 213856 nm. Son nombre quantique vaut 3.
 Untitled
Untitled
Exercice N°3 (15 points). Spectrométrie d'absorption atomique (flamme) et méthode des ajouts dosés. Dans le vin l'ajout de cuivre (à partir des sels de
 EXERCICES ÉPREUVE CHIMIE 1
EXERCICES ÉPREUVE CHIMIE 1
c). A ? = 500 nm une solution alcoolique d'éosine de concentration molaire c' = 1
 COURS ET EXERCICES DE CHIMIOMETRIE
COURS ET EXERCICES DE CHIMIOMETRIE
C'est par exemple le cas en spectrométrie d'absorption La méthode d'analyse n'est réellement corrigée que si en l'absence de l'analyte considéré
 Untitled
Untitled
1) Donner le principe de la spectroscopie d'absorption atomique. 2) 5 mL d'une solution de l'échantillon de concentration inconnue sont dilués à 100 mL.
 Exercices : autour des spectres démission et dabsorption
Exercices : autour des spectres démission et dabsorption
Exercice 6 : spectroscopie d'émission de l'atome d'hydrogène. Un nuage peu dense d'atomes d'hydrogène est éclairé par un rayonnement UV.
 Faculté de médecine 2019/ 2020 Département de Pharmacie
Faculté de médecine 2019/ 2020 Département de Pharmacie
Exercice 1 : En absorption atomique le zinc absorbe à 213.856 nm
 Exercice n°1 : (8 points) Ici absorption de ? à partir du niveau n=2
Exercice n°1 : (8 points) Ici absorption de ? à partir du niveau n=2
1. Quelle est l'orbitale atomique associée aux nombres quantiques n=2 ; l=2 et m=0 ? Impossible car l doit
 SPÉCIALITÉ PHYSIQUE CHIMIE COURS
SPÉCIALITÉ PHYSIQUE CHIMIE COURS
1.2 Spectroscopie d'absorbance . On retrouve la masse molaire atomique de chaque ... Exemples Voir la fiche d'exercices corrigés.
 Spectrométrie d’absorption atomique - Université Laval
Spectrométrie d’absorption atomique - Université Laval
Le contact entre les atomes et la source lumineuse est assuré par la cellule d’absorption La cellule d’absorption est en fait une flamme générée par la combustion d’acétylène en présence d’oxygène L’échantillon à analyser est aspiré par l’appareil et transformé en aérosol La flamme
 Spectrométrie d’absorption atomique
Spectrométrie d’absorption atomique
Les spectroscopies IR (infrarouge) et de RMN (résonance magnétique nucléaire) en sont deux exemples 1 3 1 Donner l’origine des bandes d’absorption 1 et 2 du spectre infrarouge IR (document 1) en exploitant les données du document 2 Accès à la correction
 Exercices : autour des spectres d’émission et d’absorption
Exercices : autour des spectres d’émission et d’absorption
Exercices : autour des spectres d’émission et d’absorption Exercice 6 : spectroscopie d’émission de l’atome d’hydrogène Un nuage peu dense d’atomes d’hydrogène est éclairé par un rayonnement UV polychromatique continu qui renferme toutes les longueurs d’onde dans un intervalle
 LPro Spectro 1011 - u-bourgognefr
LPro Spectro 1011 - u-bourgognefr
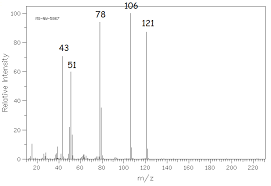
Figure’4:spectre!13C5RMN!du!composéII’ A Spectredemasse! 1D Donner!la!valeur!du!pic!de!base!et!de!l’ion!moléculaire ! 2D Déterminer!la!formule!moléculaire
 Exercices : autour des spectres d’émission et d’absorption
Exercices : autour des spectres d’émission et d’absorption
Exercices : autour des spectres d’émission et d’absorption données numériques pour l’ensemble des exercices • Constante de Planck : h = 663 10-34 J s • Célérité de la lumière : 300 108 m s-1 • Constante d'Avogadro : N = 602 1023 mol-1 • 1 eV correspond à 16 10-19 J Exercice 1 : flux de photons
 leay:block;margin-top:24px;margin-bottom:2px; class=tit maguenefste-monsitecomUniversité Cheikh Anta DIOP Faculté des Sciences & Techniques
leay:block;margin-top:24px;margin-bottom:2px; class=tit maguenefste-monsitecomUniversité Cheikh Anta DIOP Faculté des Sciences & Techniques
Exercice II Spectre d’absorption IR de l’oscillateur anharmonique de 12C=16O (8 pts) On étudie le spectre d’absorption de l’oscillateur anharmonique 12C=16O 1) Rappeler les règles de sélection en absorption dans le cas anharmonique
 Histoire de la chimie La spectroscopie d’absorption atomique
Histoire de la chimie La spectroscopie d’absorption atomique
spectroscopie d’absorption atomique (AAS) fut découverte en 1955 par Alan Walsh Or cet énoncé est assez réducteur dans la mesure où il occulte l’ampleur des tâches à accom-plir autant que l’importance de s motivations de la volonté de réussir et d’aller jusqu’au bout [1] Après avoir rappelé quelle
 2- METHODES ET TECHNIQUES - univ-paufr
2- METHODES ET TECHNIQUES - univ-paufr
2 1 4 4 - Spectrométrie d’absorption atomique Principe : L’élément à doser est dissocié le plus souvent dans une flamme et placé dans un état « fondamental » On mesure alors son absorption sur des longueurs d’onde caractéristiques
Qu'est-ce que la spectrométrie d'absorption atomique ?
- La spectrométrie d’absorption atomique permet de quantifier les éléments métalliques en solutions. Chaque élément a un nombre spécifique d’électrons associés à son noyau. La configuration orbitale normale et la plus stable des électrons est appelée état de base.
Comment fonctionne l’absorption atomique ?
- Lors du procédé d’absorption atomique l’énergie fournie à l’atome provient d’une source lumineuse appelée lampe à cathode creuse. L’atome dans son état de base absorbe l’énergie lumineuse à une longueur d’onde spécifique et passe à un état d’excitation.
Comment fonctionne une cellule d’absorption ?
- La cellule d’absorption est en fait une flamme générée par la combustion d’acétylène en présence d’oxygène. L’échantillon à analyser est aspiré par l’appareil et transformé en aérosol. La flamme atomise ensuite les éléments contenus dans l’aérosol et les place en travers du faisceau de la lampe à cathode creuse.
Comment le contact entre les atomes et la source lumineuse est assuré par la cellule d’absorption ?
- Le contact entre les atomes et la source lumineuse est assuré par la cellule d’absorption. La cellule d’absorption est en fait une flamme générée par la combustion d’acétylène en présence d’oxygène. L’échantillon à analyser est aspiré par l’appareil et transformé en aérosol.
COURS ET EXERCICES DE CHIMIOMETRIE
DR HAMIDA S. 1
Introduction :
Un chimiste se confronte quotidiennement à déterminer une réponse qualitative ou quantitative.
e la fiabilité des résultats, de devoir les valider et valider aussi la méthode savoir comment cribler les valeurs aberrantes du lot des résultats obtenusriences sont aussi des connaissances à acquérir pour pouvoir gérer ces expériences tout en gagnant
du temps et du cout.I.1 Définition de la chimiométrie :
La Chimiométrie ou Chemometrics a une double paternité celle du suédois Svante Wold et de y- tique. Elle est aussi à partir des données physico- aussi Analyse multivariable (mutivariée). ¾ Elle peut traiter des systèmes complexes généralement multivariables.¾ ue, des sciences de la vie,
économie, sociologie, et informatique.
¾ Elle est basée sur des règles mathématiques strictes et des démarches rigoureuses de la part
de l'expérimentateur.¾ La chimiométrie (ou analyse multivariable) en instrumentation consiste à modéliser les va-
n certain nombre de variables (Y variables) nécessitant une analyse chimique par variables) mesurables facilement (mesure de cap- premières.I.Incertitude de mesure:
titude est essentielle dans la démarche expérimentale. Sans elle on ne peut pas juger la qualité et la fiabilité de la mesure ou résultat.Un résultat peut être :
- Juste ou faux (il faut savoir une référence à laquelle le résultat sera comparé).COURS ET EXERCICES DE CHIMIOMETRIE
DR HAMIDA S. 2
- Précis ou imprécis tel le montre la figure I.1.Pour cela il existe :
- des méthodes de calcul des incertitudes. - des tests de comparaison du résultat à d'autres ou à un étalon. Juste et précis faux et imprécis faux et précis Erreur faible erreur systématique erreur faibleEt aléatoire
Figure I.1 :
I.3 L:
L'erreur est l'écart (différence) entre la valeur mesurée et la valeur vraie. Par contre l'incertitude
est un paramètre qui indique la dispersion des résultats des mesures. Le calcul statistique n'est possible que si l'on a accès à une valeur moyenne. Pour cela on effectue plusieurs mesures. La plupart vont être proche d'une valeur moyenne, parfois quelques-unes sont très écartées. En analyse chimique le nombre des mesures sur un même échantillon est
souvent inférieur à 5.I.4 Types des erreurs :
Les erreurs expérimentales peuvent être classées en systématiques et aléatoires :a) Erreur systématique : elle est appelée aussi erreur déterminée, qui peut être détecté et
COURS ET EXERCICES DE CHIMIOMETRIE
DR HAMIDA S. 3
erreurs de méthodes. urette non calibrée, de la contamination de la superficie intérieure du matériel volumétrique, etc. Les erreurs de méthodes peuvent provenir du comportement physique ou chimique non idéal actif non spécifique, existence deréactions secondaires qui interfère avec le processus de mesure). Par exemple en analyse
espèce à déterminer sous forme de solide de grande pureté. vé, il sera contaminé par autres substances qui fausseront alors lab) Erreur aléatoire : appelée aussi erreur indéterminée ou erreurs personnelles. Elles
Elles peuvent provenir
valorisation. Les erreurs de calculs, transposition de numéros en notant les données, inversion de
es. Le bruit électrique et les (deux sens) corrigé. En absence d'erreur systématique, la moyenne doit coïncider à la valeur réelle.L'intervalle des valeurs dépend de :
- La précision des mesures (déviation standard). - numéro de mesures réalisées.I.5 Sources des erreurs :
interférences, desincertitudes de masse, des équipements volumétriques et des erreurs aléatoires. Ils peuvent aussi
provenir des conditions de conservation et stockage, de la pureté des réactifs (les produits non pures
COURS ET EXERCICES DE CHIMIOMETRIE
DR HAMIDA S. 4
à 100% peuvent contenir des isomères et sels organiques) et des conditions de mesure (température
La figure I.2 illustre clairement les différentesFigure I.2 : Les différentes
I.6 Propagation des erreurs aléatoires :
Le tableau ci-dessous résume la propagation des erreurs aléatoires dans les calculs arithmétiques :
Tableau I.1 : calcul des erreurs aléatoires.
Type de calcul Exemples Deviation standard
Addition et soustraction
Multiplication et division
Exponentiation
Logarithme
Y=a+b-c
Y= c ba Y=axY=Log10 a
222cbayssss 222
quotesdbs_dbs8.pdfusesText_14
[PDF] exercices corrigés spectroscopie rmn
[PDF] exercices corrigés spectroscopie uv visible pdf
[PDF] exercices corrigés spss
[PDF] exercices corrigés stabilité des systèmes asservis
[PDF] exercices corrigés statique du solide
[PDF] exercices corrigés structure des molécules 1ere s
[PDF] exercices corrigés structures de données langage c
[PDF] exercices corrigés suites 1ere es
[PDF] exercices corrigés suites 1ere s
[PDF] exercices corrigés suites arithmético géométriques terminale es
[PDF] exercices corrigés suites arithmétiques géométriques pdf
[PDF] exercices corrigés suites numériques bac pro pdf
[PDF] exercices corrigés suites terminale s pdf
[PDF] exercices corrigés sur fichierprogrammation c
