 Corrigé
Corrigé
8 juin 2017 Exercice 2 : Etude d'une pompe à chaleur ( 6 points ). On souhaite ... Sur le diagramme enthalpique du R134a (page 5/10) placez les points ...
 Installations Thermiques Industrielles Présenté par : Dr BAKI
Installations Thermiques Industrielles Présenté par : Dr BAKI
Cours Exercices Corrigés et Travaux Pratiques. Page 2. 2. Page 3. 3. Table des Diagramme enthalpique du cycle frigorifique : diagramme de Mollier. Sous la ...
 «EXERCICES ET PROBLEMES CORRIGES DE
«EXERCICES ET PROBLEMES CORRIGES DE
Exercices et problèmes corrigés de thermodynamique chimique. 67. Définitions et notions devant être acquises : Diagramme de phase d'un corps pur –. Relation de
 Cours et exercices résolus De la Thermodynamique Appliquée
Cours et exercices résolus De la Thermodynamique Appliquée
- Diagramme de Mollier (P H). Figure I-3 : Diagramme de Clapeyron. I-8 Exercice corrigé du chapitre III. 36. Exercice 01 : Un gaz subit un cycle de Carnot ...
 Diagrammes et tables thermodynamiques
Diagrammes et tables thermodynamiques
3 janv. 2023 ▷ diagramme de Mollier (h s) : isobares (diphasé) et isothermes ... Exercice 1 : Lecture du diagramme des frigoristes. 1
 Travaux dirigés des installations frigorifiques Série N°2 Exercice 1
Travaux dirigés des installations frigorifiques Série N°2 Exercice 1
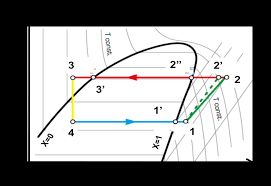
On réalise une machine frigorifique dont le fluide frigorifique est le fréon. Le schéma de cette machine est le suivant (Fig. 1):. Le diagramme de Mollier (
 Machines thermiques
Machines thermiques
Donner la nouvelle valeur du coefficient e. Exercice 9 : Diagramme de Mollier cd= 12 K. Correction de l'exercice 2. 1. On peut appliquer la loi de Laplace ...
 TD5 : Partie séchage Exercice1 Pour lair dune pièce où la
TD5 : Partie séchage Exercice1 Pour lair dune pièce où la
Exercice 2. Si l'air de l'exemple ➢ Quantité d'eau éliminée pendant les deux séchages : toutes les valeurs sont tirées du diagramme (voir les deux schémas).
 CAP FROID ET CLIMATISATION EPREUVE EP1 A PARTIE
CAP FROID ET CLIMATISATION EPREUVE EP1 A PARTIE
Corrigé. EP1 A : Réalisation et technologie (partie écrite) Durée 4h Coefficient 10 - Le diagramme enthalpique page 6/13 pour déterminer la chute de pression.
 Les bases de la thermodynamique. Cours et exercices corriges
Les bases de la thermodynamique. Cours et exercices corriges
Cours et exercices corrigés. Les bases de la thermodynamique. 3 e édition. Page 4 7.4.3 Le diagramme enthalpique. 198. Exercices. 202. Solutions. 205.
 Corrigé
Corrigé
8 juin 2017 Exercice 1 : Grandeurs et relations thermodynamiques (3.0 points) ... Sur le diagramme enthalpique du R134a (page 5/10) placez les points 1 ...
 Exercices sur
Exercices sur
On place les points 1 (abaque P
 Machines thermiques
Machines thermiques
Corrigés en TD : Centrale Beau de Rochas et Carnot
 Machines thermiques
Machines thermiques
Corrigés en TD : Centrale Beau de Rochas et Carnot
 Machines thermiques Machines thermiques
Machines thermiques Machines thermiques
Exercice 2 : Rafraîchir sa cuisine en ouvrant son frigo 3 - En fin d'énoncé figure le diagramme enthalpique (P h) de l'eau. ... ATS 2012 Corrigé.
 SERIE DEXERCICES N° 27 : THERMODYNAMIQUE : CORPS PUR
SERIE DEXERCICES N° 27 : THERMODYNAMIQUE : CORPS PUR
Exercice 1 : détente d'une vapeur d'eau dans une machine à vapeur. Dans le diagramme entropique ( T s ) de la figure
 THERMODYNAMIQUE
THERMODYNAMIQUE
Dans un diagramme d'Amagat (PV P) les isothermes d'un gaz parfait de machines à vapeur de même que le diagramme de Mollier (voir ci-dessous) ...
 Examen de thermodynamique Porter une attention particulière à la
Examen de thermodynamique Porter une attention particulière à la
Durée : 3h l'exercice et les deux problèmes sont indépendants appelé R134a) dont le diagramme enthalpique est donné en annexe.
 Transfert de vapeur deau
Transfert de vapeur deau
Les propriétés de l'air humide sont résumées par le diagramme de MOLLIER. L'observation de celui-ci permet d'observer les phénomènes suivants : -Lorsque la
 Série 5 - Complément de corrigé : I Diagramme
Série 5 - Complément de corrigé : I Diagramme
Exercices de Physique du Bâtiment I Série 5 - Complément de corrigé : I Diagramme psychrométrique (Mollier): «Mode d'emploi» II Questions III Problèmes 1-3 Silvia Coccolo & Nikos Zarkadis Physique du bâtiment I – Série 5 d’exercices 1
 Exercices Orbitales moléculaires - blablareau-chimiefr
Exercices Orbitales moléculaires - blablareau-chimiefr
On réalise une machine frigorifique dont le fluide frigorifique est le fréon Le schéma de cette machine est le suivant (Fig 1): Le diagramme de Mollier (enthalpie – pression) du fréon représenté ci-dessous (Fig 2) sera utilisé pour tracer le cycle frigorifique de cette machine Figure 1 Figure 1
 Chimie quantitative – mole masse molaire volume molaire
Chimie quantitative – mole masse molaire volume molaire
température et de pression 6700 litres Exercice 6 Le sulfate de cuivre hydraté a pour formule CuSO45H2O 1) Calculer la masse molaire du sulfate de cuivre hydraté 2497 g/mol 2) Déterminer le nombre de moles contenues dans une masse de 20 g de ce produit 8 x 10-2 mol
 Travaux dirigés d’automatique N 1 - u-strasbgfr
Travaux dirigés d’automatique N 1 - u-strasbgfr
On désire modéliser le système d’entraînement des têtes de lecture/écriture d’un disque dur Le bras supportant ces têtes est en rotation autour d’un axe et sa position est donnée par la grandeur ? Un actionneur électromagnétique permet de le mouvoir Le bras a une inertie J et son axe a un coe?cient de frottement visqueux f
 Corrigé /20
Corrigé /20
passant par le point 2 Etude du cycle : 1 Le diagramme T-s fourni permet de visualiser l'évolution de l'eau au cours du cycle Indiquer sur ce diagramme : La courbe de rosée La courbe d'ébullition Le point critique La zone liquide vapeur et la zone diphasique 2 Représenter le cycle sur le diagramme T-s fourni (page 10/10) 3
 Forces et interactions – Exercices – Devoirs
Forces et interactions – Exercices – Devoirs
3) Construis le diagramme objet-interaction Terre-Lune Terre/Lune Lune Terre Un joueur de rugby court avec le ballon dans sa main 1) Fais I'inventaire des actions s'exerçant sur le ballon 2) Identifie les interactions de contact et les interactions à distance 3) Construis le diagramme objet-interaction du bal Ion
 CHAPITRES V-VI : DIAGRAMMES D’EQUILIBRE (TD) - ensmpfr
CHAPITRES V-VI : DIAGRAMMES D’EQUILIBRE (TD) - ensmpfr
T = température de fusion (donnée par les diagrammes d’équilibre des autres exercices de ce chapitre) T = 500°C température typique de remise en solution des alliages d’aluminium Note : le résultat de cet exercice sera utilisé dans le Chapitre XXI sur les traitements thermiques des alliages d’aluminium Rappel : R = 8314 J
 TP1 : Diagramme de Cas d’Utilisations - Corrigés - azammouri
TP1 : Diagramme de Cas d’Utilisations - Corrigés - azammouri
d’indiquer au système de libérer des emplacements Le chargement et le déchargement sont réalisés manuellement Les employés de l’entrepôt sont sous la responsabilité d’un chef dont le rôle est de superviser la bonne application des consignes A l’aide d’un diagramme de cas d’utilisations modéliser ce système Corrigé :
 TP2 : Diagramme de Classes - Corrigés - azammouri
TP2 : Diagramme de Classes - Corrigés - azammouri
même salle de cours (chacune ayant un nombre de places déterminé) On désire pouvoir calculer la moyenne par matière ainsi que par département - On veut également calculer la moyenne générale d’un élève et pouvoir afficher les matières dans lesquelles il n’a pas été noté
 Correction du devoir de Cours sur UML - Charlie-Soft
Correction du devoir de Cours sur UML - Charlie-Soft
3) Donner le nom de ce diagramme et expliquez brièvement de qu'il représente : Le piège du devoir ! En effet ce n’est pas un diagramme de collaboration mais la modélisation d’une collaboration dans les diagrammes de classe Cela permet de représenter quelles classes travaillent à un cas d’utilisation Il représente
 QCM UML corrigé - Université Sorbonne Paris Nord
QCM UML corrigé - Université Sorbonne Paris Nord
La question n'est pas tant le nombre de classes les modélisations peuvent différer mais sur l'impact du choix des interfaces pour les combinaisons (combinaisons statiques avec l'heritage dynamiques avec les interfaces) Q14 Quel(s) type(s) de relations sont permises entre des cas d'utilisation ? (plusieurs choix possibles) Association
 Searches related to exercices corrigés sur le diagramme de mollier filetype:pdf
Searches related to exercices corrigés sur le diagramme de mollier filetype:pdf
Exercices Orbitales moléculaires Exercices Orbitales moléculaires Cours Approximations fondamentales 1 Rappeler succinctement les approximations fondamentales mises en place pour obtenir les orbitales moléculaires et les énergies correspondantes dans une molécule
Comment établir le diagramme d’orbitales moléculaires du chlorure d’hydrogène ?
- On cherche à établir le diagramme d’orbitales moléculaires du chlorure d’hydrogène sachant que l’énergie de l’orbitale atomique 1s de l’hydrogène est – 13,6 eV et que pour le chlore, on ne prend en compte que les orbitales atomiques 3p d’énergie -13,0 eV. L’énergie de l’OA 3s du chlore est beaucoup plus basse (-29,1 eV).
Qu'est-ce que le rôle dans un diagramme de classes ?
- Un rôle (dans un diagramme de classes UML) se traduit-il en Java par ? X un nom de variable une association un constructeur une opération Q12. Des véhicules sont dotés de châssis et de propulsions. Différents types de châssis permettent aux véhicules de rouler, voler ou bien flotter.
Comment calculer le schéma fonctionnel d’un moteur?
- Etablir le schéma fonctionnel du moteur en faisant apparaître les grandeurs U, I, ? et ?, ainsi qu’une entrée de perturbation de couple P venant s’additionner au couple moteur. 2. Simpli?er ce schéma de manière à obtenir la relation ?(s) = F(P(s),U(s)).
Comment calculer la masse molaire d’un élément ?
- Chimie quantitative – mole, masse molaire, volume molaire Chimie quantitative – mole, masse molaire, volume molaire Exercice 1 Une mole d’atomes est la quantité de matière qui contient 6,02 x 1023atomes identiques. Le nombre d’Avogadro est égal à 6,02 x 1023 La masse molaire atomique d’un élément est la masse d’une mole d’atomes de cet élément.
Série d'exercices 27 1
SERIE D'EXERCICES N° 27 : THERMODYNAMIQUE : CORPS PUR DIPHASE EN EQUILIBRE Exercice 1 : détente d'une vapeur d'eau dans une machine à vapeur.Dans un cycle de machine à vapeur, la phase motrice est une détente de la vapeur d'eau dans un cylindre fermé par un piston mobile.
Cette détente est suffisamment rapide pour que les transferts thermiques n'aient pas le temps d'être quantitatifs : nous supposons
donc la détente adiabatique. Pour simplifier, nous la supposons aussi réversible, ce qui suppose notamment que les frottements sont
négligeables. Il en résulte que la détente est isentropique.Dans le diagramme entropique ( T , s ) de la figure, l'évolution isentropique I ® F est représentée par le segment vertical IF . L'état
initial I correspond à une vapeur saturante sèche ( xV1 = 1 ) à la température T1 = 485 K (à la pression P1 = f (T1) = 20 bar ). L'état final
F correspond à une vapeur saturante à la température T2 = 373 K (à la pression P2 = f (T2) = 1 bar ). Calculer le titre en vapeur xV2 dans
l'état final dans les deux cas suivants :1. on dispose des tables thermodynamiques complètes ci-dessous :
2. on ne dispose cette fois que de l'enthalpie massique de vaporisation à T
1 = 485 K : l1 = 1 892 kJ.kg-1 ; à T2 = 373 K : l2 = 2 258
kJ.kg-1 et de la capacité thermique massique de l'eau c = 4,18 kJ.K-1.kg-1 (supposée indépendante de la température); on envisagera
dans ce cas le chemin IL1L2F indiqué sur le diagramme entropique ci-dessous :
3. Comparer les résultats obtenus dans les deux cas.
Exercice 2 : détente de Joule-Kelvin d'un fréon dans une machine frigorifique.Dans une machine frigorifique, un fréon (chlorofluoroalcane) subit une détente de Joule-Kelvin de l'état A à l'état B (voir le
diagramme de Clapeyron ci-dessous). x désignant le titre en vapeur, on donne TA = 303 K ; PA = f (TA) = 7,5 bar ; xA = 0 ; TB = 263 K ; PB = f (TB) = 2,2 bar ; l'enthalpie
massique de vaporisation à T = 263 K notée l263 = 159 kJ.kg-1 et la capacité thermique massique du fréon liquide
c = 0,96 kJ.K-1.kg-1 (supposée indépendante de la température).Calculer :
1. le titre massique en vapeur xB dans l'état final ;
2. la création d'entropie massique lors de la détente envisagée, commenter son signe.
Nathalie Van de Wiele - Physique Sup PCSI - Lycée les Eucalyptus - NiceSérie d'exercices 27 2
Exercice 3 : détente d'un liquide dans le vide.On place une ampoule contenant m = 0,01 kg d'eau liquide dans une enceinte indéformable de volume V maintenue au contact d'un
thermostat à la température T0 = 373 K . Initialement l'enceinte est vide et l'eau dans l'ampoule est à la température T0 et sous une
pression initiale P0 égale à la pression de vapeur saturante P0 = f (T0) = 1,0 bar . On assimile la vapeur d'eau à un gaz parfait de masse
molaire M = 18 g.mol-1 . On donne l'enthalpie de vaporisation de l'eau à la température T0 : lv = 2,3.103 kJ.kg-1 . On néglige le volume
massique de l'eau liquide devant le volume massique de la vapeur d'eau. On donne R = 8,314 J.K-1.mol-1 .
1.a) Calculer la valeur particulière V
C du volume V pour que dans l'état d'équilibre final, l'eau soit à la température T0 et à la pression
de vapeur saturante P0 = f (T0) = 1,0 bar , avec un titre en vapeur xVF = 1 .
b) Calculer pour l'évolution I ® F correspondante : · le transfert thermique Q algébriquement reçu par l'eau ;· la variation d'entropie de l'eau, l'entropie échangée par l'eau avec le thermostat, l'entropie créée ; conclure.
2. On suppose que le volume V est inférieur à la valeur VC déterminée au 1. Déterminer le titre en vapeur dans l'état d'équilibre final
en fonction de V et V C .3. On suppose cette fois que le volume V est supérieur au volume VC . Déterminer la pression dans l'état d'équilibre final en fonction
de P0 = f (T0) = 1,0 bar , V et VC .
Exercice 4 : détente isochore d'une vapeur d'eau saturante.Un récipient fermé et indéformable, de volume V = 1,00 L , contient de la vapeur d'eau saturante dans l'état initial I ( T
I = 485 K ,
PI = f (TI) = 20 bar , xVI = 1 ). On le met en contact avec un thermostat à la température T0 = 373 K . Déterminer :
a) l'état d'équilibre final F ; b) le transfert thermique Q algébriquement reçu par l'eau ;c) la variation d'entropie de l'eau, l'entropie échangée par l'eau, l'entropie créée au cours de l'évolution I ® F , commenter.
On utilisera les tables thermodynamiques de l'eau données à l'exercice 1 .Exercice 5 : transitions de phase de l'eau.
Au point triple, la température de l'eau est T T = 0,01 °C et la pression PT = 6,1.10-3 bar . Soit une quantité d'eau vapeur de masse m sous la pression P0 = 5,0.10-3 bar à la température de 0,00 °C . Comprimons
progressivement de manière isotherme cette masse jusqu'à une pression de 2 bar .Décrire les phénomènes observés et schématiser sur un diagramme ( P , T ) , d'après le cours, le chemin suivi par le système.
Donner l'allure de la courbe P = f (t) pour cette transformation ( t est le temps et on s'inspirera des résultats du TP 26 ).
Exercice 6 : glaçons dans un verre d'eau.
Des glaçons flottent à la surface de l'eau dans un verre. Que peut-on en conclure quant à la masse volumique de l'eau solide et de l'eau
liquide ? Lorsque les glaçons ont fondu, le niveau de l'eau dans le verre est-il monté ? descendu ? resté inchangé ?
Exercice 7 : diagramme de l'eau pure.
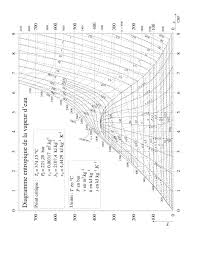
Le document donné en annexe représente le diagramme température-entropie massique ( q (°C) , s (kJ.kg-1.K-1) ) d'une masse
m = 1 kg d'eau pure.Sur ce diagramme figurent :
· en trait renforcé, les courbes d'ébullition (titre en vapeur xV = 0 : liquide juste saturé) et de rosée (titre en vapeur xV = 1 : vapeur
saturante sèche), se rejoignant au point critique ;· en trait fin continu, dans le domaine d'équilibre liquide-vapeur, les réseaux d'isotitres en vapeur : 0 < x =xV = cte < 1 ;
· en trait fin continu, dans tout le domaine du diagramme, un réseau d'isenthalpes h = cte ( h est l'enthalpie massique) et un réseau
d'isobares P = cte , confondus avec les isothermes dans le domaine d'équilibre liquide-vapeur (équilibre diphasé monovariant) ;
· en trait fin pointillé, dans tout le domaine du diagramme, un réseau d'isochores v = cte ( v est le volume massique).
Une masse d'eau juste saturante (vapeur saturante sèche) de masse m = 1 kg initialement maintenue à la pression P = 20 bar est
détendue de manière adiabatique réversible, donc isentropique, jusqu'à la pression P = 0,5 bar .
1. En utilisant le diagramme, déterminer les caractéristiques de l'état initial et de l'état final et porter les résultats dans le tableau
proposé : q (°C) xV P (bar) s (kJ.kg-1.K-1) h (kJ.kg-1) v (m3.kg-1) état 1 20 état 2 0,5Note : pour la détermination de xV2 on pourra utiliser le théorème des moments ou extrapoler les valeurs de xV entre deux isotitres ;
pour la détermination de v2 on extrapolera les valeurs de v entre deux isochores.2. En déduire les variations des fonctions d'état du système au cours de la transformation : Ds , Dh et Du .
Nathalie Van de Wiele - Physique Sup PCSI - Lycée les Eucalyptus - NiceSérie d'exercices 27 3
Annexe : diagramme température-entropie massique de l'eau pure. Nathalie Van de Wiele - Physique Sup PCSI - Lycée les Eucalyptus - NiceSérie d'exercices 27 4
Réponses.
Exercice 1.
1) xV2 = )T(s)T(s)T(s)T(s
2L2V2L1V
-- = 0,833 . 2) xV2 = )TTlncTl(lT
12 11 22- = 0,826 . 3) La cohérence des résultats valide les approximations faites pour la phase liquide.
Exercice 2.
1) xB = 263
)BA lTT(c- = 0,242 . 2) sB - sA = B 263B AB
TlxTTlnc+ = 10,4 J.K-1.kg-1 = Scréée > 0 .
Exercice 3.
1.a) V
c = 0 0 PMTRm = 17,2 L . 1.b) Qeau = m lv - P0 Vc = 21,3 kJ ; DSeau = 0 vTlm = 61,7 J.K-1 ; Séchangée = 0
eauTQ = 57,1 J.K-1 ;
S créée = DSeau - Séchangée = 4,6 J.K-1 > 0 . 2) xVf = cVV . 4) P = P0 V Vc .Exercice 4.
a) xVF = )T(v)T(v)T(v)T(v
0L0V0LIV
-- = 5,81.10-2 . b) Qeau = )T(vV IV [ xVF hV (T0) + ( 1 - xVF ) hL (T0) - hV (TI) ] + V ( PI - P0 ) = - 20, 7 kJ . b) DSeau =)T(vV IV [ xVF sV (T0) + ( 1 - xVF ) sL (T0) - sV (TI) ] = -47,1 J.K-1 ; Séchangée = 0 eauTQ = - 55,5 J.K-1 ;
S créée = DSeau - Séchangée = 8,4 J.K-1 > 0 .Exercice 5.
P L C T S V TAn a d'abord une compression isotherme de la vapeur, puis une condensation V ® S (palier en diagramme (P,t) ), puis une
compression isotherme du solide, puis une fusion S ® L (palier en diagramme (P,t) ), puis une compression isotherme du liquide.
Exercice 6.
Niveau inchangé.
Exercice 7.
1) Théorème des moments : xV = LV
LM = 0,81 ou par extrapolation entre les isotitres : xV2 = 0,81 .2) Ds = 0 ; Dh = h2 -h1 = -600 kJ.kg-1 ; Du = Dh + P1 v1 - P2 v2 = - 550 kJ.kg-1 .
quotesdbs_dbs8.pdfusesText_14[PDF] exercices corriges sur les agregats economiques pdf
[PDF] exercices corrigés sur les anneaux quotients
[PDF] exercices corrigés sur les atomes et les molécules 4eme
[PDF] exercices corrigés sur les comptes peruc pdf
[PDF] exercices corrigés sur les congruences pdf
[PDF] exercices corrigés sur les filtres actifs et passifs
[PDF] exercices corrigés sur les flux économiques pdf
[PDF] exercices corrigés sur les fonctions numériques dune variable réelle
[PDF] exercices corrigés sur les fonctions récursives
[PDF] exercices corrigés sur les glucides
[PDF] exercices corrigés sur les immobilisations corporelles
[PDF] exercices corriges sur les lois de probabilités discrètes
[PDF] exercices corrigés sur les matrices en langage c pdf
[PDF] exercices corrigés sur les nombres entiers naturels
