 Corrigé
Corrigé
8 juin 2017 Exercice 2 : Etude d'une pompe à chaleur ( 6 points ). On souhaite ... Sur le diagramme enthalpique du R134a (page 5/10) placez les points ...
 Installations Thermiques Industrielles Présenté par : Dr BAKI
Installations Thermiques Industrielles Présenté par : Dr BAKI
Cours Exercices Corrigés et Travaux Pratiques. Page 2. 2. Page 3. 3. Table des Diagramme enthalpique du cycle frigorifique : diagramme de Mollier. Sous la ...
 «EXERCICES ET PROBLEMES CORRIGES DE
«EXERCICES ET PROBLEMES CORRIGES DE
Exercices et problèmes corrigés de thermodynamique chimique. 67. Définitions et notions devant être acquises : Diagramme de phase d'un corps pur –. Relation de
 Cours et exercices résolus De la Thermodynamique Appliquée
Cours et exercices résolus De la Thermodynamique Appliquée
- Diagramme de Mollier (P H). Figure I-3 : Diagramme de Clapeyron. I-8 Exercice corrigé du chapitre III. 36. Exercice 01 : Un gaz subit un cycle de Carnot ...
 Diagrammes et tables thermodynamiques
Diagrammes et tables thermodynamiques
3 janv. 2023 ▷ diagramme de Mollier (h s) : isobares (diphasé) et isothermes ... Exercice 1 : Lecture du diagramme des frigoristes. 1
 Travaux dirigés des installations frigorifiques Série N°2 Exercice 1
Travaux dirigés des installations frigorifiques Série N°2 Exercice 1
On réalise une machine frigorifique dont le fluide frigorifique est le fréon. Le schéma de cette machine est le suivant (Fig. 1):. Le diagramme de Mollier (
 Machines thermiques
Machines thermiques
Donner la nouvelle valeur du coefficient e. Exercice 9 : Diagramme de Mollier cd= 12 K. Correction de l'exercice 2. 1. On peut appliquer la loi de Laplace ...
 TD5 : Partie séchage Exercice1 Pour lair dune pièce où la
TD5 : Partie séchage Exercice1 Pour lair dune pièce où la
Exercice 2. Si l'air de l'exemple ➢ Quantité d'eau éliminée pendant les deux séchages : toutes les valeurs sont tirées du diagramme (voir les deux schémas).
 CAP FROID ET CLIMATISATION EPREUVE EP1 A PARTIE
CAP FROID ET CLIMATISATION EPREUVE EP1 A PARTIE
Corrigé. EP1 A : Réalisation et technologie (partie écrite) Durée 4h Coefficient 10 - Le diagramme enthalpique page 6/13 pour déterminer la chute de pression.
 Les bases de la thermodynamique. Cours et exercices corriges
Les bases de la thermodynamique. Cours et exercices corriges
Cours et exercices corrigés. Les bases de la thermodynamique. 3 e édition. Page 4 7.4.3 Le diagramme enthalpique. 198. Exercices. 202. Solutions. 205.
 Corrigé
Corrigé
8 juin 2017 Exercice 1 : Grandeurs et relations thermodynamiques (3.0 points) ... Sur le diagramme enthalpique du R134a (page 5/10) placez les points 1 ...
 Exercices sur
Exercices sur
On place les points 1 (abaque P
 Machines thermiques
Machines thermiques
Corrigés en TD : Centrale Beau de Rochas et Carnot
 Machines thermiques
Machines thermiques
Corrigés en TD : Centrale Beau de Rochas et Carnot
 Machines thermiques Machines thermiques
Machines thermiques Machines thermiques
Exercice 2 : Rafraîchir sa cuisine en ouvrant son frigo 3 - En fin d'énoncé figure le diagramme enthalpique (P h) de l'eau. ... ATS 2012 Corrigé.
 SERIE DEXERCICES N° 27 : THERMODYNAMIQUE : CORPS PUR
SERIE DEXERCICES N° 27 : THERMODYNAMIQUE : CORPS PUR
Exercice 1 : détente d'une vapeur d'eau dans une machine à vapeur. Dans le diagramme entropique ( T s ) de la figure
 THERMODYNAMIQUE
THERMODYNAMIQUE
Dans un diagramme d'Amagat (PV P) les isothermes d'un gaz parfait de machines à vapeur de même que le diagramme de Mollier (voir ci-dessous) ...
 Examen de thermodynamique Porter une attention particulière à la
Examen de thermodynamique Porter une attention particulière à la
Durée : 3h l'exercice et les deux problèmes sont indépendants appelé R134a) dont le diagramme enthalpique est donné en annexe.
 Transfert de vapeur deau
Transfert de vapeur deau
Les propriétés de l'air humide sont résumées par le diagramme de MOLLIER. L'observation de celui-ci permet d'observer les phénomènes suivants : -Lorsque la
 Série 5 - Complément de corrigé : I Diagramme
Série 5 - Complément de corrigé : I Diagramme
Exercices de Physique du Bâtiment I Série 5 - Complément de corrigé : I Diagramme psychrométrique (Mollier): «Mode d'emploi» II Questions III Problèmes 1-3 Silvia Coccolo & Nikos Zarkadis Physique du bâtiment I – Série 5 d’exercices 1
 Exercices Orbitales moléculaires - blablareau-chimiefr
Exercices Orbitales moléculaires - blablareau-chimiefr
On réalise une machine frigorifique dont le fluide frigorifique est le fréon Le schéma de cette machine est le suivant (Fig 1): Le diagramme de Mollier (enthalpie – pression) du fréon représenté ci-dessous (Fig 2) sera utilisé pour tracer le cycle frigorifique de cette machine Figure 1 Figure 1
 Chimie quantitative – mole masse molaire volume molaire
Chimie quantitative – mole masse molaire volume molaire
température et de pression 6700 litres Exercice 6 Le sulfate de cuivre hydraté a pour formule CuSO45H2O 1) Calculer la masse molaire du sulfate de cuivre hydraté 2497 g/mol 2) Déterminer le nombre de moles contenues dans une masse de 20 g de ce produit 8 x 10-2 mol
 Travaux dirigés d’automatique N 1 - u-strasbgfr
Travaux dirigés d’automatique N 1 - u-strasbgfr
On désire modéliser le système d’entraînement des têtes de lecture/écriture d’un disque dur Le bras supportant ces têtes est en rotation autour d’un axe et sa position est donnée par la grandeur ? Un actionneur électromagnétique permet de le mouvoir Le bras a une inertie J et son axe a un coe?cient de frottement visqueux f
 Corrigé /20
Corrigé /20
passant par le point 2 Etude du cycle : 1 Le diagramme T-s fourni permet de visualiser l'évolution de l'eau au cours du cycle Indiquer sur ce diagramme : La courbe de rosée La courbe d'ébullition Le point critique La zone liquide vapeur et la zone diphasique 2 Représenter le cycle sur le diagramme T-s fourni (page 10/10) 3
 Forces et interactions – Exercices – Devoirs
Forces et interactions – Exercices – Devoirs
3) Construis le diagramme objet-interaction Terre-Lune Terre/Lune Lune Terre Un joueur de rugby court avec le ballon dans sa main 1) Fais I'inventaire des actions s'exerçant sur le ballon 2) Identifie les interactions de contact et les interactions à distance 3) Construis le diagramme objet-interaction du bal Ion
 CHAPITRES V-VI : DIAGRAMMES D’EQUILIBRE (TD) - ensmpfr
CHAPITRES V-VI : DIAGRAMMES D’EQUILIBRE (TD) - ensmpfr
T = température de fusion (donnée par les diagrammes d’équilibre des autres exercices de ce chapitre) T = 500°C température typique de remise en solution des alliages d’aluminium Note : le résultat de cet exercice sera utilisé dans le Chapitre XXI sur les traitements thermiques des alliages d’aluminium Rappel : R = 8314 J
 TP1 : Diagramme de Cas d’Utilisations - Corrigés - azammouri
TP1 : Diagramme de Cas d’Utilisations - Corrigés - azammouri
d’indiquer au système de libérer des emplacements Le chargement et le déchargement sont réalisés manuellement Les employés de l’entrepôt sont sous la responsabilité d’un chef dont le rôle est de superviser la bonne application des consignes A l’aide d’un diagramme de cas d’utilisations modéliser ce système Corrigé :
 TP2 : Diagramme de Classes - Corrigés - azammouri
TP2 : Diagramme de Classes - Corrigés - azammouri
même salle de cours (chacune ayant un nombre de places déterminé) On désire pouvoir calculer la moyenne par matière ainsi que par département - On veut également calculer la moyenne générale d’un élève et pouvoir afficher les matières dans lesquelles il n’a pas été noté
 Correction du devoir de Cours sur UML - Charlie-Soft
Correction du devoir de Cours sur UML - Charlie-Soft
3) Donner le nom de ce diagramme et expliquez brièvement de qu'il représente : Le piège du devoir ! En effet ce n’est pas un diagramme de collaboration mais la modélisation d’une collaboration dans les diagrammes de classe Cela permet de représenter quelles classes travaillent à un cas d’utilisation Il représente
 QCM UML corrigé - Université Sorbonne Paris Nord
QCM UML corrigé - Université Sorbonne Paris Nord
La question n'est pas tant le nombre de classes les modélisations peuvent différer mais sur l'impact du choix des interfaces pour les combinaisons (combinaisons statiques avec l'heritage dynamiques avec les interfaces) Q14 Quel(s) type(s) de relations sont permises entre des cas d'utilisation ? (plusieurs choix possibles) Association
 Searches related to exercices corrigés sur le diagramme de mollier filetype:pdf
Searches related to exercices corrigés sur le diagramme de mollier filetype:pdf
Exercices Orbitales moléculaires Exercices Orbitales moléculaires Cours Approximations fondamentales 1 Rappeler succinctement les approximations fondamentales mises en place pour obtenir les orbitales moléculaires et les énergies correspondantes dans une molécule
Comment établir le diagramme d’orbitales moléculaires du chlorure d’hydrogène ?
- On cherche à établir le diagramme d’orbitales moléculaires du chlorure d’hydrogène sachant que l’énergie de l’orbitale atomique 1s de l’hydrogène est – 13,6 eV et que pour le chlore, on ne prend en compte que les orbitales atomiques 3p d’énergie -13,0 eV. L’énergie de l’OA 3s du chlore est beaucoup plus basse (-29,1 eV).
Qu'est-ce que le rôle dans un diagramme de classes ?
- Un rôle (dans un diagramme de classes UML) se traduit-il en Java par ? X un nom de variable une association un constructeur une opération Q12. Des véhicules sont dotés de châssis et de propulsions. Différents types de châssis permettent aux véhicules de rouler, voler ou bien flotter.
Comment calculer le schéma fonctionnel d’un moteur?
- Etablir le schéma fonctionnel du moteur en faisant apparaître les grandeurs U, I, ? et ?, ainsi qu’une entrée de perturbation de couple P venant s’additionner au couple moteur. 2. Simpli?er ce schéma de manière à obtenir la relation ?(s) = F(P(s),U(s)).
Comment calculer la masse molaire d’un élément ?
- Chimie quantitative – mole, masse molaire, volume molaire Chimie quantitative – mole, masse molaire, volume molaire Exercice 1 Une mole d’atomes est la quantité de matière qui contient 6,02 x 1023atomes identiques. Le nombre d’Avogadro est égal à 6,02 x 1023 La masse molaire atomique d’un élément est la masse d’une mole d’atomes de cet élément.
IUT de Saint Denis
Département Génie Industriel et MaintenanceTHERMODYNAMIQUEModule THERMb
Semestre 2février 2013
Pascal Tobalyhttp://ptob.free.fr
Moussa Dicko
iiTable des matières
6 Les fluides réels
16.1 Les gaz réels
16.1.1 Allure du réseau des isothermes
16.1.2 Équations d"état
16.2 Changements d"état
26.2.1 Liquéfaction des gaz
26.2.2 Courbe de pression de vapeur
36.2.3 Chaleur latente de vaporisation
46.2.4 Formule de Clapeyron
46.2.5 Titre de vapeur
46.3 Diagrammes thermodynamiques
56.3.1 Les tables de vapeur
97 turbine à vapeur :
117.1 Introduction
117.1.1 Les installations industrielles à vapeur
117.1.2 Calculs d"énergie
147.1.3 Cycle de Hirn (Surchauffe de la vapeur)
157.1.4 Détente étagée (cycle avec resurchauffeur)
177.1.5 Turbine à contre-pression
197.1.6 Cycle à soutirage (ou à prélèvement)
198 Transferts thermiques
238.1 Introduction.
238.1.1 Flux de chaleur
238.1.2 Trois modes de transfert :
258.2 Conduction en régime permanent
268.2.1 Conduction à travers une paroi plane en régime per-
manent. 2 68.2.2 Régime permanent.
298.2.3 Interface avec un fluide : loi de Newton
29iii ivTABLE DES MATIÈRES
8.3 Notion de résistance thermique
318.3.1 Géométrie plane mur composite
318.3.2 Géométrie cylindrique
338.3.3 Géométrie sphérique
348.3.4 Résistances en parallèle
358.3.5 Coefficients de transferts globaux
368.4 Analogie électrique
36Chapitre 6
Les fluides réels
6.1 Les gaz réels
6.1.1 Allure du réseau des isothermes
La loi des gaz parfaits est une loi approchée qui ne représente correctement le comportement des gaz qu"aux faibles pressions. Dans un diagramme d"Amagat(PV; P)les isothermes d"un gaz parfait sont des droites horizontales.Figure6.1 - Réseau des isothermes d"un gaz parfait dans le diagramme d"AmagatLes mesures effectuées sur les gaz réels permettent de tracer le réseau des isothermes des gaz réels, par exemple ici l"azote.Vers les basses températures, les
courbes se déforment jusqu"à pré- senter un point d"inflexion. L"iso- therme correspondante est appelée isotherme critique. En dessous de cette température (-147°C pour l"azote), le gaz peut être liquéfié.La température pour laquelle la
pente de l"isotherme aux basses pres- sions est nulle est appelée tempé- rature de Mariotte (50°C pour l"azote).6.1.2 Équations d"état
12CHAPITRE 6. LES FLUIDES RÉELS
Figure6.2 - Réseau des isothermes
d"un gaz réel dans le diagramme d"AmagatDe très nombreuses équations d"état ont été proposées pour rendre compte du comportement réel des fluides. La plus connue, et la plus simple, est l"équation de Van derWaals :
P+aV 2 (Vb) =r:TMalheureusement, si cette équa-
tion permet d"obtenir un réseau d"isothermes ayant bien l"allure d"un reseau réel, elle ne permet pas d"ob- tenir des résultats numériques ac- ceptables dans un large domaine de pressions et de températures. Elle a surtout une importance historique car c"est la première à permettre de représenter les deux phases gazeuse et liquide en équilibre. De plus elle est obtenue à partir un raisonnement moléculaire très pertinent. La raison pour laquelle elle est peu précise est qu"elle ne prend pas en compte le détail des forces d"attraction et de répul- sion agissant au niveau moléculaire. Aucune équation simple n"est en mesure de donner des résultats précis pour tous les fluides quels que soient la tem- pérature et la pression. La plupart des équations d"état utilisées dans l"industrie sont des exten- sions de l"équation de van der Waals. De plus, toutes les équations d"état ont en commun de tendre vers la loi des gaz parfaits pour les faibles pressions. Les calculs sont complexes avec la plupart de ces équations d"état et pour s"éviter des calculs fastidieux, notamment en présence de changements d"état, on est amené à utiliser des diagrammes fournissant des solutions gra- phiques approximatives mais quasi-immédiates. Par ailleurs, le développe- ment de l"informatique permet aujourd"hui d"obtenir des solutions rapides à l"aide de logiciels appropriés.6.2 Changements d"état
6.2.1 Liquéfaction des gaz
6.2. CHANGEMENTS D"ÉTAT3
Figure6.3 - courbe de saturationExpérience de liquéfaction du gaz carbonique.Dans un tube maintenu à tem-
pérature constante, on enferme du CO2puis on fait varier la pression et
le volume en poussant sur le piston.Lorsqu"on atteint une certaine pres-
sionPv, une première goutte de li- quide apparaît. Si l"on continue à en- foncer le piston, la masse de liquide produite augmente maisla pression reste constantetandis que le volume occupé par le mélange diminue. Lorsqu"il n"y a plus que du liquide, la pression augmente très rapidement tandis que le volume diminue très lentement. Si l"on répète l"expérience pour d"autres températures, on obtient le réseau d"isothermes ci-dessous. Au delà de la température critique, la liquéfaction n"est plus possible (31°C pour CO 2). La courbe (S) est appelée courbe de saturation, elle représente l"état du liquide pur (à gauche du point critique C) et de la vapeur saturée pure (à droite du point C). Les points situés en dessous de la courbe correspondent à un mélange de liquide et de vapeur en équilibre.6.2.2 Courbe de pression de vapeur
Figure6.4 - Courbe de pression de
vapeurPour un équilibre liquide-vapeur, la pression et la température sont liées par une fonctionPs=f(Ts); c"est un système mono-variant (c"està dire à un seul degré de liberté).
La courbe de pression de vapeur
est limitée par le point critique C et le point triple T, point de coexis- tence des trois phases (vapeur, li- quide, solide). La pente de la courbe n"est pas infinie en C, et différentes formules peuvent représenter cette courbe : - formule de Rankine : Log(Ps) = ABT4CHAPITRE 6. LES FLUIDES RÉELS
- formule de Duperray, pour l"eau entre 100 et 200°C :Ps=t1004, avec
P sen bars etten°C.6.2.3 Chaleur latente de vaporisation
C"est la variation d"enthalpie d"une masse unitaire de liquide saturant qui se vaporise totalement à pression constante, et température constanteévidemment.
L=HvHl=UvUl+P(VvVl) =Qp
C"est la quantité de chaleur qu"il faut fournir, à pression constante, pour vaporiser le liquide,Ldépend de la température. Les mesures effectuées donnent une courbe de la forme ci-contre, exemple pour l"eau,Ltend vers 0 pour la température critique.Ex : pour l"eau à 100°C :L=539 kcal/kg.
6.2.4 Formule de Clapeyron
La formule qui suit peut être démontrée à partir des deux principes. Elle n"est pas une formule approchée mais une formule thermodynamiquement exacte. Elle relie la chaleur latente à la pente de la courbe de saturation. De plus des formules analogues existent n"importe quel équilibre entre phases d"un corps pur. (par exemple l"équilibre liquide solide)L=T(vgvl)dPsdT
avecvgetvlvolume massique de la vapeur et du liquide saturant.6.2.5 Titre de vapeur
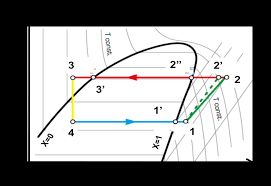
Figure6.5 - Titre de vapeurC"est le pourcentage de vapeur contenu dans un mélange liquide- vapeur à l"équilibre. On notemgla masse de vapeur etmlla masse de liquide. Le titre de vapeur s"écrira donc : x=mgm g+ml6.3. DIAGRAMMES THERMODYNAMIQUES5
Figure6.6 - lignes isotitre
Les points L, M et V donnés sur
la figure 6.5 représen tentresp ective- ment :LLiquide saturé
VVapeur saturée
MMélange liquide-vapeur
On démontre aisément :
x=vvgv gvl=hhlh ghl=ssls gsl En effet, on écrira par exemple pour l"enthalpie massique du mélange : h=Hm =Hl+Hgm =mlhl+mghgm = (1x)hl+xhg oùmest la masse totale. On procèdera de même pour les autres grandeurs extensives. L"interprêtation graphique est donnée par le rapport de deux segments : x=LM LV Ces formules permettent de tracer les lignes isotitres en divisant les paliers de vaporisation dans un rapport constant égal àxcomme n peut le voir sur la figure 6.66.3 Les diagrammes thermodynamiques et leur
utilisation Il est possible de calculer les valeurs des différentes grandeurs d"état (éner- gie interne, enthalpie, entropie .... ) en fonction des variables d"état (P, v ou6CHAPITRE 6. LES FLUIDES RÉELS
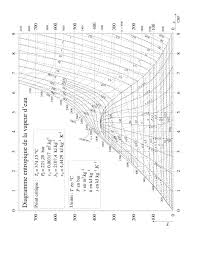
Figure6.7 - Diagramme entropique de l"eau
T) à l"aide d"équations d"état très développées et de diverses données expéri-
mentales. Le développement de ces équations ainsi que leur utilisation pour les calculs est une affaire de spécialistes étant donné la lourdeur des calculs mis en jeu. Toutefois, le résultat de ce type de calculs peut être utilisé dans la pratique sous différentes formes. Certaines données peuvent être présentées sous forme de tables numériques ou sous forme graphique. La précision de ce genre de données est généralement de l"ordre de 1% ce qui est suffisant pour la plupart des calculs techniques. A cela, viennent s"ajouter depuis quelque temps, des outils informatiques permettant de réaliser très rapidement des études de projets puisque les cal- culs fastidieux seront directement traités par l"ordinateur.Diagramme entropique (T,s)
Ce diagramme (figure
6.7 ) a pour abscisse l"entropie massique s et pour ordonnée la température. Il est utilisé principalement pour l"étude des cycles de machines à vapeur de même que le diagramme de Mollier (voir ci-dessous)6.3. DIAGRAMMES THERMODYNAMIQUES7
La courbe de saturation prend une forme similaire à celle qui a été vue sur le diagramme de Clapeyron avec une courbe d"ébullition à gauche (liquide saturé) et une courbe de rosée à droite (vapeur saturée) qui se rejoignent en un point critique au sommet. Ici encore, (pour une température inférieure à la température critique), les points situés à droite de la courbe représentent les états liquides (liquide sous refroidi), les états vapeur étant représentés par les points situés à droite de la courbe de rosée. Les points situés en dessous de la courbe de saturation représentent un mélange de liquide et de vapeur à l"équilibre thermodynamique. Un segment horizontal joignant la courbe d"ébullition à la courbe de rosée est à la fois une isotherme et une isobare. La position d"un point sur cette droite dépend des proportions du mélange (titre de vapeur). En parcourant ce segment de la gauche vers la droite, on passe progressivement d"un titre de vapeur nul (liquide saturé pur) à un titre de vapeur égal à 1 (vapeur saturée seule). On trace généralement dans cette partie du diagramme les lignes isotitres. On trouve aussi souvent les isobares et isochores dans la partie correspondant à la vapeur. On peut ainsi facilement suivre les évolutions d"un fluide et connaître la valeur de toutes les grandeurs dans chaque état. Un des intérêts de ce type de diagramme est qu"on peut facilement calculer une adiabatique réversible puisque son entropie étant constante, elle sera représentée par un segment de droite verticale.Diagramme de Mollier (h, s)
Les coordonnées de ce diagramme sont l"entropie massique pour l"abscisse et l"enthalpie massique pour l"ordonnée. On le préfère généralement au dia- gramme entropique pour les calculs sur les cycles de machines à vapeur car il permet de lire directement la valeur de l"enthalpie sur l"axe des ordonnées. Or c"est celle-ci qui est nécessaire dans le cas des machines où le fluide est en écoulement (voir chap 5). On voit ici aussi une courbe de saturation mais contrairement au cas précédent, le point critique n"est pas situé au sommet de la courbe. Sur la figure ci-contre, seule la courbe de rosée est apparente. Le point critique ainsi que la courbe d"ébullition se situeraient à gauche en dehors du graphique. La raison pour laquelle le liquide n"est pas représenté est que c"est surtout la vapeur qui nous intéresse ici. Dans les installations à vapeur, le liquide est souvent proche de la saturation et des simples tables de saturation suffiront. La région au dessus de la courbe représente l"état de vapeur surchauffée et dans cette région on trace généralement les isothermes et les isobares. Les points situés sous la courbe représentent les mélanges liquide vapeur. Les paliers de liquéfaction sont ici des droites obliques dont la pente est égale8CHAPITRE 6. LES FLUIDES RÉELS
Figure6.8 - Diagramme de Mollier
à la température absolue. En effet, la pente est égale àHS=T. On trace
aussi habituellement les courbes isotitres .Le diagramme enthalpique (P, h)
Ce diagramme est principalement utilisé par les frigoristes pour les ma- chines frigorifiques ainsi que les pompes à chaleur. L"abscisse est ici l"enthalpie massique tandis que l"ordonnée est la pression souvent représentée sur une échelle logarithmique. Ici encore, on observe une courbe de saturation, liquide à gauche et vapeur à droite avec un point cri- tique au sommet. (En général, le point critique est en dehors du dessin car la zone de travail se situe généralement au dessous). Les paliers de changement d"état (isobares et isothermes à la fois ) sont de nouveau des horizontales. De la même manière que précédemment, on trace : Da nsla région corresp ondantà la phase v apeur(à droite), les is o- thermes ainsi que les isentropes ou courbes isentropiques c"est à dire les courbes pour lesquelles l"entropie reste constante. Da nsla région corresp ondantaux mélanges liquide-v apeur,les lignes isotitres. Da nsla ré gioncorresp ondantau liquide, les isobares ne son tp astra-6.3. DIAGRAMMES THERMODYNAMIQUES9
Figure6.9 - Diagramme enthalpique
cées compte tenu du fait qu"on sait qu"elles sont pratiquement verti- cales. (Du fait de l"incompressibilité du liquide, l"enthalpie est très peu sensible à la pression)6.3.1 Les tables de vapeur
La précision de la lecture sur les diagrammes est souvent insuffisante et on a souvent recours à des tables dans lesquelles on peut trouver les valeursquotesdbs_dbs5.pdfusesText_10[PDF] exercices corriges sur les agregats economiques pdf
[PDF] exercices corrigés sur les anneaux quotients
[PDF] exercices corrigés sur les atomes et les molécules 4eme
[PDF] exercices corrigés sur les comptes peruc pdf
[PDF] exercices corrigés sur les congruences pdf
[PDF] exercices corrigés sur les filtres actifs et passifs
[PDF] exercices corrigés sur les flux économiques pdf
[PDF] exercices corrigés sur les fonctions numériques dune variable réelle
[PDF] exercices corrigés sur les fonctions récursives
[PDF] exercices corrigés sur les glucides
[PDF] exercices corrigés sur les immobilisations corporelles
[PDF] exercices corriges sur les lois de probabilités discrètes
[PDF] exercices corrigés sur les matrices en langage c pdf
[PDF] exercices corrigés sur les nombres entiers naturels
