 dosage des sucres réducteurs: méthode de Fehling
dosage des sucres réducteurs: méthode de Fehling
Liqueur de Fehling. Solution 1. CuSO4 5H2O. 40 g. Eau. 300 mL. (prévoir un excès de 5-10% de CuSO4). Solution 2. NaOH. 130 g. Tartrate de K et Na. 160 g. Eau.
 Kit dialyse
Kit dialyse
sucres réducteurs à l'aide de réactions au lugol et à la liqueur de Fehling A + B. L'autre groupe réalise la digestion In Vitro en mettant de l'amidon en ...
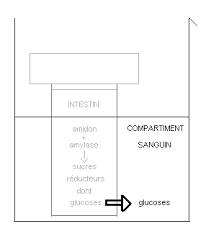
 Sans titre
Sans titre
Ces oses se comportent comme des réducteurs : ils réduisent la liqueur de Fehling à C'est un sucre réducteur. ◗. Le lactose formé d'une molécule de glucose ...
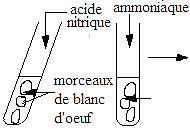 CODE: SVT DURÉE : 6H
CODE: SVT DURÉE : 6H
Le sucre réducteur du pain est le glucose et le sucre réducteur du lait est le lactose. La liqueur de Fehling qui permet de caractériser les sucres réducteurs
 Fiche technique dutilisation de réactifs spécifiques de différents
Fiche technique dutilisation de réactifs spécifiques de différents
- Verser ........ mL de la solution dans un tube à essais
 TP 2 : De lamidon au maltose une simplification moléculaire Mise
TP 2 : De lamidon au maltose une simplification moléculaire Mise
- liqueur de Fehling (réactif spécifique des sucres réducteurs comme le maltose). - solution d'amylase (+ pipette 5 mL) à température ambiante. - solution d
 Observations sur la méthode de Gabriel Bertrand pour le dosage
Observations sur la méthode de Gabriel Bertrand pour le dosage
8 oct. 2019 comme officielle qui consiste à oxyder le sucre réducteur au moyen d'une liqueur du type Barreswill-Fehling
 Expérience de biochimie : Analyser des aliments Biologie
Expérience de biochimie : Analyser des aliments Biologie
Test à la liqueur de Fehling : mise en évidence des sucres réducteurs. La liqueur de Fehling est une solution renfermant des ions Cu2+ de couleur bleue en
 TP 2 : La spécificité des enzymes digestives. Mise en situation et
TP 2 : La spécificité des enzymes digestives. Mise en situation et
liqueur de Fehling. Le document 1 nous rappelle que la présence de sucres réducteurs (glucose et maltose) traduit l'hydrolyse des polysaccharides. On en ...
 dosage des sucres réducteurs: méthode de Fehling
dosage des sucres réducteurs: méthode de Fehling
Pour une même quantité de solution de liqueur de Fehling utilisée soit 5 mL
 Sans titre
Sans titre
C'est le sucre de table ou sucre blanc. Il n'est pas réducteur et ne peut donc pas être mis en évidence par la réaction à la liqueur de Fehling.
 Dosage des glucides présents dans un jus de fruit
Dosage des glucides présents dans un jus de fruit
totalité une prise d'essai équivalente de liqueur de Fehling. Par comparaison on en déduit la teneur en sucre réducteur de la solution à.
 Kit dialyse
Kit dialyse
Réactif. Couleur. LUGOL. LIQUEUR DE FEHLING A + B. Chauffée au bain-marie. Du réactif. Avec ajout de sucres réducteurs. Avec ajout d'amidon
 TP 2 : De lamidon au maltose une simplification moléculaire Mise
TP 2 : De lamidon au maltose une simplification moléculaire Mise
liqueur de Fehling (réactif spécifique des sucres réducteurs comme le maltose). - solution d'amylase (+ pipette 5 mL) à température ambiante.
 1 L A 04 Les glucides B version prof
1 L A 04 Les glucides B version prof
Dans un tube à essai contenant de la liqueur de Fehling de couleur bleue L'acide chlorhydrique transforme le saccharose en sucres réducteurs : glucose ...
 Expérience de biochimie : Analyser des aliments Biologie
Expérience de biochimie : Analyser des aliments Biologie
Biochimie : liqueur de Fehling lugol
 Atelier de biologie mise en évidence de glucides
Atelier de biologie mise en évidence de glucides
présence de différents sucres dans les aliments. Durée de l'activité. 1 séance indicateurs colorés le lugol (l'eau iodée) et la liqueur de Fehling.
 TP 2 : La spécificité des enzymes digestives. Mise en situation et
TP 2 : La spécificité des enzymes digestives. Mise en situation et
liqueur de Fehling (réactif spécifique des sucres réducteurs comme le maltose). - solution d'amylase (+ pipette 5 mL). - eau distillée.
 MÉMOIRE DE MASTER
MÉMOIRE DE MASTER
Dosage des sucres réducteurs. A) Principe. Cette méthode basée sur la réduction de le liqueur de Fehling par les sucres réducteurs.
 [PDF] dosage des sucres réducteurs: méthode de Fehling - Sites ENSFEA
[PDF] dosage des sucres réducteurs: méthode de Fehling - Sites ENSFEA
Liqueur de Fehling Solution 1 CuSO4 5H2O 40 g Eau 300 mL (prévoir un excès de 5-10 de CuSO4) Solution 2 NaOH 130 g Tartrate de K et Na 160 g Eau
 Dosage des sucres réducteurs par la méthode de Fehling
Dosage des sucres réducteurs par la méthode de Fehling
Cette méthode de dosage repose sur la réduction de la liqueur de Fehling mélange d'une solution de sulfate de cuivre et de sel de Seignette en présence de
 Des sucres réducteurs - Mettre en évidence - Académie de Versailles
Des sucres réducteurs - Mettre en évidence - Académie de Versailles
La liqueur de Fehling renferme des ions cuivre II de couleur bleue A chaud en présence d'un réducteur se forme un précipité rouge brique d'oxyde de cuivre
 [PDF] Fiche technique dutilisation de réactifs spécifiques de différents
[PDF] Fiche technique dutilisation de réactifs spécifiques de différents
A chaud et en présence de glucides réducteurs la liqueur de Fehling donne un précipité rouge brique d'oxyde de cuivre Cu2O A : Couleur initial du réactif ;
 [PDF] MÉMOIRE DE MASTER - University of Biskra Repository
[PDF] MÉMOIRE DE MASTER - University of Biskra Repository
Cette méthode basée sur la réduction de le liqueur de Fehling par les sucres réducteurs contenus dans l'échantillon (Audigier et al 1984) 3 3 1 10
 [PDF] Atelier de biologie mise en évidence de glucides - Franciaoktataseu
[PDF] Atelier de biologie mise en évidence de glucides - Franciaoktataseu
Elle permet aussi de présenter aux jeunes deux indicateurs colorés le lugol (l'eau iodée) et la liqueur de Fehling Remarque : Cette expérience est très prisée
 [PDF] Les molécules organiques
[PDF] Les molécules organiques
C'est le sucre de table ou sucre blanc Il n'est pas réducteur et ne peut donc pas être mis en évidence par la réaction à la liqueur de Fehling
 [PDF] Chimie des sucrespdf - ORBi
[PDF] Chimie des sucrespdf - ORBi
Les OSES encore appelés monosaccharides ou sucres simples sont les plus simples des glucides Ils sont REDUCTEURS Les sures simples sont des chaînes carbonées
 [PDF] 1 L A 04 Les glucides B version prof
[PDF] 1 L A 04 Les glucides B version prof
Interprétation : certains sucres comme le glucose réagissent avec la liqueur de Fehling ; ils sont appelés "sucres réducteurs"
 [PDF] TP 21 : Dosage du glucose
[PDF] TP 21 : Dosage du glucose
Le glucose réagit à chaud avec la liqueur de Fehling La transformation est visualisée par un changement de couleur : la teinte du mélange vire du bleu au
Pourquoi le glucose réagit avec la liqueur de Fehling ?
La raison est que le saccharose s'hydrolyse en fructose et en glucose, et que ce dernier réagit avec les ions cuivre(II) de la liqueur.Pourquoi le sucre est réducteur ?
Les sucres réducteurs sont des sucres simples donneurs d'électrons dans une réaction d'oxydo-réduction. Par exemple le glucose, le fructose et le maltose. Ils poss?nt une fonction aldéhyde. Les sucres non réducteurs ne poss?nt pas cette fonction aldéhyde.Comment mettre en évidence le sucre réducteur ?
Mettre la substance à tester en solution dans un tube à essai avec de l'eau distillée. Faire chauffer au bec bunsen ou mieux mettre au bain-marie à 100°C quelques minutes. La formation d'un précipité rouge brique indique la présence de sucres réducteurs.- On utilise la liqueur de Fehling pour caractériser les aldéhydes aliphatiques (la réaction est moins nette pour les aldéhydes aromatiques), tel le glucose. La réaction provoque la formation d'un précipité d'oxyde cuivreux rouge-brun. On l'utilise aussi pour déterminer la proportion de sucres réducteurs.
Dosage des glucides présents
dans un jus de fruit (TP enseignant)Objectif
: on se propose de déterminer la concentration en saccharose, glucose et fructose présents dans un jus de fruit à l"aide de deux dosages d"oxydoréduction.Matériels et réactifs :
Dosage par le diiode -Erlenmeyer de 150 mL -jus de fruit (orange, pomme, raisin) -Burette -diiode 0,025 mol .L -1 -Pipettes -Na2S2O3 0,05 mol.L-1
-Bain-marie -NaOH 2,5 mol. L -1 -Becher -H2SO4 3 mol. L-1
-Empois d"amidon -Solution d"invertase 2 mg/mL Dosage par la liqueur de Fehling -Erlenmeyer de 250 mL -Solution A -Burette 40 g de CuSO4 5H2O
-Pipettes 10 mL 5 mL d"H2SO4 concentré
-Eprouvette 50 mL Eau distillée qsp 1L -Chauffe-ballon -Solution B :200 g de tartrate double
Sodium - potassium
150 g de NaOH
Eau distillée qsp 1L
Le jus de fruit contient du saccharose, du glucose et du fructose. ❖ Dosage par oxydation doucePrincipe
: les aldéhydes sont des composés plus facilement oxydables que les cétones. En effet, l"oxydation de la fonction cétone implique la coupure de la chaîne carbonée et l"action d"oxydants puissants. C"est ainsi que le diiode qui est un oxydant oxyde en milieu alcalin les aldoses en acides carboxyliques correspondants, alors que les cétoses ne sont pas oxydés dans des conditions équivalentes. Cette méthode permet donc le dosage spécifique des aldoses en présence de cétoses. ❖ Réaction du dosageEn milieu alcalin : dismutation du diiode
I2 + 2OH- ® IO- + H2O + I-
suivie d"une oxydation des aldosesR - CHO + IO
- ® R.COOH + I-Régénération du diiode en milieu acide
IO - + 2H+ + I- ® I2 + H2O Titration du diiode par une solution de thiosulfate de sodiumI2 + 2S2O-2
3 ® 2I- + S4O-2
6 Par différence avec un témoin effectué dans les mêmes conditions, on peut en déduire la quantité d"oses réducteurs présents dans la solution. Dosage par oxydation forte : méthode cuprimétrique L"oxydation des oses par une solution de liqueur de Fehling est une réaction non stoechiométrique qui doit s"effectuer toujours dans les mêmes conditions de température, pH et durée de chauffage.En milieu alcalin, les ions Cu
2+ réagissent avec les oses en formant un précipité de
Cu 2O2 Cu 2+ + R-CHO + 5OH- ® Cu2O + 3H2O + R.COO-
C"est une méthode de comparaison : on détermine le volume (Ve) d"une solution étalon de glucose nécessaire pour réduire en totalité une prise d"essai donnée de liqueur de fehling. On détermine ensuite le volume V de solution sucrée à doser pour réduire en totalité une prise d"essai équivalente de liqueur de Fehling. Par comparaison, on en déduit la teneur en sucre réducteur de la solution à doser.Préparation des solutions à doser
- préparer une solution du glucose 5 g.L-1 : solution S1 - faire une dilution au 1/10 d"un jus d"orange (250 mL volume final) : solution S 2- prélever 100 mL de jus de fruit dilué à rajouter 50 mL d"invertase à 2 mg/mL. Placer l"ensemble au bain-marie pendant
30 min à 37°C : solution S
3.Dosage par le diiode
- préparer 4 erlenmeyers de la façon suivanteErlen 0 Erlen 1 Erlen 2 Erlen 3
témoin 5mL S1 5 mL S2 5 mL S3H2O 10 mL 5 mL 5 mL 5 ml
Diiode 0.025 mol.L-1 15 mL 15 mL 15 mL 15 mL
NaOH 2,5 mol.L-1 3 mL 3 mL 3 mL 3 mL
Agiter et placer à l"obscurité les erlens 30 min puis - ajouter dans chaque erlen 2 mL d"H2SO4 (3 mol.L-1), agiter et observer la régénération du diiode. - procéder au dosage en plaçant la solution de thiosulfate à 0,05 mol.L -1 dans la burette. Verser goutte à goutte jusqu"à avoir une couleur jaune clair, ajouter quelques gouttes d"empois d"amidon ; continuer à verser la solution de thiosulfate jusqu"à obtention du virage (solution incolore). - Noter les volumes obtenus V0, V1, V2, V3; - Déterminer les concentrations en glucose.Dosage par la liqueur de fehling
Dans un erlenmeyer de 250 mL, introduire 10 mL de solution A, 10 mL de solution B et 50 mL d"eau distillée.Porter à ébullition pendant 3 minutes.
Verser goutte à goutte la solution étalon S1 contenue dans la burette jusqu"à disparition totale de la couleur bleue et apparition d"un précipité de Cu 2O,Après chaque ajout, chauffer. Noter le volume.
Refaire l"expérience avec la solution du jus de fruit diluée S2 et avec la
solution du jus de fruit hydrolysée S3 . Noter les volumes correspondants.
Expression des résultats
Déterminer la concentration en glucose libre du jus d"orange. Déterminer la concentration en fructose libre du jus d"orange. Déterminer la concentration en saccharose du jus d"orange. Déterminer la concentration en glucides totale du jus d"orange.quotesdbs_dbs6.pdfusesText_12[PDF] diholoside réducteur et non réducteur
[PDF] pouvoir réducteur des glucides
[PDF] le système hormonal
[PDF] glandes endocrines et hormones
[PDF] système endocrinien pour les nuls
[PDF] liste des hormones pdf
[PDF] type d'hormone
[PDF] les hormones et leurs fonctions pdf
[PDF] lipides simples et complexes
[PDF] classification des microorganismes ppt
[PDF] le monde microbien wikipedia
[PDF] tableau de classification des micro-organisme
[PDF] pfe pont dalle
[PDF] pont a poutre en béton armé pdf
