 dosage des sucres réducteurs: méthode de Fehling
dosage des sucres réducteurs: méthode de Fehling
Liqueur de Fehling. Solution 1. CuSO4 5H2O. 40 g. Eau. 300 mL. (prévoir un excès de 5-10% de CuSO4). Solution 2. NaOH. 130 g. Tartrate de K et Na. 160 g. Eau.
 Kit dialyse
Kit dialyse
sucres réducteurs à l'aide de réactions au lugol et à la liqueur de Fehling A + B. L'autre groupe réalise la digestion In Vitro en mettant de l'amidon en ...
 Sans titre
Sans titre
Ces oses se comportent comme des réducteurs : ils réduisent la liqueur de Fehling à C'est un sucre réducteur. ◗. Le lactose formé d'une molécule de glucose ...
 CODE: SVT DURÉE : 6H
CODE: SVT DURÉE : 6H
Le sucre réducteur du pain est le glucose et le sucre réducteur du lait est le lactose. La liqueur de Fehling qui permet de caractériser les sucres réducteurs
 Fiche technique dutilisation de réactifs spécifiques de différents
Fiche technique dutilisation de réactifs spécifiques de différents
- Verser ........ mL de la solution dans un tube à essais
 TP 2 : De lamidon au maltose une simplification moléculaire Mise
TP 2 : De lamidon au maltose une simplification moléculaire Mise
- liqueur de Fehling (réactif spécifique des sucres réducteurs comme le maltose). - solution d'amylase (+ pipette 5 mL) à température ambiante. - solution d
 Observations sur la méthode de Gabriel Bertrand pour le dosage
Observations sur la méthode de Gabriel Bertrand pour le dosage
8 oct. 2019 comme officielle qui consiste à oxyder le sucre réducteur au moyen d'une liqueur du type Barreswill-Fehling
 Dosage des glucides présents dans un jus de fruit
Dosage des glucides présents dans un jus de fruit
déduire la quantité d'oses réducteurs totalité une prise d'essai équivalente de liqueur de Fehling. Par comparaison on en déduit la teneur en sucre réducteur ...
 Expérience de biochimie : Analyser des aliments Biologie
Expérience de biochimie : Analyser des aliments Biologie
Test à la liqueur de Fehling : mise en évidence des sucres réducteurs. La liqueur de Fehling est une solution renfermant des ions Cu2+ de couleur bleue en
 TP 2 : La spécificité des enzymes digestives. Mise en situation et
TP 2 : La spécificité des enzymes digestives. Mise en situation et
liqueur de Fehling. Le document 1 nous rappelle que la présence de sucres réducteurs (glucose et maltose) traduit l'hydrolyse des polysaccharides. On en ...
 dosage des sucres réducteurs: méthode de Fehling
dosage des sucres réducteurs: méthode de Fehling
Pour une même quantité de solution de liqueur de Fehling utilisée soit 5 mL
 Sans titre
Sans titre
C'est le sucre de table ou sucre blanc. Il n'est pas réducteur et ne peut donc pas être mis en évidence par la réaction à la liqueur de Fehling.
 Dosage des glucides présents dans un jus de fruit
Dosage des glucides présents dans un jus de fruit
totalité une prise d'essai équivalente de liqueur de Fehling. Par comparaison on en déduit la teneur en sucre réducteur de la solution à.
 Kit dialyse
Kit dialyse
Réactif. Couleur. LUGOL. LIQUEUR DE FEHLING A + B. Chauffée au bain-marie. Du réactif. Avec ajout de sucres réducteurs. Avec ajout d'amidon
 TP 2 : De lamidon au maltose une simplification moléculaire Mise
TP 2 : De lamidon au maltose une simplification moléculaire Mise
liqueur de Fehling (réactif spécifique des sucres réducteurs comme le maltose). - solution d'amylase (+ pipette 5 mL) à température ambiante.
 1 L A 04 Les glucides B version prof
1 L A 04 Les glucides B version prof
Dans un tube à essai contenant de la liqueur de Fehling de couleur bleue L'acide chlorhydrique transforme le saccharose en sucres réducteurs : glucose ...
 Expérience de biochimie : Analyser des aliments Biologie
Expérience de biochimie : Analyser des aliments Biologie
Biochimie : liqueur de Fehling lugol
 Atelier de biologie mise en évidence de glucides
Atelier de biologie mise en évidence de glucides
présence de différents sucres dans les aliments. Durée de l'activité. 1 séance indicateurs colorés le lugol (l'eau iodée) et la liqueur de Fehling.
 TP 2 : La spécificité des enzymes digestives. Mise en situation et
TP 2 : La spécificité des enzymes digestives. Mise en situation et
liqueur de Fehling (réactif spécifique des sucres réducteurs comme le maltose). - solution d'amylase (+ pipette 5 mL). - eau distillée.
 MÉMOIRE DE MASTER
MÉMOIRE DE MASTER
Dosage des sucres réducteurs. A) Principe. Cette méthode basée sur la réduction de le liqueur de Fehling par les sucres réducteurs.
 [PDF] dosage des sucres réducteurs: méthode de Fehling - Sites ENSFEA
[PDF] dosage des sucres réducteurs: méthode de Fehling - Sites ENSFEA
Liqueur de Fehling Solution 1 CuSO4 5H2O 40 g Eau 300 mL (prévoir un excès de 5-10 de CuSO4) Solution 2 NaOH 130 g Tartrate de K et Na 160 g Eau
 Dosage des sucres réducteurs par la méthode de Fehling
Dosage des sucres réducteurs par la méthode de Fehling
Cette méthode de dosage repose sur la réduction de la liqueur de Fehling mélange d'une solution de sulfate de cuivre et de sel de Seignette en présence de
 Des sucres réducteurs - Mettre en évidence - Académie de Versailles
Des sucres réducteurs - Mettre en évidence - Académie de Versailles
La liqueur de Fehling renferme des ions cuivre II de couleur bleue A chaud en présence d'un réducteur se forme un précipité rouge brique d'oxyde de cuivre
 [PDF] Fiche technique dutilisation de réactifs spécifiques de différents
[PDF] Fiche technique dutilisation de réactifs spécifiques de différents
A chaud et en présence de glucides réducteurs la liqueur de Fehling donne un précipité rouge brique d'oxyde de cuivre Cu2O A : Couleur initial du réactif ;
 [PDF] MÉMOIRE DE MASTER - University of Biskra Repository
[PDF] MÉMOIRE DE MASTER - University of Biskra Repository
Cette méthode basée sur la réduction de le liqueur de Fehling par les sucres réducteurs contenus dans l'échantillon (Audigier et al 1984) 3 3 1 10
 [PDF] Atelier de biologie mise en évidence de glucides - Franciaoktataseu
[PDF] Atelier de biologie mise en évidence de glucides - Franciaoktataseu
Elle permet aussi de présenter aux jeunes deux indicateurs colorés le lugol (l'eau iodée) et la liqueur de Fehling Remarque : Cette expérience est très prisée
 [PDF] Les molécules organiques
[PDF] Les molécules organiques
C'est le sucre de table ou sucre blanc Il n'est pas réducteur et ne peut donc pas être mis en évidence par la réaction à la liqueur de Fehling
 [PDF] Chimie des sucrespdf - ORBi
[PDF] Chimie des sucrespdf - ORBi
Les OSES encore appelés monosaccharides ou sucres simples sont les plus simples des glucides Ils sont REDUCTEURS Les sures simples sont des chaînes carbonées
 [PDF] 1 L A 04 Les glucides B version prof
[PDF] 1 L A 04 Les glucides B version prof
Interprétation : certains sucres comme le glucose réagissent avec la liqueur de Fehling ; ils sont appelés "sucres réducteurs"
 [PDF] TP 21 : Dosage du glucose
[PDF] TP 21 : Dosage du glucose
Le glucose réagit à chaud avec la liqueur de Fehling La transformation est visualisée par un changement de couleur : la teinte du mélange vire du bleu au
Pourquoi le glucose réagit avec la liqueur de Fehling ?
La raison est que le saccharose s'hydrolyse en fructose et en glucose, et que ce dernier réagit avec les ions cuivre(II) de la liqueur.Pourquoi le sucre est réducteur ?
Les sucres réducteurs sont des sucres simples donneurs d'électrons dans une réaction d'oxydo-réduction. Par exemple le glucose, le fructose et le maltose. Ils poss?nt une fonction aldéhyde. Les sucres non réducteurs ne poss?nt pas cette fonction aldéhyde.Comment mettre en évidence le sucre réducteur ?
Mettre la substance à tester en solution dans un tube à essai avec de l'eau distillée. Faire chauffer au bec bunsen ou mieux mettre au bain-marie à 100°C quelques minutes. La formation d'un précipité rouge brique indique la présence de sucres réducteurs.- On utilise la liqueur de Fehling pour caractériser les aldéhydes aliphatiques (la réaction est moins nette pour les aldéhydes aromatiques), tel le glucose. La réaction provoque la formation d'un précipité d'oxyde cuivreux rouge-brun. On l'utilise aussi pour déterminer la proportion de sucres réducteurs.

SORDALAB | PARC SUDESSOR - 15 Avenue des Grenots - 91150 ETAMPES - FRANCE Tél. : +33 1 69 92 26 72 - Fax : +33 1 69 92 26 74 - www.sordalab.com - Mail : info@sordalab.com Page 1/10 Kit dialyse Réf. C/DIAL A RECEPTION DU COLIS : þ Vérifier la composition du colis indiquée ci-dessous þ Stocker les articles du colis dans les bonnes conditions : Ouvrir le carton - !Placer le sachet noté K à + 4°C! - !Placer le sachet noté L et le flacon noté " Fehling » à température ambiante! þ Avant toute manipulation, étudier la fiche sécurité COMPOSITION DU COLIS : - 1 sachet noté " K » à stocker à +4°C contenant : o 1 sachet noté " amidon test » contenant 2 g d'amidon o 1 sachet noté " sucre réducteur test » contenant 3 g de glucose o 1 sachet noté " amidon digestion » contenant 8,4 g d'amidon o 1 sachet noté " amylase » contenant 1,2 g d'amylase - 1 sachet noté " L » à stocker à température ambiante contenant : o 1 sachet noté " membranes » contenant 6 membranes de dialyse o 1 tube noté " lugol » de 6 mL de lugol o 6 pinces blanches pour membrane de dialyse o 36 compte-gouttes - 1 flacon noté " Fehling » de 150 mL de liqueur de Fehling A + B à stocker à température ambiante MATERIEL NECESSAIRE : - 1 cristallisoir - 3 flacons de 100 mL - 1 éprouvette de 100 mL - Feutres permanents - 3 pipettes de 10 mL et poire adaptée pour l'enseignant ou éprouvette de 25 mL - 2 éprouvettes de 25 mL - 12 grands verres de montre ou 24 petits verres de montre - 6 erlens ou béchers en verre de 100 mL - 12 béchers en verre de 100 mL - 6 béchers avec bec verseur de 100 mL - Gants - Lunettes de sécurité - Eau distillée - Gant anti-chaleur ou manique de préhension
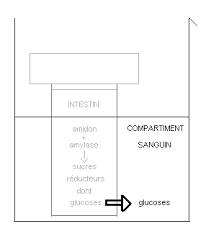
SORDALAB | PARC SUDESSOR - 15 Avenue des Grenots - 91150 ETAMPES - FRANCE Tél. : +33 1 69 92 26 72 - Fax : +33 1 69 92 26 74 - www.sordalab.com - Mail : info@sordalab.com Page 2/10 MATERIEL CONSEILLE : - 2 bain-marie OBJECTIFS COGNITIFS Le but de ce TP est de comprendre le principe de la digestion et de l'absorption intestinale des nutriments, avec l'exemple de l'amidon digéré en sucres, dont des molécules de glucose. RAPPELS Principe de la digestion de l'amidon par l'amylase : L'amidon est une chaîne de molécules de glucose dont les liaisons sont lysées par l'amylase lorsque la température est suffisante. L'amidon est donc coupé en sucres réducteurs et molécules de glucose. Principe de la dialyse : La membrane de dialyse modélise la paroi intestinale. L'intérieur de la membrane correspond à la lumière de l'intestin, le bécher remplit d'eau figure le compartiment sanguin qui irrigue les organes. Les molécules d'amidon ne peuvent pas traverser la membrane car elles sont trop grosses. Seules les molécules de sucres suffisamment petites peuvent passer. A l'intérieur de la membrane, il reste les sucres de taille importante et à l'extérieur, il n'y a que les petits sucres ayant pu passer les pores de la membrane. Ces petits sucres sont en majorité des molécules de glucose qui vont pouvoir alimenter les organes. Principe général du TP : Un groupe d'élèves va effectuer des tests préliminaires pour identifier la présence d'amidon et de sucres réducteurs à l'aide de réactions au lugol et à la liqueur de Fehling A + B. L'autre groupe réalise la digestion In Vitro en mettant de l'amidon en présence d'amylase dans une membrane de dialyse, elle-même placée dans un bécher d'eau chaude. Après 45 minutes de digestion, des tests d'identification au lugol et à la liqueur de Fehling sont pratiqués.
SORDALAB | PARC SUDESSOR - 15 Avenue des Grenots - 91150 ETAMPES - FRANCE Tél. : +33 1 69 92 26 72 - Fax : +33 1 69 92 26 74 - www.sordalab.com - Mail : info@sordalab.com Page 3/10 PREPARATION PREPARATION DE LA SALLE (LA VEILLE DU TP) "NB" : Deux groupes de 6 élèves pourront manipuler : un groupe réalise les tests d'identification et l'autre groupe réalise la digestion In Vitro. - Pour le groupe réalisant les tests, disposer : o 6 grands verres de montre ou bien 12 petits o 18 compte-gouttes o 6 erlenmeyers ou béchers de 100 mL en verre, ou 6 tubes (15 mL minimum) avec portoirs - Pour le groupe réalisant la digestion in vitro, disposer : o 6 grands verres de montre ou bien 12 petits o 12 compte-gouttes o 6 béchers de 100 mL avec bec verseur bien défini o 6 béchers de 100 mL en verre - Pour toute la classe : o sortir les flacons de liqueur de Fehling A+B et le tube de lugol fournis dans le kit o préparer des éprouvettes de 25 mL (au moins 2) ainsi que 3 pipettes de 10 mL et poire adaptée pour l'enseignant (ou bien 3 éprouvettes de 25 mL) o ne pas oublier de prévoir des gants, latex et anti-chaleur, et des lunettes de protection PREPARER LE OU LES BAIN-MARIE (AVANT LE TP SELON LE TEMPS DE CHAUFFE DES BAINS-MARIE) - Mettre le ou les bains-marie à chauffer à 65-70°C - Préparer des gants anti-chaleur pour la manipulation PREPARATION DES MEMBRANES DE DIALYSE (10 MINUTES AVANT LE TP) - Mettre à tremper les membranes de dialyse (dans le sachet noté " membranes ») dans un cristallisoir rempli d'eau chaude (non bouillante) - Laisser reposer dans l'eau pendant 5 minutes - Faire rouler sous les doigts chaque membrane jusqu'à ce que le cylindre s'ouvre puis faire un petit noeud à l'une des extrémités et bien le serrer - Replacer immédiatement les membranes nouées d'un côté dans le cristallisoir rempli d'eau #Conseil # : les membranes sont à travailler plus ou moins longtemps avec les doigts avant de s'ouvrir : procéder de la même façon qu'avec un sac plastique de congélation. $$ ATTENTION $$ : veiller à ne pas abimer les membranes en les manipulant : éviter de les griffer avec les ongles surtout lors de la réalisation du noeud PREPARATION DU FLACON DE GLUCOSE (QUELQUES MINUTES AVANT LE TP OU PENDANT LE TP) - Transvaser dans un flacon de 100 mL le contenu du sachet noté " glucose test » (stocké dans le sur-sachet A placé au réfrigérateur) - Ajouter 30 mL d'eau distillée mesurés avec une éprouvette de 100 mL - Bien agiter - Noter ce flacon : " sucre réducteur pour tests » -
SORDALAB | PARC SUDESSOR - 15 Avenue des Grenots - 91150 ETAMPES - FRANCE Tél. : +33 1 69 92 26 72 - Fax : +33 1 69 92 26 74 - www.sordalab.com - Mail : info@sordalab.com Page 4/10 PREPARATION DES SUSPENSIONS D'AMIDON (JUSTE AVANT LE TP OU PENDANT LE TP) "NB" : Un flacon est utilisé par le groupe qui réalise les tests de réactivité et l'autre par le groupe qui réalise la digestion In Vitro. - Transvaser dans un flacon de 100 mL le contenu du sachet noté " amidon test » (stocké dans le sur-sachet A placé au réfrigérateur) - Ajouter 30 mL d'eau distillée mesurés avec une éprouvette de 100 mL - Bien agiter - Noter ce flacon : " amidon pour tests » - Stocker ce flacon au frais (à l'ombre ou au réfrigérateur) - Transvaser dans un flacon de 100 mL le contenu du sachet noté " amidon digestion » (stocké dans le sur-sachet A placé au réfrigérateur) - Ajouter 90 mL d'eau distillée mesurés avec une éprouvette de 100 mL - Bien agiter - Noter ce flacon : " amidon pour digestion » - Stocker ce flacon au frais (à l'ombre ou au réfrigérateur) MANIPULATION : Le TP est prévu pour deux groupes de 6 binômes : Un groupe va réaliser les tests d'identification sur les produits tests et sur les produits de la digestion Un groupe va réaliser la digestion In Vitro TESTS D'IDENTIFICATION SUR LES PRODUITS TESTS L'enseignant répartit à la pipette (ou avec une éprouvette) le contenu du flacon noté " sucres réducteurs pour tests » dans 6 petits béchers ou erlenmeyers de 100 mL (ou encore dans des tubes pouvant contenir au moins 15 mL) en verre : chaque récipient contient alors 5 mL de solution de sucres réducteurs L'enseignant répartit à la pipette (ou avec une éprouvette) le contenu du flacon noté " amidon pour tests » dans 6 petits béchers ou erlens de 100 mL (ou encore dans des tubes pouvant contenir au moins 15 mL) en verre : chaque récipient contient alors 5 mL de solution d'amidon 1) Repérage des solutions distribuées : - Noter avec un feutre " sucre réducteur » sur le récipient contenant la solution de sucres réducteurs - Noter avec un feutre " amidon » sur le récipient contenant la solution d'amidon 2) Réalisation des tests au lugol sur les solutions de glucose et d'amidon :
SORDALAB | PARC SUDESSOR - 15 Avenue des Grenots - 91150 ETAMPES - FRANCE Tél. : +33 1 69 92 26 72 - Fax : +33 1 69 92 26 74 - www.sordalab.com - Mail : info@sordalab.com Page 5/10 Si vous avez deux petits verres de montre : - Noter " sucre réducteur » avec un feutre sur un verre de montre - Noter " amidon » sur l'autre verre de montre - Prélever de la solution notée " sucre réducteur » avec un compte-gouttes en plastique - Déposer une goutte de cette solution dans le verre de montre marqué " sucre réducteur » (une goutte suffit) - Prélever avec un autre compte-gouttes de la solution notée " amidon » - Déposer une goutte de cette solution dans le verre de montre marqué " amidon » (une goutte suffit) - Prélever avec un compte-gouttes de la solution brune notée " lugol » - Déposer une goutte de lugol sur chaque goutte réalisée dans les verres de montre - Observer et noter la couleur obtenue Si vous avez un grand verre de montre : - Tracer un trait au feutre pour partager le verre de montre en deux - D'un côté, noter " sucre réducteur » et de l'autre noter " amidon » - Prélever de la solution notée " sucre réducteur » avec un compte-gouttes en plastique - Déposer une goutte de cette solution dans le verre de montre du côté marqué " sucre réducteur » (une goutte suffit) - Prélever avec un autre compte-gouttes de la solution notée " amidon » - Déposer une goutte de cette solution dans le verre de montre du côté marqué " amidon » (une goutte suffit) - Prélever avec un compte-gouttes de la solution brune notée " lugol » - Déposer une goutte de lugol sur chaque goutte réalisée dans les verres de montre - Observer et noter la couleur obtenue 3) Réalisation des tests à la liqueur de Fehling A + B sur les solutions de glucose et d'amidon : Mettre des gants et des lunettes de protection - Mesurer 5 mL de la solution bleue notée " Fehling » dans une éprouvette de 25 mL - Ajouter ces 5 mL dans le récipient noté " sucre réducteur » - Noter la couleur de la solution - Mesurer 5 mL de la solution bleue notée " Fehling » dans une éprouvette de 25 mL - Ajouter ces 5 mL dans le récipient noté " amidon » - Noter la couleur de la solution - Donner les récipients au professeur pour qu'il les mette dans le bain-marie - Observer et noter les changements de couleur - Remplir le tableau type : Réactif Couleur LUGOL LIQUEUR DE FEHLING A + B Chauffée au bain-marie Du réactif Avec ajout de sucres réducteurs Avec ajout d'amidon
SORDALAB | PARC SUDESSOR - 15 Avenue des Grenots - 91150 ETAMPES - FRANCE Tél. : +33 1 69 92 26 72 - Fax : +33 1 69 92 26 74 - www.sordalab.com - Mail : info@sordalab.com Page 6/10 DIGESTION IN VITRO L'enseignant transvase le contenu du sachet noté " amylase » dans le flacon noté " amidon pour digestion » puis répartit à la pipette (ou avec une éprouvette) le contenu du flacon dans 6 petits béchers de 100 mL avec bec verseur : chaque récipient contient alors 10 mL de solution d'amidon 1) Identification des solutions distribuées : Noter " amidon » sur le bécher distribué par l'enseignant 2) Remplissage du sachet : Saisir les petits sachets de dialyse stockés dans le cristallisoir d'eau Faire rouler les sachets sous les doigts pour ouvrir le tube Verser délicatement le contenu du bécher noté " amidon » dans la membrane Fermer la membrane à l'aide d'une pince blanche en veillant à ne pas former trop de bulles d'air 3) Mise en route de la dialyse : Noter " compartiment sanguin » sur un bécher en verre de 100 mL Remplir ce bécher avec environ 30 mL d'eau très chaude Placer le sachet contenant l'amidon dans le bécher en veillant à orienter la pince blanche vers le haut Laisser le sachet dans le bécher pendant 45 minutes en agitant de temps en temps le bécher 4) Récupération des produits de dialyse : Récupérer le tube à dialyse Poser le tube sur un papier absorbant Noter " intestin » sur un bécher en verre de 100 mL Vider le contenu du tube dans ce bécher TESTS D'IDENTIFICATION SUR LES PRODUITS DE DIGESTION 1) Réalisation des tests au lugol sur les produits de digestion : Si vous avez deux petits verres de montre : - Noter " intestin » avec un feutre sur un verre de montre - Noter " sang » sur l'autre verre de montre - Prélever de la solution notée " intestin » avec un compte-gouttes en plastique - Déposer une goutte de cette solution dans le verre de montre marqué " intestin » (une goutte suffit) - Prélever avec un autre compte-gouttes de la solution notée " sang » - Déposer une goutte de cette solution dans le verre de montre marqué " sang » (une goutte suffit) - Prélever avec un compte-gouttes de la solution brune notée " lugol » - Déposer une goutte de lugol sur chaque goutte réalisée dans les verres de montre - Observer et noter la couleur obtenue
SORDALAB | PARC SUDESSOR - 15 Avenue des Grenots - 91150 ETAMPES - FRANCE Tél. : +33 1 69 92 26 72 - Fax : +33 1 69 92 26 74 - www.sordalab.com - Mail : info@sordalab.com Page 7/10 Si vous avez un grand verre de montre : - Tracer un trait au feutre pour partager le verre de montre en deux - D'un côté, noter " intestin » et de l'autre noter " sang » - Prélever de la solution notée " intestin » avec un compte-gouttes en plastique - Déposer une goutte de cette solution dans le verre de montre du côté marqué " intestin » (une goutte suffit) - Prélever avec un autre compte-gouttes de la solution notée " sang » - Déposer une goutte de cette solution dans le verre de montre du côté marqué " sang » (une goutte suffit) - Prélever avec un compte-gouttes de la solution brune notée " lugol » - Déposer une goutte de lugol sur chaque goutte réalisée dans les verres de montre - Observer et noter la couleur obtenue 2) Réalisation des tests à la liqueur de Fehling A + B sur les produits de digestion : Mettre des gants et des lunettes de protection - Mesurer 5 mL de la solution bleue notée " Fehling » dans une éprouvette de 25 mL - Ajouter ces 5 mL dans le récipient noté " intestin » - Noter la couleur de la solution - Mesurer 15 mL d'eau distillée dans une éprouvette de 25 mL - Ajouter ces 15 mL dans le récipient noté " sang » - Mesurer 10 mL de la solution bleue notée " Fehling » dans une éprouvette de 25 mL - Ajouter ces 10 mL dans le récipient noté " sang » - Noter la couleur de la solution - Donner les récipients au professeur pour qu'il les mette dans le bain-marie - Observer et noter les changements de couleur - Remplir le tableau type : Réactif Couleur LUGOL LIQUEUR DE FEHLING A + B Chauffée au bain-marie Dans le sachet de dialyse : intestin A l'extérieur du sachet : compartiment sanguin RESULTATS ATTENDUS ET INTERPRETATION TESTS D'IDENTIFICATION SUR LES PRODUITS TESTS D'IDENTIFICATION : Glucose et amidon par les tests au lugol et a la liqueur de fehling a + b Réactif Couleur LUGOL LIQUEUR DE FEHLING A + B Chauffée au bain-marie Du réactif Brun-orangé Bleu clair Avec ajout de sucres réducteurs Brun-orangé Rouge brique Avec ajout d'amidon Bleu-noir Bleu foncé puis rouge marron Rouge brique clair si le temps de chauffage est très long
SORDALAB | PARC SUDESSOR - 15 Avenue des Grenots - 91150 ETAMPES - FRANCE Tél. : +33 1 69 92 26 72 - Fax : +33 1 69 92 26 74 - www.sordalab.com - Mail : info@sordalab.com Page 8/10 "NB" : L'amidon donne un test négatif à la liqueur de Fehling mais si on le chauffe longtemps, il se dégrade (par hydrolyse à la chaleur) et donne une coloration rouge brique clair (beaucoup plus clair que le test du glucose) Conclusions : Le glucose réagit avec la liqueur de Fehling A + B chaude en donnant une coloration rouge brique. Le glucose ne réagit pas avec le lugol qui reste brun-orangé. L'amidon réagit avec le lugol en donnant une coloration bleu-noir mais ne réagit pas avec la liqueur de Fehling A + B chaude qui reste bleu voire bleu-foncé à moins de laisser l'amidon au chaud plus longtemps. % Pour aller plus loin : Les élèves se sont rendus compte que l'amidon est un sucre qui est dégradé par la chaleur, c'est-à-dire qu'il s'hydrolyse naturellement quand on le cuit. Le professeur peut alors expliquer que la cuisson des aliments permet à l'organisme de mieux assimiler les sucres comme l'amidon : quand on cuit une pomme de terre qui contient beaucoup d'amidon, elle devient alors plus riche en sucre plus petit que l'amidon et sera donc plus digeste mais aussi plus calorique. TESTS D'IDENTIFICATION SUR LES PRODUITS DE DIGESTION Réactif Couleur LUGOL LIQUEUR DE FEHLING A + B Chauffée au bain-marie Dans le sachet de dialyse : intestin Brun orangé Rouge brique A l'extérieur du sachet : compartiment sanguin Brun orangé Rouge brique clair Conclusions : Dans le sachet de dialyse, les élèves ont mis de l'amidon et de l'amylase au chaud. Après 45 minutes, le sachet de dialyse ne contient plus d'amidon et l'extérieur du sachet n'en contient pas non plus (test négatif au lugol) : cet amidon a donc été transformé en une autre substance. Or le s achet de dialyse et son extér ieur cont iennent des suc res réducteurs. Comme l'amidon est composé d'une chaîne de molécules de glucose, qui est un sucre réducteur, on peut conclure que l'amylase a coupé les molécules d'amidon en molécules de sucres réducteurs. Sachant que le bécher d'eau dans lequel a été plongée la membrane de dialyse ne contenait pas de sucres réducteurs ni d'amidon et qu'après dialyse , il contient des sucres, les élèves peu vent déduir e que les sucres ont passé la membrane pour se retrouver dans le bécher. La membrane de dialyse modélise la paroi intestinale et laisse passer certaines molécules dans le bécher contenant de l'eau qui modélise le compartiment sanguin. L'amidon digéré par l'amylase est coupé en molécules de sucres réducteurs : certains restent dans l'intestin et d'autres passent la paroi intestinale pour aller dans le sang.
SORDALAB | PARC SUDESSOR - 15 Avenue des Grenots - 91150 ETAMPES - FRANCE Tél. : +33 1 69 92 26 72 - Fax : +33 1 69 92 26 74 - www.sordalab.com - Mail : info@sordalab.com Page 9/10 Les élèves peuvent se rendre compte que la coloration rouge brique est plus pâle lors du test à la liqueur de Fehling dans le compartiment sanguin que dans l'intestin : seulement quelques sucres passent la paroi intestinale, ce sont les plus petites molécules de sucres. En effet, lors de la digestion, se sont les molécules de glucose, des sucres très petits qui passent la paroi intestinale pour aller dans le sang et alimenter les organes en énergie. L'absorption intestinale est sélective du point de vue de la taille des nutriments. Etant donné qu'il reste du sucre (donc de l'énergie) dans l'intestin, les élèves peuvent comprendre qu'il est nécessaire d'avoir d'autres enzymes digestives pour pouvoir assimiler toute cette énergie : l'amylase n'est pas la seule enzyme qui intervient dans le processus de digestion de l'amidon (besoin en maltases, saccharases, lactases ...) Schéma bilan représentant la digestion In Vitro réalisée : FICHE SECURITE (guide non exhaustif) L'amylase, l'amidon, le glucose, le lugol et les membranes de dialyse ne requièrent pas de précautions d'utilisation particulières. L'Amylase étant une enzyme de digestion celle-ci doit être manipulée avec des gants pour éviter tout contact direct avec la peau et ingestion accidentelle. Ne pas ingérer. En cas de contact avec les yeux ou la peau, rincer abondamment. Produit Pictogramme et risques normalisés Actions à mener en cas de contact avec la peau inhalation projection dans les yeux ingestion Liqueur de Fehling A + B Corrosif Dangereux pour l'environnement Laver immédiatement la peau avec une grande quantité d'eau savonneuse pendant au moins 15 minutes. Laver les vêtements contaminés avant de les utiliser. Faire respirer de l'air frais Rincer immédiate ment les yeux à grande eau pendant au moins 15 minutes en séparant les paupières et contacter un ophtalmologiste. rincer immédiatement la bouche avec de l'eau et contacter un médecin.
SORDALAB | PARC SUDESSOR - 15 Avenue des Grenots - 91150 ETAMPES - FRANCE Tél. : +33 1 69 92 26 72 - Fax : +33 1 69 92 26 74 - www.sordalab.com - Mail : info@sordalab.com Page 10/10 FICHE CONSERVATION Le sachet K doit être stocké à +4 °C. L'amidon, le glucose, l'amylase se conservent au réfrigérateur pendant plusieurs mois. Le sachet L et le flacon noté " Fehling » sont stockés à température ambiante. La liqueur de Fehling A + B se conserve plusieurs mois Les membranes et le lugol peuvent se conserver quelques années tant qu'ils ne sont pas contaminés. FICHE TRI ET RECUPERATION La liqueur de Fehling doit être récupérée dans des bacs de récupération des produits corrosifs, prévus à cet effet. Les autres produits liquides peuvent être jetés à l'évier avec de grandes quantités d'eau.
quotesdbs_dbs29.pdfusesText_35[PDF] diholoside réducteur et non réducteur
[PDF] pouvoir réducteur des glucides
[PDF] le système hormonal
[PDF] glandes endocrines et hormones
[PDF] système endocrinien pour les nuls
[PDF] liste des hormones pdf
[PDF] type d'hormone
[PDF] les hormones et leurs fonctions pdf
[PDF] lipides simples et complexes
[PDF] classification des microorganismes ppt
[PDF] le monde microbien wikipedia
[PDF] tableau de classification des micro-organisme
[PDF] pfe pont dalle
[PDF] pont a poutre en béton armé pdf
