 1. Déterminer la masse atomique moyenne du carbone sachant quil
1. Déterminer la masse atomique moyenne du carbone sachant quil
m.a.m. = (m 12C x % abondance) + (m 13C x % abondance) Isotope. Masse atomique. (u). % abondance ... Calculer la masse atomique moyenne du.
 Chapitre 5 La mole
Chapitre 5 La mole
Par exemple le magnésium a 3 isotopes naturels
 7 abondances naturelles des isotopes
7 abondances naturelles des isotopes
Afin d'aider le lecteur à apprécier les valeurs d'abondance naturelle telles pour le calcul de 13?g/b as 13?g/b ? 1 avec 13?g/b = 0.0111421/0.0112372 ...
 LA METHODE ISOTOPIQUE
LA METHODE ISOTOPIQUE
ABONDANCE ISOTOPIQUE. (Pour les détails voir volume I). L'hydrogène et l'oxygène comportent un certain nombre d'isotopes
 TP BT06 MS_LCESI_2012 QTOF
TP BT06 MS_LCESI_2012 QTOF
Abondance isotopique = pourcentage des isotopes d'un élément dans la nature Calcul de l'abondance relative des satellites isotopiques M+1 M+2 pour.
 1. Lazote possède 2 isotopes. La masse de lazote 14 équivaut à 14
1. Lazote possède 2 isotopes. La masse de lazote 14 équivaut à 14
détermine le % abondance de chacun des isotopes. Isotope abondance 15N = 100 – X = 100 - 9964 = 0
 Chimie 30S Devoir : Masse atomique moyenne 1. Les deux isotopes
Chimie 30S Devoir : Masse atomique moyenne 1. Les deux isotopes
2. À l'état naturel le silicium se compose de trois isotopes. Voici ces isotopes suivis de leur abondance relative et de leur masse atomique : le Si.
 Module 2- Quantités chimiques
Module 2- Quantités chimiques
chaque isotope présent dans un élément porte le nom d'abondance relative Afin de calculer la masse atomique moyenne d'un élément il faut.
 T.D. N° 01 DE CHIMIE
T.D. N° 01 DE CHIMIE
Quel est l'isotope du silicium le plus abondant ? 2. Calculer l'abondance naturelle des deux autres isotopes. Exercice 4. Les masses du proton du neutron et de
 UE - Éléments Chimiques TD1 : Latome
UE - Éléments Chimiques TD1 : Latome
2) Calculer l'abondance naturelle des deux isotopes de l'antimoine. Exercice 4. Le bore (B) a une masse atomique moyenne de 10811 u et un numéro atomique Z
 Isotopes et spectrométrie de masse (leçon) Khan Academy
Isotopes et spectrométrie de masse (leçon) Khan Academy
LA METHODE ISOTOPIQUE 2 1 ABONDANCE ISOTOPIQUE (Pour les détails voir volume I) L’hydrogène et l’oxygène comportent un certain nombre d’isotopes dont les variations dans les eaux naturelles servent de support à l’utilisation des techniques isotopiques en Hydrologie
 4 VARIATIONS DES ABONDANCES PAR LES PROCESSUS NATURELS - IAEA
4 VARIATIONS DES ABONDANCES PAR LES PROCESSUS NATURELS - IAEA
Les valeurs de ? déterminées par les laboratoires isotopiques peuvent alors être transformées en valeurs R en appliquant (réécriture de l’équation 4 2): R = Rr(1 + ?) (4 3) ou les valeurs Rrsont les rapports isotopiques des matériaux de référence internationaux qui seront définis plus loin dans le Chapitre 7
 Spectrométrie de masse –Introduction
Spectrométrie de masse –Introduction
• Abondance isotopique = pourcentage des isotopes d’un élément dans la nature • Masse moyenne pondérée (MM) = Masse atomique apparaissant sur le tableau périodique et qui tient compte des isotopes et de leur abondance Exemple : nbre de nbre de protons : nucléons : nbre nbre de nbre masse abondance abondance
Qu'est-ce que l' abondance relative d'un isotope ?
Les atomes qui possèdent un même nombre de protons et d'électrons mais un nombre différent de neutrons sont appelés isotopes. Les isotopes possèdent des masses atomiques différentes. L' abondance relative d'un isotope correspond à la proportion sur Terre d'un même élément de masse atomique spécifique.
Comment calculer l'abondance d'un isotope ?
L'abondance relative de chaque isotope peut être déterminée à partir de la hauteur, ou intensité, du pic de rapport masse sur charge correspondant. Sur la simulation du spectre de masse, on suppose que chaque ion identifié par un pic est porteur d'une charge 1+ 1+, permettant ainsi de calculer la masse atomique de chaque isotope.
Comment détecter les isotopes ?
Isotopes et masse atomique. Comment les isotopes peuvent être détectés à l’aide de la spectrométrie de masse. Les atomes qui possèdent un même nombre de protons et d'électrons mais un nombre différent de neutrons sont appelés isotopes. Les isotopes possèdent des masses atomiques différentes.
Comment définir un isotope en particulier ?
De la même façon que le numéro atomique définit l'élément, le nombre de masse définit l'isotope spécifique de cet élément en particulier. De fait, la façon la plus simple de définir un isotope en particulier est d'utiliser la notation "nom de l'élément - nombre de masse".
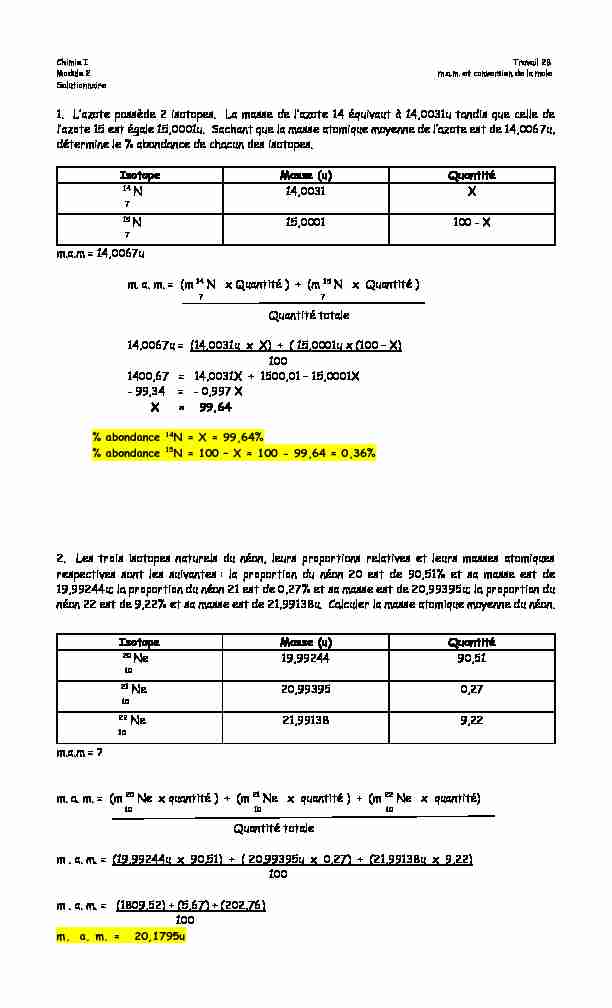
Chimie I Travail 2B
Module 2 m.a.m. et conversion de la moleSolutionnaire
1. I·M]RPH SRVVqGH 2 LVRPRSHVB IM PMVVH GH O·M]RPH 14 pTXLYMXP j 140031X PMQGLV TXH ŃHOOH GH
l·M]RPH 1D HVP pJMOH 1D0001XB 6MŃOMQP TXH OM PMVVH MPRPLTXH PR\HQQH GH O·M]RPH HVP GH 140067X
détermine le % abondance de chacun des isotopes.Isotope Masse (u) Quantité
14 N7 14,0031 X
15 N7 15,0001 100 - X
m.a.m = 14,0067u m. a. m. = (m 14 N x Quantité ) + (m 15 N x Quantité )7 7
Quantité totale
14,0067u = (14,0031u x X) + ( 15,0001u x (100 ² X)
1001400,67 = 14,0031X + 1500,01 ² 15,0001X
- 99,34 = - 0,997 XX = 99,64
% abondance 14N = X = 99,64% % abondance 15N = 100 ² X = 100 - 99,64 = 0,36%2. Les trois isotopes naturels du néon, leurs proportions relatives et leurs masses atomiques
respectives sont les suivantes : la proportion du néon 20 est de 90,51% et sa masse est de19,99244u; la proportion du néon 21 est de 0,27% et sa masse est de 20,99395u; la proportion du
néon 22 est de 9,22% et sa masse est de 21,99138u. Calculer la masse atomique moyenne du néon.
Isotope Masse (u) Quantité
20 Ne10 19,99244 90,51
21 Ne10 20,99395 0,27
22 Ne10 21,99138 9,22
m.a.m = ? m. a. m. = (m 20 Ne x quantité ) + (m 21 Ne x quantité ) + (m 22 Ne x quantité)10 10 10
Quantité totale
m . a. m. = (19,99244u x 90,51) + ( 20,99395u x 0,27) + (21,99138u x 9,22) 100m . a. m. = (1809,52) + (5,67) + (202,76) 100
m. a. m. = 20,1795u
3. Le cuivre a deux isotopes naturels : le cuivre 63, dont la masse est de 62,9298u et le cuivre 65,
dont la masse est de 64,9278u. Sachant que la masse atomique moyenne du cuivre est de 63,546u, déterminer le % abondance (proportion) de chaque isotope.Isotope Masse (u) Quantité
63 Cu29 62,9298 X
65 Cu29 64,9278 100 - X
m.a.m = 63,546u m. a. m. = (m 63 Cu x Quantité ) + (m 65 Cu x Quantité )29 29
Quantité totale
63,546 u = (62,9298u x X) + ( 64,9278u x (100 ² X)
1006354,6 = 62,9298X + 6492,78 ² 64,9278X
-138,18 = - 1,998 XX = 69,16
% abondance 63Cu = X = 69,16% % abondance 65Cu = 100 ² X = 100 - 69,16 = 30,84%4. Combien de moles de magnésium y a-t-il dans 5,23 x 1023 atomes de magnésium?
1 mol Mg = 6,02 x 1023 atomes Mg
5,23 x 1023 atomes Mg x 1 mol = 0,8688 mol Mg
6,02 x 1023 atomes Mg
5. Combien de molécules y a-t-il dans 5,6 moles de chlorure de cuivre II (CuCl2)?
1 mol CuCl2 = 6,02 x 1023 molécules CuCl2
5,6 mol CuCl2 x 6,02 x 1023 molécules CuCl2 = 3,37 x 1024 molécules CuCl2
1 mol6B 4XHOOH HVP OM TXMQPLPp GH PROHV G·MŃLGH VXOIXULTXH +2SO4) présente dans 1,9 x 10-5 molécules
G·MŃLGH"
1 mol H2 SO4 = 6,02 x 1023 molécules H2SO4
1,9 x 10-5 molécules H2SO4 x 1 mol = 3,16 x 10-29 mol H2SO4
6,02 x 1023 molécules H2SO4
7. Quelle est la quantité de molécules présente dans 387 moles de NiCO3?
1 mol NiCO3 = 6,03 x 1023 molécules NiCO3
387 mol NiCO3 x 6,02 x 1023 molécules NiCO3 = 2,33 x 1026 molécules NiCO3
1 mol N FRPNLHQ G·MPRPHV de carbone y a-t-il dans cet échantillon?1 molécule NiCO3 = 1 atome C
2,33 x 1026 molécules NiCO3 x 1 atomeC = 2,33 x 1026 atomes C
1 molécule NiCO3
quotesdbs_dbs29.pdfusesText_35[PDF] calculer le pourcentage d'abondance de l'isotope
[PDF] calcul rapport volumétrique
[PDF] calculateur de cylindrée moteur
[PDF] calcul de cylindrée en cm3
[PDF] calcul cylindrée moteur 2 temps
[PDF] calcul volume chambre de combustion
[PDF] formule alesage
[PDF] calcul alésage d'un cylindre
[PDF] calculer la course d'un moteur
[PDF] liposolubilité d'un médicament
[PDF] delai d'action d'un medicament definition
[PDF] voie d'excrétion des médicaments
[PDF] la dose de charge definition
[PDF] liste médicaments liposolubles
