 Conductance et conductivité
Conductance et conductivité
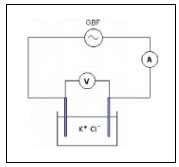
Exercice 1 : La mesure de la conductivité d'une solution de chlorure de potassium + + − de concentration C.
 LA CONDUCTIMÉTRIE
LA CONDUCTIMÉTRIE
EXERCICES. Partie 1/ Chimie minérale. Fiche 8 : Conductimétrie. Quelques ions avec leur conductivité molaire ionique en S.m2.mol-1. Cuivre. Fer 2. Sodium.
 Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
Justifier votre réponse. ACCÈS CORRECTION. Extrait 8 : Bac S 2014 Pondichéry http://labolycee.org. Exercice Le titrage est suivi par conductimétrie. Le volume ...
 Solution de Exercices de La conductance et la conductivité
Solution de Exercices de La conductance et la conductivité
2) les facteurs qui influencent la conductivité sont : -- la température de la solution. -- la concentration (C) de la solution ionique. Exercice_4. On veut
 Cours de soutien Conductance et conductivité 1BAC Fr. Bac
Cours de soutien Conductance et conductivité 1BAC Fr. Bac
Quelle est la valeur de la conductance G ? Exercice 4 : Conductance et conductivité molaire ionique : 1) La conductance d'une solution de chlorure de sodium
 Chapitre 2 – Analyse dun système Exercices supplémentaires
Chapitre 2 – Analyse dun système Exercices supplémentaires
Une sonde conductimétrique est immergée dans une solution ionique de chlorure de potassium. (K+(aq) Cl–(aq)). La conductance mesurée est de 5
 Exercices : corrigé
Exercices : corrigé
On veut suivre l'évolution de la réaction par conductimétrie. On rappelle que la conductivité s de la solution est donnée par l'expression : = °i.Ci i. Où
 Terminale générale - Méthodes danalyse physique - Exercices
Terminale générale - Méthodes danalyse physique - Exercices
m-1. Déterminer la conductivité d'une solution à 10-3mol.L-1 de KOH. (K++OH-). Exercice 6 corrigé disponible. Dans les mêmes conditions expérimentales on
 1ére bac SMF Mahdade Allal année scolaire 2015-2016
1ére bac SMF Mahdade Allal année scolaire 2015-2016
CONDUCTION DANS LES SOLUTIONS : exercices. Choisir la (ou les) bonne(s) À partir des conductances mesurées déterminer la conductivité σ des solutions 1
 Conductance et conductivité
Conductance et conductivité
Exercice 1 : La mesure de la conductivité d'une solution de chlorure de potassium + + ? de concentration C.
 Exercices : corrigé
Exercices : corrigé
Où Ci est la concentration de l'ion i exprimée en mol.L-1 et ?i° la conductivité molaire à dilution infinie de l'ion i. ?i° est propre à chaque ion.
 Travaux dirigés : Conductance et Conductivité
Travaux dirigés : Conductance et Conductivité
Le corrigé des exercices du livre indiqués sur la feuille est aussi sur le Une cellule conductimétrique est constituée de deux électrodes de surface S ...
 Ch.18. Exercice corrigé p : 479 n°10. CONTRÔLE DE QUALITE PAR
Ch.18. Exercice corrigé p : 479 n°10. CONTRÔLE DE QUALITE PAR
Justifier l'évolution de la conductivité. On dose par titrage conductimétrique
 Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
métrique conductimétrique et par pente dans un titrage conductimétrique. ... EXERCICE 2 – UN EXEMPLE DE CHIMIE VERTE : LA SYNTHÈSE DE L'IBUPROFÈNE.
 Cours de soutien Conductance et conductivité 1BAC Fr. Bac
Cours de soutien Conductance et conductivité 1BAC Fr. Bac
Exercice 4 : Conductance et conductivité molaire ionique : 1) La conductance d'une solution de chlorure de sodium de concentration C1= 0
 Conductance et conductivité dune solution ionique
Conductance et conductivité dune solution ionique
exercices corrigés. À l'aide d'un conductimètre on mesure la conductivité ? = 4
 Terminale générale - Méthodes danalyse physique - Exercices
Terminale générale - Méthodes danalyse physique - Exercices
Exercice 3 corrigé disponible. On plonge une cellule de conductimétrie dans une solution pour mesurer sa conductivité ? . 1. Réaliser le schéma du montage
 Suivi temporel dune transformation chimique vitesse de réaction
Suivi temporel dune transformation chimique vitesse de réaction
Exercices corrigés. Exercice 1 : 7- La réaction précédente peut-être suivie en mesurant la conductivité de la solution en fonction du.
 Chapitre 2 – Analyse dun système Exercices supplémentaires
Chapitre 2 – Analyse dun système Exercices supplémentaires
Une sonde conductimétrique est immergée dans une solution ionique de chlorure de potassium. (K+(aq) Cl–(aq)). La conductance mesurée est de 5
 [PDF] Conductance et conductivité - AlloSchool
[PDF] Conductance et conductivité - AlloSchool
Exercice 1 : La mesure de la conductivité d'une solution de chlorure de potassium + + ? de concentration C donne 1224 ?1 à 21°C
 [PDF] Travaux dirigés : Conductance et Conductivité
[PDF] Travaux dirigés : Conductance et Conductivité
Travaux dirigés : Conductance et Conductivité * Le corrigé des exercices du livre indiqués sur la feuille est aussi sur le site du lycée *
 [PDF] Corrigés des exercices sur la conductimétrie
[PDF] Corrigés des exercices sur la conductimétrie
Corrigés des exercices sur la conductimétrie 6 page 69 8 page 70 a La conductance G est proportionnelle à la conductivité ?elle même proportionnelle la
 [PDF] ex08conductimetriepdf
[PDF] ex08conductimetriepdf
EXERCICES Partie 1/ Chimie minérale Fiche 8 : Conductimétrie Quelques ions avec leur conductivité molaire ionique en S m2 mol-1
 [PDF] Exercices : corrigé
[PDF] Exercices : corrigé
Où Ci est la concentration de l'ion i exprimée en mol L-1 et ?i° la conductivité molaire à dilution infinie de l'ion i ?i° est propre à chaque ion
 Telecharger 08conductimetrie-correctionpdf pdf examens corriges
Telecharger 08conductimetrie-correctionpdf pdf examens corriges
CORRECTION EXERCICES Partie 1/ Chimie minérale Fiche 8 : Conductimétrie Quelques ions avec leur conductivité molaire ionique en S m2 mol-1
 [PDF] solution-de-exercices-de-la-conductance-et-la-conductivitc3a9pdf
[PDF] solution-de-exercices-de-la-conductance-et-la-conductivitc3a9pdf
1 2) La conductivité d'une partie d'une solution électrolytique dépend de la tension appliquée aux électrodes et au courant électrique qui passe dans le
 [PDF] Ch18 Exercice corrigé p : 479 n°10 CONTRÔLE DE QUALITE PAR
[PDF] Ch18 Exercice corrigé p : 479 n°10 CONTRÔLE DE QUALITE PAR
EXERCICE p : 479 n°10 Justifier l'évolution de la conductivité On dose par titrage conductimétrique une solution SA d'acide chlorhydrique H3O+
 [PDF] correction exercices de revision : conductivite des solutions - PC-STL
[PDF] correction exercices de revision : conductivite des solutions - PC-STL
CORRECTION EXERCICES DE REVISION : CONDUCTIVITE DES SOLUTIONS Exercice 1 (D'après BTS BIOTECHNO 2002 Conductivité Composé peu solubles)
Thème3 : AGIR - DEFIS DU XXIe SIECLE p : 1 Exercices corrigés. Ch.18. Contrôle de qualité par dosage
Ch.18. Exercice corrigé p : 479 n°10. CONTRÔLE DE QUALITE PAR DOSAGEEXERCICE p : 479 n°10.
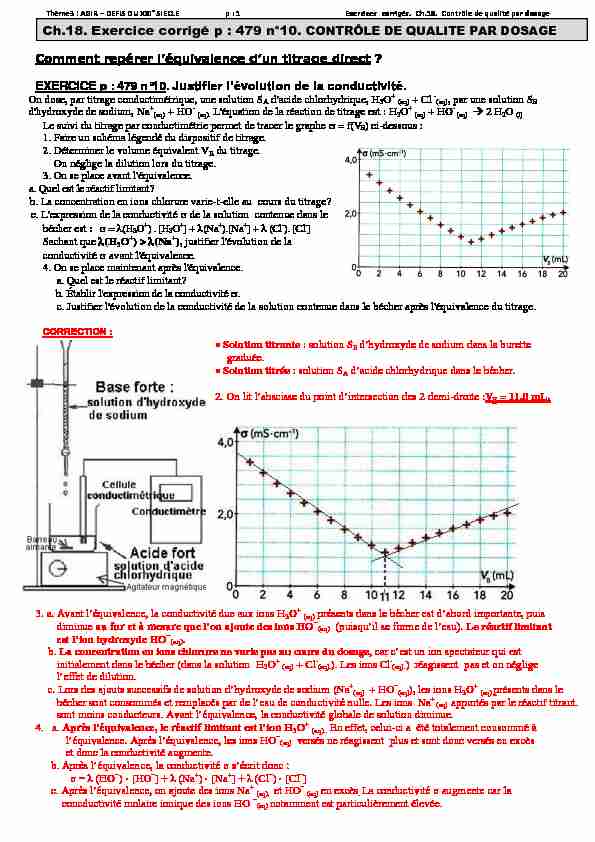
On dose, par titrage conductimétrique, une solution SA d'acide chlorhydrique, H3O+ (aq) + Cl -(aq), par une solution SB
d'hydroxyde de sodium, Na+(aq) + HO- (aq). L'équation de la réaction de titrage est : H3O+ (aq) + HO- (aq) AE 2 H2O (l)
Le suivi du titrage par conductimétrie permet de tracer le graphe = f(VB) ci-dessous :1. Faire un schéma légendé du dispositif de titrage.
2. Déterminer le volume équivalent VE du titrage.
On néglige la dilution lors du titrage.
3. On se place avant l'équivalence.
a. Quel est le réactif limitant? b. La concentration en ions chlorure varie-t-elle au cours du titrage? c. L'expression de la conductivité de la solution contenue dans le bécher est : = (H3O+) . [H3O+] + (Na+).[Na+] + (Cl-). [Cl-] Sachant que (H3O+) > (Na+), justifier l'évolution de la conductivité avant l'équivalence.4. On se place maintenant après l'équivalence.
a. Quel est le réactif limitant? b. Établir l'expression de la conductivité .c. Justifier l'évolution de la conductivité de la solution contenue dans le bécher après l'équivalence du titrage.
CORRECTION :
Solution titrante : solution SB
graduée.Solution titrée : solution SA
la conductivité due aux ions H3O+ (aq) diminue (aq) Le réactif limitantHO(aq).
b. La concentration en ions chlorure ne varie pas au cours du dosagequi estinitialement dans le bécher (dans la solution H3O+ (aq) + Cl-(aq).). Les ions Cl-(aq).) réagissent pas et on néglige
de dilution. (Na+(aq) + HO(aq)), les ions H3O+ (aq) présents dans lebécher sont consommés et remplacés par Les ions Na+ (aq) apportés par le réactif titrant.
sont moins conducteurs. a conductivité globale de solution diminue.4. a. H3O+ (aq).. En effet, celui-ci a été totalement consommé à
HO(aq) versés ne réagissent plus et sont donc versés en excès et donc la conductivité augmente. b. a ı ıȜௗ) · [HOȜௗ+) · [Na+Ȝௗ) · [Cl] c. on ajoute des ions Na+ (aq), et HO (aq) en excès. La ı car la concductivité molaire ionique des ions HO (aq) notamment est particulièrement élevée. 1.Thème3 : AGIR - DEFIS DU XXIe SIECLE p : 2 Exercices corrigés. Ch.18. Contrôle de qualité par dosage
Ch.18. Exercice corrigé p : 479 n°11. CONTRÔLE DE QUALITE PAR DOSAGE EXERCICE p : 479 n°11. Doser par titrage pH-métrique. Le document ci-contre présente le graphe pH = f(VB) obtenu lors du titrage d'un volume VA = 20,0 mL d'une solution SA d'acide méthanoïque de concentration CA par une solution SB d'hydroxyde de sodium, Na+(aq) + HO- (aq), de concentration CB = 2,50 x 10-2 mol .L-1.1. Faire un schéma légendé du dispositif de titrage.
2. Écrire l'équation de la réaction de titrage.
3. Déterminer graphiquement le volume équivalent VE.
4. Établir la relation entre les concentrations et les volumes traduisant
l'équivalence du titrage.5. Calculer la concentration CA. Données : couples acide/base :
HCOOH (aq) / HCOO- (aq) et H2O (l) / HO- (aq)
CORRECTION :
1. Voir schéma ci-c-dessous.
Réactif titrant : Solution SB
CB = 2,50 × 102 mol.L1 dans la burette graduée.Réactif titré : Solution SA CA
à déterminer et de volume VA = 20,0 mL dans le bécher.2. Equation de la réaction de titrage.
de titrage est rapide, totale, unique)3. VE = 9,0 mL.
Méthode des tangentes parallèles.
4. Relation à
A :HCOOH (acide faible) et réactif titrant (ions HO-) sont totalement consommés et ont n0 (HCOOH)titrée dans SA = n (HO) versée à 1 1 Soit : n0 (HCOOH) titrée dans SA = n (HO) versée à soit : CA · VA = CB · VBE avec CB = 2,50 × 102 mol.L1 ; VBE = 9,0 mLet VA = 20,0 mL (dans le bécher)5. Calcul de la concentration CA.
64quotesdbs_dbs29.pdfusesText_35
[PDF] conductimétrie formule
[PDF] conductimétrie pdf
[PDF] conductivité de l'eau potable
[PDF] facteur de correction température conductivité
[PDF] influence de la température sur la conductivité de l'eau
[PDF] conversion conductivité salinité
[PDF] conversion ms/cm en g/l
[PDF] conductivité en fonction de la température
[PDF] la conductivité d'une solution
[PDF] mesure de conductivité d'une solution
[PDF] relation conductivité température
[PDF] facteur de correction conductivité
[PDF] conductivité eaux usées domestiques
[PDF] cours conductivité électrique pdf
