 Conductance et conductivité
Conductance et conductivité
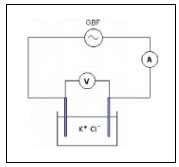
Exercice 1 : La mesure de la conductivité d'une solution de chlorure de potassium + + − de concentration C.
 LA CONDUCTIMÉTRIE
LA CONDUCTIMÉTRIE
EXERCICES. Partie 1/ Chimie minérale. Fiche 8 : Conductimétrie. Quelques ions avec leur conductivité molaire ionique en S.m2.mol-1. Cuivre. Fer 2. Sodium.
 Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
Justifier votre réponse. ACCÈS CORRECTION. Extrait 8 : Bac S 2014 Pondichéry http://labolycee.org. Exercice Le titrage est suivi par conductimétrie. Le volume ...
 Solution de Exercices de La conductance et la conductivité
Solution de Exercices de La conductance et la conductivité
2) les facteurs qui influencent la conductivité sont : -- la température de la solution. -- la concentration (C) de la solution ionique. Exercice_4. On veut
 Cours de soutien Conductance et conductivité 1BAC Fr. Bac
Cours de soutien Conductance et conductivité 1BAC Fr. Bac
Quelle est la valeur de la conductance G ? Exercice 4 : Conductance et conductivité molaire ionique : 1) La conductance d'une solution de chlorure de sodium
 Chapitre 2 – Analyse dun système Exercices supplémentaires
Chapitre 2 – Analyse dun système Exercices supplémentaires
Une sonde conductimétrique est immergée dans une solution ionique de chlorure de potassium. (K+(aq) Cl–(aq)). La conductance mesurée est de 5
 Exercices : corrigé
Exercices : corrigé
On veut suivre l'évolution de la réaction par conductimétrie. On rappelle que la conductivité s de la solution est donnée par l'expression : = °i.Ci i. Où
 Terminale générale - Méthodes danalyse physique - Exercices
Terminale générale - Méthodes danalyse physique - Exercices
m-1. Déterminer la conductivité d'une solution à 10-3mol.L-1 de KOH. (K++OH-). Exercice 6 corrigé disponible. Dans les mêmes conditions expérimentales on
 Ch.18. Exercice corrigé p : 479 n°10. CONTRÔLE DE QUALITE PAR
Ch.18. Exercice corrigé p : 479 n°10. CONTRÔLE DE QUALITE PAR
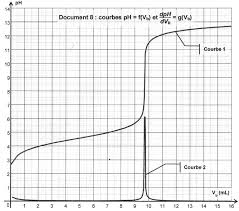
La concentration en ions chlorure varie-t-elle au cours du titrage? c. L'expression de la conductivité σ de la solution contenue dans le bécher est : σ = λ(H3O+)
 1ére bac SMF Mahdade Allal année scolaire 2015-2016
1ére bac SMF Mahdade Allal année scolaire 2015-2016
CONDUCTION DANS LES SOLUTIONS : exercices. Choisir la (ou les) bonne(s) À partir des conductances mesurées déterminer la conductivité σ des solutions 1
 Conductance et conductivité
Conductance et conductivité
Exercice 1 : La mesure de la conductivité d'une solution de chlorure de potassium + + ? de concentration C.
 Exercices : corrigé
Exercices : corrigé
Où Ci est la concentration de l'ion i exprimée en mol.L-1 et ?i° la conductivité molaire à dilution infinie de l'ion i. ?i° est propre à chaque ion.
 Travaux dirigés : Conductance et Conductivité
Travaux dirigés : Conductance et Conductivité
Le corrigé des exercices du livre indiqués sur la feuille est aussi sur le Une cellule conductimétrique est constituée de deux électrodes de surface S ...
 Ch.18. Exercice corrigé p : 479 n°10. CONTRÔLE DE QUALITE PAR
Ch.18. Exercice corrigé p : 479 n°10. CONTRÔLE DE QUALITE PAR
Justifier l'évolution de la conductivité. On dose par titrage conductimétrique
 Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
métrique conductimétrique et par pente dans un titrage conductimétrique. ... EXERCICE 2 – UN EXEMPLE DE CHIMIE VERTE : LA SYNTHÈSE DE L'IBUPROFÈNE.
 Cours de soutien Conductance et conductivité 1BAC Fr. Bac
Cours de soutien Conductance et conductivité 1BAC Fr. Bac
Exercice 4 : Conductance et conductivité molaire ionique : 1) La conductance d'une solution de chlorure de sodium de concentration C1= 0
 Conductance et conductivité dune solution ionique
Conductance et conductivité dune solution ionique
exercices corrigés. À l'aide d'un conductimètre on mesure la conductivité ? = 4
 Terminale générale - Méthodes danalyse physique - Exercices
Terminale générale - Méthodes danalyse physique - Exercices
Exercice 3 corrigé disponible. On plonge une cellule de conductimétrie dans une solution pour mesurer sa conductivité ? . 1. Réaliser le schéma du montage
 Suivi temporel dune transformation chimique vitesse de réaction
Suivi temporel dune transformation chimique vitesse de réaction
Exercices corrigés. Exercice 1 : 7- La réaction précédente peut-être suivie en mesurant la conductivité de la solution en fonction du.
 Chapitre 2 – Analyse dun système Exercices supplémentaires
Chapitre 2 – Analyse dun système Exercices supplémentaires
Une sonde conductimétrique est immergée dans une solution ionique de chlorure de potassium. (K+(aq) Cl–(aq)). La conductance mesurée est de 5
 [PDF] Conductance et conductivité - AlloSchool
[PDF] Conductance et conductivité - AlloSchool
Exercice 1 : La mesure de la conductivité d'une solution de chlorure de potassium + + ? de concentration C donne 1224 ?1 à 21°C
 [PDF] Travaux dirigés : Conductance et Conductivité
[PDF] Travaux dirigés : Conductance et Conductivité
Travaux dirigés : Conductance et Conductivité * Le corrigé des exercices du livre indiqués sur la feuille est aussi sur le site du lycée *
 [PDF] Corrigés des exercices sur la conductimétrie
[PDF] Corrigés des exercices sur la conductimétrie
Corrigés des exercices sur la conductimétrie 6 page 69 8 page 70 a La conductance G est proportionnelle à la conductivité ?elle même proportionnelle la
 [PDF] ex08conductimetriepdf
[PDF] ex08conductimetriepdf
EXERCICES Partie 1/ Chimie minérale Fiche 8 : Conductimétrie Quelques ions avec leur conductivité molaire ionique en S m2 mol-1
 [PDF] Exercices : corrigé
[PDF] Exercices : corrigé
Où Ci est la concentration de l'ion i exprimée en mol L-1 et ?i° la conductivité molaire à dilution infinie de l'ion i ?i° est propre à chaque ion
 Telecharger 08conductimetrie-correctionpdf pdf examens corriges
Telecharger 08conductimetrie-correctionpdf pdf examens corriges
CORRECTION EXERCICES Partie 1/ Chimie minérale Fiche 8 : Conductimétrie Quelques ions avec leur conductivité molaire ionique en S m2 mol-1
 [PDF] solution-de-exercices-de-la-conductance-et-la-conductivitc3a9pdf
[PDF] solution-de-exercices-de-la-conductance-et-la-conductivitc3a9pdf
1 2) La conductivité d'une partie d'une solution électrolytique dépend de la tension appliquée aux électrodes et au courant électrique qui passe dans le
 [PDF] Ch18 Exercice corrigé p : 479 n°10 CONTRÔLE DE QUALITE PAR
[PDF] Ch18 Exercice corrigé p : 479 n°10 CONTRÔLE DE QUALITE PAR
EXERCICE p : 479 n°10 Justifier l'évolution de la conductivité On dose par titrage conductimétrique une solution SA d'acide chlorhydrique H3O+
 [PDF] correction exercices de revision : conductivite des solutions - PC-STL
[PDF] correction exercices de revision : conductivite des solutions - PC-STL
CORRECTION EXERCICES DE REVISION : CONDUCTIVITE DES SOLUTIONS Exercice 1 (D'après BTS BIOTECHNO 2002 Conductivité Composé peu solubles)
=Δ..(2)(1)(2)=Δ..Δ..=ΔΔ=ΔΔ.()=2()=Δ()Δ.Δ()=Δ()Δ=Δ.2=Δ2=7402=370=15Δ=600Quand=50d"après la courbe on trouvela variation de pressionΔest600
=ΔΔ.=600740×0,3=0,24()()()()()9,2-0,24=8,960,6-2×0,24=0,07=0,24=0,241-1-Définitions:Un oxydant est une espèce chimique capable de capter un ou plusieurs d"électrons.Un réducteurest une espèce chimique capable de céder un ou plusieurs d"électrons.1-2-Les couples redox et les demi-équations:Couple()()réduction de l"eau oxygénée()+2()+2?2Couple()()oxydation des ions iodure2()?+22-1-Les réactifs sont-ils dans les conditions stchiométriques?=()=.=0,10×20,0.10=2,0=()=.=0,10×2,0.10=0,2D"après l"équation de la réaction, les réactifs sont en propositions stchiométriques si:()2=()()=()10Les réactifs ne sont pas dans les conditions stchiométriques.
2-2-Tableau descriptif:Equation()+2()+2()()+4()Etat initialè0èEtat intermédiaire--2èèEtat final--2èè=300()-(300)=0,20-0,09=0,11-2×(300)=2,0-2×0,09=1,8è(300)=0,09è2-3-Relation entre[]et:[]=Avec=20,0+8,0+2,0=302-4-Détermination de:Si le diiode est le réactif limitant alors-2=0soit:==1,0Si l"eau est le réactif limitant alors-=0soit:==0,20Le réactif limitant est l"eau oxygénéecar il donne la valeur dela plus faible.[]==,=6,7.10.Lorsque la transformation est terminée3-1-La composition du mélange à=300:On utilise l"échelle horizontale du document:2500=14,8300=14,8×3002500=1,8On trace un segment de=1,8pour repérer=300On utilise l"échelle verticale du document:2,5.10=11,3(300)=4,2=2,5.10×4,211,3=0,93.10=0,093Soit(300)=0,09
Composition:Equation()+2()+2()()+4()Etat initialè0èEtat intermédiaire--2èè=300()-(300)=0,20-0,09=0,11-2×(300)=2,0-2×0,09=1,02è(300)=0,09è3-2-L"expression de la vitesse de la réaction est:?=.Oùreprésente le coefficient directeur de la tangente à la courbe=()à la date t, on voit sur lacourbe que cette valeur diminue au cours du temps. La vitesse de la réaction diminue au cours dutemps. Le facteur cinétique responsable de cette diminution est la concentration des réactifs (quidiminue au cours du temps).3-3-Définition du temps de la demi-réaction:Le temps de demi-réactionest la durée pour laquelle l"avancement vaut.
Sur le graphe, on litpour()=,×=1,0×10Détermination de(voir courbe):≈3001-Calcul de densité:=()29=12+16×229≈1,522-Détermination des quantités de matière:()=.()=0,1×0,1=10()=()()=240+12+16×3=2.10()+2()()+()+3()00102.10010-22.10-10-22.10-Siest le réactif limitant:2.10-=0=2.10Siest le réactif limitant:10-2=0==5.10Donc le réactif limitant estet l"avancement maximal est=5.104-1-Expression de l"avancement:D"après l"équation de la réaction le seul gaz dégagé est le dioxyde de carboned"après letableau d"avancement()=L"équation d"état des gaz parfait s"écrit:().=()..
On a:()=.=..=..=0=29=29.10=..(+273)=1,020.10×29.108,31×(25+273)≈1,2.10==5.10=.=..=..=5.10×8,31×(25+273)1,020.10=1,21.10=121?=.?=1..=..(1)=..
quotesdbs_dbs11.pdfusesText_17[PDF] conductimétrie formule
[PDF] conductimétrie pdf
[PDF] conductivité de l'eau potable
[PDF] facteur de correction température conductivité
[PDF] influence de la température sur la conductivité de l'eau
[PDF] conversion conductivité salinité
[PDF] conversion ms/cm en g/l
[PDF] conductivité en fonction de la température
[PDF] la conductivité d'une solution
[PDF] mesure de conductivité d'une solution
[PDF] relation conductivité température
[PDF] facteur de correction conductivité
[PDF] conductivité eaux usées domestiques
[PDF] cours conductivité électrique pdf
