 ECE : Analyse dun échantillon par spectrophotométrie
ECE : Analyse dun échantillon par spectrophotométrie
concentration inconnue lors d'un dosage spectrophotométrique par étalonnage puis des Le film est disponible dans le dossier TP 1ère S vidéo
 On souhaite déterminer si une solution S contenant des ions cuivre
On souhaite déterminer si une solution S contenant des ions cuivre
TP : dosage spectrophotométrique. On souhaite déterminer si une solution S contenant des ions cuivre II (Cu. 2+. (aq)) peut être rejetée sans danger pour l
 Cuivre dosage par absorption atomique Méthode de type IV
Cuivre dosage par absorption atomique Méthode de type IV
PRINCIPE. Le cuivre est dosé par spectrophométrie d'absorption atomique à l'aide d'une flamme air acétylène oxydante en utilisant une lampe à cathode creuse
 Chapitre B1 : Comment effectuer un dosage par spectrophotométrie ?
Chapitre B1 : Comment effectuer un dosage par spectrophotométrie ?
TP : La bouillie bordelaise : Dosage par étalonnage. Document 1 : la Le cuivre est présent dans le produit sous la forme de sulfate de cuivre. CuSO4(s) ...
 Dosage spectrophotométrique
Dosage spectrophotométrique
L'absorbance de la solution S2 à 800 nm est mesurée elle vaut 0
 CORRECTION DU TP N°7
CORRECTION DU TP N°7
dosage par étalonnage. ➢ On part d'une solution mère de concentration c0 ... ions cuivre II (point rose). On trouve cM = 7.4*10. -2 mol/L c. Obtention du ...
 Une fausse pièce plus vraie que vraie ?
Une fausse pièce plus vraie que vraie ?
Dosage de solutions colorées par étalonnage. Loi de Beer-Lambert. Pratiquer cuivre à 10 × 10–1 mol.L–1. Chaque solution fille peut avoir
 Exercice 3 : Dosage dune solution de sulfate de cuivre Correction
Exercice 3 : Dosage dune solution de sulfate de cuivre Correction
Dosage par étalonnage utilisant l'absorbance: On réalise le dosage spectrophotométrique de la solution S1. Pour cela on prépare un ensemble de solutions
 TP Dosage Spectrophotométrique du Bleu Brillant contenu dans le
TP Dosage Spectrophotométrique du Bleu Brillant contenu dans le
La boisson Powerade est une boisson énergisante de couleur bleue mais il existe plusieurs bleu : Sulfate de cuivre
 [PDF] TP : dosage spectrophotométrique
[PDF] TP : dosage spectrophotométrique
TP : dosage spectrophotométrique On souhaite déterminer si une solution S contenant des ions cuivre II (Cu 2+ (aq)) peut être rejetée sans
 [PDF] TRAVAIL PRATIQUE N°1 DOSAGE DES IONS CUIVRE (II) PAR
[PDF] TRAVAIL PRATIQUE N°1 DOSAGE DES IONS CUIVRE (II) PAR
TP réalisé grâce à la conjonction des moyens du laboratoire de traitement des Dosage des ions cuivre par spectrophotométrie d'absorption moléculaire
 [PDF] TP22 : Dosage par étalonnage - Prophychi
[PDF] TP22 : Dosage par étalonnage - Prophychi
cette solution en ions cuivre II Le cuivre et ses composés ne doivent pas avoir une concentration massique II) Dosage par spectrophotométrie
 [PDF] Contrôles de qualité TP C1 DOSAGE DU CUIVRE DANS UN LAITON
[PDF] Contrôles de qualité TP C1 DOSAGE DU CUIVRE DANS UN LAITON
TP C1 DOSAGE DU CUIVRE DANS UN LAITON OBJECTIFS : ? Réaliser et exploiter une courbe d'étalonnage ? Exploiter un titrage
 [PDF] CORRECTION DU TP N°7 - Physagreg
[PDF] CORRECTION DU TP N°7 - Physagreg
CORRECTION DU TP N°7 Solution de sulfate de cuivre à : 1 0*10-1 réaliser une échelle de teinte pour pouvoir réaliser le dosage par étalonnage
 [PDF] TP N°1 : SPECTROPHOTOMETRIE : DOSAGE PAR ETALONNAGE
[PDF] TP N°1 : SPECTROPHOTOMETRIE : DOSAGE PAR ETALONNAGE
TP N°1 Chimie Prof 1 TP N°1 : SPECTROPHOTOMETRIE : DOSAGE PAR ETALONNAGE Introduction : 1) Pourquoi une solution est-elle colorée ?
 [PDF] TP-revisions-dosagepdf
[PDF] TP-revisions-dosagepdf
Révisions dosages 1) Dosage spectrophotométrique par étalonnage de commencer par fabriquer une solution mère S0 de sulfate de cuivre de concentration
 [PDF] Dosage spectrophotométrique
[PDF] Dosage spectrophotométrique
On donne ci-dessous les spectres d'absorption d'une solution d'ions cuivre (II) et d'une solution d'ions fer (III) ainsi qu'un tableau reliant longueur d'onde
 [PDF] Exo 3 spécialité Dosage des ions cuivre (II)
[PDF] Exo 3 spécialité Dosage des ions cuivre (II)
On veut maintenant réaliser le dosage spectrophotométrique de la solution S1 Pour cela on prépare un ensemble de solutions de sulfate de cuivre (Cu2+ (aq) +
 [PDF] TP C5 Dosage du cuivre dans un alliage
[PDF] TP C5 Dosage du cuivre dans un alliage
Quel est l'intérêt de l'utilisation du spectrophotomètre par rapport à l'œil ? 3) Mesure de l'absorbance et tracé de la courbe d'étalonnage E 15 :
 [PDF] On souhaite déterminer si une solution S contenant des ions cuivre
[PDF] On souhaite déterminer si une solution S contenant des ions cuivre
TP : dosage spectrophotométrique On souhaite déterminer si une solution S contenant des ions cuivre II (Cu 2+ (aq)) peut être rejetée sans
 [PDF] Dosage spectrophotométrique
[PDF] Dosage spectrophotométrique
On donne ci-dessous les spectres d'absorption d'une solution d'ions cuivre (II) et d'une solution d'ions fer (III) ainsi qu'un tableau reliant longueur d'onde
 [PDF] TP22 : Dosage par étalonnage - Prophychi
[PDF] TP22 : Dosage par étalonnage - Prophychi
Le cuivre et ses composés ne doivent pas avoir une concentration massique supérieure à 05 mg L-1 si les quantités de rejets sont supérieures à 5g jour-1
 [PDF] tp c1 dosage du cuivre dans un laiton - JF Noblet
[PDF] tp c1 dosage du cuivre dans un laiton - JF Noblet
Contrôles de qualité TP C1 DOSAGE DU CUIVRE DANS UN LAITON OBJECTIFS : ? Réaliser et exploiter une courbe d'étalonnage ? Exploiter un titrage
 [PDF] CORRECTION DU TP N°7 - Physagreg
[PDF] CORRECTION DU TP N°7 - Physagreg
TP N°7 Chimie Correction 1 CORRECTION DU TP N°7 Matériel : falloir réaliser une échelle de teinte pour pouvoir réaliser le dosage par étalonnage
 [PDF] Dosage des ions cuivre et détermination de la formule de la
[PDF] Dosage des ions cuivre et détermination de la formule de la
TP Géné n°2 Dosage des ions cuivre et détermination de la formule de la bronchantite Colorimétrie pH-métrie et conductimétrie La blouse et les lunettes
 [PDF] Chapitre B1 : Comment effectuer un dosage par spectrophotométrie ?
[PDF] Chapitre B1 : Comment effectuer un dosage par spectrophotométrie ?
Chapitre B1 : Comment effectuer un dosage par spectrophotométrie ? TP : La bouillie bordelaise : Dosage par étalonnage Document 1 : la spectroscopie UV-visible
 [PDF] Révisions dosages
[PDF] Révisions dosages
1) Dosage spectrophotométrique par étalonnage Il est conseillé de commencer par fabriquer une solution mère S0 de sulfate de cuivre de concentration
 [DOC] DOSAGE DUNE SOLUTION DE CHLORURE DE CUIVRE
[DOC] DOSAGE DUNE SOLUTION DE CHLORURE DE CUIVRE
TP N°12 : DOSAGE D'UNE SOLUTION DE SULFATE DE CUIVRE PARTIE 1 : dosage spectrophotométrique des ions cuivre à partir d'une gamme étalon
 Spectrophotométrie PDF Labsorbance Cuivre - Scribd
Spectrophotométrie PDF Labsorbance Cuivre - Scribd
Contrôle - Qualité - BEP MIP Spectrophotométrie But du TP: Dosage de substances colorées Principe: - Préparation des solutions de sulfate de cuivre
TP22 : Dosage par étalonnage
Le laboratoire de chimie souhaite se débarrasser d'un bidon contenant 5L d'une eau contenant des ions cuivre issus de
travaux pratiques en classe de seconde. Un prélèvement de ce bidon est réalisé afin de déterminer la concentration de
cette solution en ions cuivre II.Document 1
Le cuivre et ses composés ne doivent pas avoir une concentration massique supérieure à 0,5 mg.L-1 si les quantités
de rejets sont supérieures à 5g.jour-1.On considère qu'une eau est potable si elle contient une concentration massique en cuivre inférieure à 2,0 mg.L-1.
La masse molaire du cuivre vaut 63,5g.mol-1.
Document 2
Pour une solution ionique peu concentrée (entre 10-2 et 10-3 mol.L-1), la conductivité (notée Ů, exprimée en S.m-1 ou mS.cm-1) est proportionnelle à la concentration de chaque ion présent en solution. Cette relation empirique RX ORL GH .ROOUMXVŃO SHXP V·pŃULUH :Ů ő Ũi×Ci
RZ Ũi HVP OM ŃRQGXŃPLYLPp PROMLUH TXL GpSHQG GH O·LRQ GH OM PHPSpUMPXUH GX solvant $ O·MLGH G·XQH ŃRXUNH G·pPMORQQMJH HP GH OM PHVXUH GH OM ŃRQGXŃPLYLPp GH OM solution à analyser, il est donc possible de déterminer la concentration en ions cuivre II.Document 3
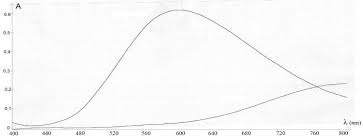
En présence d'ammoniaque NH3 les
ions cuivre II sont complexés et prennent la forme Cu(NH3)42+. Ce complexe prend une couleur bleu- nuit caractéristique.Ci-contre les courbes d'absorption des
ions cuivre II et tetramine cuivre II (complexe ammoniaqué du cuivre II).I1) Réalisation des solutions étalons
2Q GLVSRVH G·XQH VROXPLRQ 60 de sulfate de cuivre II de concentration connue [Cu2+(aq)] = C0 =2,0.10-2 mol.L-1.
On souhaite préparer 50 mL des 4 solutions de sulfate de cuivre suivantes : C1 = 1,0.10-3 mol.L-1 ; C2 = 2,0.10-3 mol.L-1 ; C3 = 4,0.10-3 mol.L-1 ; C4 = 6,0.10-3 mol.L-1Détailler le protocole puis réaliser deux de ces solutions (un autre binôme réalisera les deux autres).
I2) Préparation de la solution à analyser
Réaliser 50 mL de solution à analyser, qui est une solution faite à partir de la solution prélevée diluée au cinquième.
II) Dosage par spectrophotométrie
II1) Mesures
Le spectrophotomètre étant préréglé sur une longueur d'onde de 800nm, réaliser le blanc puis mesurer les absorbances
des 4 solutions réalisées (S1 à S4) ainsi que celle de la solution à analyser.II2) Exploitation
1. Tracer la courbe A = f(C) et déterminer son expression (on pourra utiliser Regressi).
2. 9pULILHU TXH O·pŃMUP expérience / modèle est inférieur à 5 % (sinon, expliquer pourquoi).
3. La loi de Beer-Lambert est-elle vérifiée ? Justifier.
4. Déterminer la concentration molaire des ions cuivre II dans la solution à analyser puis dans la l'échantillon.
5. L'échantillon peut-il être mis à l'évier ?
6. Dans le sujet de TP d'un autre établissement, le professeur propose d'ajouter aux différentes solutions de
l'ammoniac afin de transformer les ions Cu2+ et complexe Cu(NH3)42+. Expliquer la pertinence de ce choix.
III) Dosage par conductimétrie
III1) Mesure de la conductivité
Mesurer les conductivités des 4 solutions préparées, ainsi que celle de la solution à analyser et de l'eau distillée.
Consigner ces valeurs dans un tableur.
III2) Exploitation
1. 3RXUTXRL O·HMX GLVPLOOpe est-elle beaucoup moins conductrice que les solutions de sulfate de cuivre ?
2. 7UMŃHU OM ŃRXUNH Ů f(C) et déterminer son expression (on pourra utiliser Regressi).
3. 9pULILHU TXH O·pŃMUP expérience / modèle est inférieur à 5 % (sinon, expliquer pourquoi).
4. Déterminer la concentration molaire des ions cuivre II dans la solution à analyser puis dans la l'échantillon.
5. La loi de Kohlrausch est-elle vérifiée ? Justifier.
6. L'échantillon peut-il être mis à l'évier ?
IV) Comparaison des deux méthodes
1. Faire une synthèse du TP en indiquant les avantages et les inconvénients de chaque méthode.
2. Expliquer celle qui vous parait la mieux adaptée à la problématique étudiée.
quotesdbs_dbs45.pdfusesText_45[PDF] oxydoréduction couple
[PDF] réaction entre le sulfate de cuivre et le zinc
[PDF] oxydoréduction exercice
[PDF] exercices rédaction lettre commerciale
[PDF] lame de zinc dans sulfate de fer
[PDF] oxydoréduction equation
[PDF] systeme lineaire et matrice
[PDF] résolution des systèmes d'équations linéaires
[PDF] système de cramer matrice
[PDF] relier 12 points avec 5 droites
[PDF] relier 9 points en 3 traits sans lever le crayon
[PDF] enigme relier 9 points sans croiser
[PDF] relier 9 points en 4 traits sans croiser
[PDF] exercices gratuits écrits professionnels
