 ECE : Analyse dun échantillon par spectrophotométrie
ECE : Analyse dun échantillon par spectrophotométrie
concentration inconnue lors d'un dosage spectrophotométrique par étalonnage puis des Le film est disponible dans le dossier TP 1ère S vidéo
 On souhaite déterminer si une solution S contenant des ions cuivre
On souhaite déterminer si une solution S contenant des ions cuivre
TP : dosage spectrophotométrique. On souhaite déterminer si une solution S contenant des ions cuivre II (Cu. 2+. (aq)) peut être rejetée sans danger pour l
 TP22 : Dosage par étalonnage
TP22 : Dosage par étalonnage
Ci-contre les courbes d'absorption des ions cuivre II et tetramine cuivre II II) Dosage par spectrophotométrie. II1) Mesures. Le spectrophotomètre étant ...
 Cuivre dosage par absorption atomique Méthode de type IV
Cuivre dosage par absorption atomique Méthode de type IV
PRINCIPE. Le cuivre est dosé par spectrophométrie d'absorption atomique à l'aide d'une flamme air acétylène oxydante en utilisant une lampe à cathode creuse
 Chapitre B1 : Comment effectuer un dosage par spectrophotométrie ?
Chapitre B1 : Comment effectuer un dosage par spectrophotométrie ?
TP : La bouillie bordelaise : Dosage par étalonnage. Document 1 : la Le cuivre est présent dans le produit sous la forme de sulfate de cuivre. CuSO4(s) ...
 Dosage spectrophotométrique
Dosage spectrophotométrique
L'absorbance de la solution S2 à 800 nm est mesurée elle vaut 0
 CORRECTION DU TP N°7
CORRECTION DU TP N°7
dosage par étalonnage. ➢ On part d'une solution mère de concentration c0 ... ions cuivre II (point rose). On trouve cM = 7.4*10. -2 mol/L c. Obtention du ...
 Une fausse pièce plus vraie que vraie ?
Une fausse pièce plus vraie que vraie ?
Dosage de solutions colorées par étalonnage. Loi de Beer-Lambert. Pratiquer cuivre à 10 × 10–1 mol.L–1. Chaque solution fille peut avoir
 Exercice 3 : Dosage dune solution de sulfate de cuivre Correction
Exercice 3 : Dosage dune solution de sulfate de cuivre Correction
Dosage par étalonnage utilisant l'absorbance: On réalise le dosage spectrophotométrique de la solution S1. Pour cela on prépare un ensemble de solutions
 TP Dosage Spectrophotométrique du Bleu Brillant contenu dans le
TP Dosage Spectrophotométrique du Bleu Brillant contenu dans le
La boisson Powerade est une boisson énergisante de couleur bleue mais il existe plusieurs bleu : Sulfate de cuivre
 [PDF] TP : dosage spectrophotométrique
[PDF] TP : dosage spectrophotométrique
TP : dosage spectrophotométrique On souhaite déterminer si une solution S contenant des ions cuivre II (Cu 2+ (aq)) peut être rejetée sans
 [PDF] TRAVAIL PRATIQUE N°1 DOSAGE DES IONS CUIVRE (II) PAR
[PDF] TRAVAIL PRATIQUE N°1 DOSAGE DES IONS CUIVRE (II) PAR
TP réalisé grâce à la conjonction des moyens du laboratoire de traitement des Dosage des ions cuivre par spectrophotométrie d'absorption moléculaire
 [PDF] TP22 : Dosage par étalonnage - Prophychi
[PDF] TP22 : Dosage par étalonnage - Prophychi
cette solution en ions cuivre II Le cuivre et ses composés ne doivent pas avoir une concentration massique II) Dosage par spectrophotométrie
 [PDF] Contrôles de qualité TP C1 DOSAGE DU CUIVRE DANS UN LAITON
[PDF] Contrôles de qualité TP C1 DOSAGE DU CUIVRE DANS UN LAITON
TP C1 DOSAGE DU CUIVRE DANS UN LAITON OBJECTIFS : ? Réaliser et exploiter une courbe d'étalonnage ? Exploiter un titrage
 [PDF] CORRECTION DU TP N°7 - Physagreg
[PDF] CORRECTION DU TP N°7 - Physagreg
CORRECTION DU TP N°7 Solution de sulfate de cuivre à : 1 0*10-1 réaliser une échelle de teinte pour pouvoir réaliser le dosage par étalonnage
 [PDF] TP N°1 : SPECTROPHOTOMETRIE : DOSAGE PAR ETALONNAGE
[PDF] TP N°1 : SPECTROPHOTOMETRIE : DOSAGE PAR ETALONNAGE
TP N°1 Chimie Prof 1 TP N°1 : SPECTROPHOTOMETRIE : DOSAGE PAR ETALONNAGE Introduction : 1) Pourquoi une solution est-elle colorée ?
 [PDF] TP-revisions-dosagepdf
[PDF] TP-revisions-dosagepdf
Révisions dosages 1) Dosage spectrophotométrique par étalonnage de commencer par fabriquer une solution mère S0 de sulfate de cuivre de concentration
 [PDF] Dosage spectrophotométrique
[PDF] Dosage spectrophotométrique
On donne ci-dessous les spectres d'absorption d'une solution d'ions cuivre (II) et d'une solution d'ions fer (III) ainsi qu'un tableau reliant longueur d'onde
 [PDF] Exo 3 spécialité Dosage des ions cuivre (II)
[PDF] Exo 3 spécialité Dosage des ions cuivre (II)
On veut maintenant réaliser le dosage spectrophotométrique de la solution S1 Pour cela on prépare un ensemble de solutions de sulfate de cuivre (Cu2+ (aq) +
 [PDF] TP C5 Dosage du cuivre dans un alliage
[PDF] TP C5 Dosage du cuivre dans un alliage
Quel est l'intérêt de l'utilisation du spectrophotomètre par rapport à l'œil ? 3) Mesure de l'absorbance et tracé de la courbe d'étalonnage E 15 :
 [PDF] On souhaite déterminer si une solution S contenant des ions cuivre
[PDF] On souhaite déterminer si une solution S contenant des ions cuivre
TP : dosage spectrophotométrique On souhaite déterminer si une solution S contenant des ions cuivre II (Cu 2+ (aq)) peut être rejetée sans
 [PDF] Dosage spectrophotométrique
[PDF] Dosage spectrophotométrique
On donne ci-dessous les spectres d'absorption d'une solution d'ions cuivre (II) et d'une solution d'ions fer (III) ainsi qu'un tableau reliant longueur d'onde
 [PDF] TP22 : Dosage par étalonnage - Prophychi
[PDF] TP22 : Dosage par étalonnage - Prophychi
Le cuivre et ses composés ne doivent pas avoir une concentration massique supérieure à 05 mg L-1 si les quantités de rejets sont supérieures à 5g jour-1
 [PDF] tp c1 dosage du cuivre dans un laiton - JF Noblet
[PDF] tp c1 dosage du cuivre dans un laiton - JF Noblet
Contrôles de qualité TP C1 DOSAGE DU CUIVRE DANS UN LAITON OBJECTIFS : ? Réaliser et exploiter une courbe d'étalonnage ? Exploiter un titrage
 [PDF] CORRECTION DU TP N°7 - Physagreg
[PDF] CORRECTION DU TP N°7 - Physagreg
TP N°7 Chimie Correction 1 CORRECTION DU TP N°7 Matériel : falloir réaliser une échelle de teinte pour pouvoir réaliser le dosage par étalonnage
 [PDF] Dosage des ions cuivre et détermination de la formule de la
[PDF] Dosage des ions cuivre et détermination de la formule de la
TP Géné n°2 Dosage des ions cuivre et détermination de la formule de la bronchantite Colorimétrie pH-métrie et conductimétrie La blouse et les lunettes
 [PDF] Chapitre B1 : Comment effectuer un dosage par spectrophotométrie ?
[PDF] Chapitre B1 : Comment effectuer un dosage par spectrophotométrie ?
Chapitre B1 : Comment effectuer un dosage par spectrophotométrie ? TP : La bouillie bordelaise : Dosage par étalonnage Document 1 : la spectroscopie UV-visible
 [PDF] Révisions dosages
[PDF] Révisions dosages
1) Dosage spectrophotométrique par étalonnage Il est conseillé de commencer par fabriquer une solution mère S0 de sulfate de cuivre de concentration
 [DOC] DOSAGE DUNE SOLUTION DE CHLORURE DE CUIVRE
[DOC] DOSAGE DUNE SOLUTION DE CHLORURE DE CUIVRE
TP N°12 : DOSAGE D'UNE SOLUTION DE SULFATE DE CUIVRE PARTIE 1 : dosage spectrophotométrique des ions cuivre à partir d'une gamme étalon
 Spectrophotométrie PDF Labsorbance Cuivre - Scribd
Spectrophotométrie PDF Labsorbance Cuivre - Scribd
Contrôle - Qualité - BEP MIP Spectrophotométrie But du TP: Dosage de substances colorées Principe: - Préparation des solutions de sulfate de cuivre
T.P.C5 : Dosage du cuivre dans un alliage
Objectifs : Réaliser et exploiter une courbe d"étalonnage pour faire un dosage.Toutes les pièces de centimes CFA contiennent du cuivre dans des proportions différentes : on indique leur
composition par le "titre" (masse en g de cuivre pour 100 g d"échantillon). Nous disposons d"une pièce de 5 centimes CFA dont on désire déterminer le titre. Pour ce faire, on fait d"abord " passer » le métal cuivre à l"état d"ions cuivre II Cu2+ (aq), par réaction
d"oxydoréduction avec une solution d"acide nitrique, puis on détermine la concentration molaire de la
solution par dosage par étalonnage.I.- Préparation de la solution à doser
E.1. : Sur une balance au centigramme, on pèse la pièce de monnaie. On note la masse m exacte : m = . . . .
. . . . . gE.2. : Cet échantillon est ensuite placé sous la hotte dans un erlenmeyer contenant 10 mL de solution
d"acide nitrique concentrée (acide nitrique à 60 %).Attention à la manipulation de l"acide : le port de la blouse, de lunettes de protection et de gants est
obligatoireQ.3. : Observer la coloration que prend la solution ainsi que la couleur du gaz qui se dégage (dioxyde
d"azote). Noter les observations. La réaction se poursuit sous la hotte jusqu"à disparition complète du
solide (environ 30 minutes).E.4. : Lorsque la réaction est terminée, on verse la solution obtenue dans une fiole jaugée de 500 mL
partiellement remplie d"eau distillée, et complétée jusqu"au trait de jauge. On obtient une solution S.
Q.5. : La réaction qui a lieu est une réaction d"oxydoréduction entre le cuivre métal et les ions nitrate NO
3- (aq)en milieu acide. Etablir l"équation de la réaction, sachant que les couples mis en jeu sont : Cu2+ (aq)
/ Cu (s) et NO3- (aq) / NO (g).
Q.6. : En déduire la relation entre la masse de cuivre métal présent dans le fil de laiton et la concentration
molaire volumique en ions cuivre II Cu2+ (aq) de la solution S.
Q.7. : Le gaz roux observé est en fait du dioxyde d"azote NO2 (g). Comment expliquer la couleur du
dégagement gazeux observé. Ecrire l"équation de la réaction qui a lieu.II.- Dosage par étalonnage
C.8. : Les solutions aqueuses contenant des ions cuivre Cu2+ (aq) sont colorées. On peut donc déterminer
par mesure d"absorbance la concentration en ion cuivre. Pour cela, on construit dans un premier temps une
courbe d"étalonnage, en mesurant à une longueur d"onde bien choisie l"absorbance de solutions étalon,
de concentrations connues avec précision composant une échelle de teinte. La mesure de l"absorbance de la solution S permet alors de déduire sa concentration en ions cuivre.1) Choix de la longueur d"onde d"étude
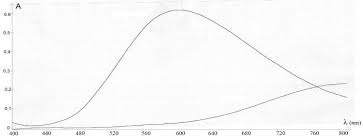
Ci-contre le spectre d"absorption d"une solution aqueuse de sulfate de cuivre de concentration molaire en CuSO 4 (s) C0 = 1,0.10-2 mol.L-1.
Q.9. : Le spectre de bandes d"absorption ci-contre est-il en accord avec la coloration de la solution ? Expliquer. Q.10. : D"après le spectre d"absorption, à quelle longueur d"onde doit-on travailler ? Justifier votre réponse.Comment appelle-t-on cette longueur d"onde ?
-2-2) Réalisation des solutions étalon
E.11. : A partir de la solution-mère de concentration molaire en sulfate de cuivre CuSO4 (s) apportée
C0 = 1,0.10-1 mol.L-1, préparer 50,0 mL de chacune des solutions " filles » figurant dans le tableau ci-
dessous (chaque groupe préparera une des solutions). On dispose de fioles jaugées de 50,0 mL, et de
pipettes jaugées de 5, 10 et 20 mL, ainsi que de béchers. S i S1 S2 S3 S4 S5 S6 S7Ci (x 10-2 mol.L-1) 1 2 3 4 5 6 8
Facteur de dilution f
V0 : volume de solution mère
à prélever (en mL)
Absorbance
Q.12. : Donner le volume de la solution-mère à prélever pour la solution fille que vous avez à préparer en
la justifiant. Q.13. : Donner le mode opératoire pour la préparation de cette solution avec des schémas.Q.14. : Regrouper les solutions dans des tubes à essais devant. Evaluer la concentration de la solution S par
un encadrement. Quel est l"intérêt de l"utilisation du spectrophotomètre par rapport à l"oeil ?
3) Mesure de l"absorbance et tracé de la courbe d"étalonnage
E.15. : Sélectionner la longueur d"onde d"étude choisie et faire le "blanc" (absorbance nulle).
E.16. : Chaque groupe mesure l"absorbance de la solution qu"il a préparée (il est inutile de refaire le
" blanc » pour les différentes mesures car la longueur d"onde ne change pas). Consigner les valeurs
d"absorbance mesurées dans le tableau ci-dessus. Les résultats sont repris par l"ensemble des groupes.
E.17. : Tracer sur papier millimétré ou sur REGRESSI la courbe d"étalonnage A = f (C i). Q.18. : La loi de Beer-Lambert est-elle vérifiée ? Justifier. Q.19. : Quel est l"intérêt de faire un blanc ?4) Dosage de la solution préparée à partir de l"échantillon de laiton
E.20. : Sans refaire le " blanc », on mesure l"absorbance de la solution S, à la même longueur d"onde que
précédemment :A = . . . . . . . .
Q.21. : A l"aide de la courbe d"étalonnage, déterminer la concentration molaire en ions cuivre II Cu
2+ (aq)
de la solution S.Q.22. : En déduire la masse de cuivre dans l"échantillon de laiton pesé. (masse molaire atomique du
cuivre : 63,5 g.mol -1 ). Q.23. : A l"aide de la masse m de cet échantillon, calculer le titre du laiton, exprimé en %.quotesdbs_dbs45.pdfusesText_45[PDF] oxydoréduction couple
[PDF] réaction entre le sulfate de cuivre et le zinc
[PDF] oxydoréduction exercice
[PDF] exercices rédaction lettre commerciale
[PDF] lame de zinc dans sulfate de fer
[PDF] oxydoréduction equation
[PDF] systeme lineaire et matrice
[PDF] résolution des systèmes d'équations linéaires
[PDF] système de cramer matrice
[PDF] relier 12 points avec 5 droites
[PDF] relier 9 points en 3 traits sans lever le crayon
[PDF] enigme relier 9 points sans croiser
[PDF] relier 9 points en 4 traits sans croiser
[PDF] exercices gratuits écrits professionnels
