 ECE : Analyse dun échantillon par spectrophotométrie
ECE : Analyse dun échantillon par spectrophotométrie
concentration inconnue lors d'un dosage spectrophotométrique par étalonnage puis des Le film est disponible dans le dossier TP 1ère S vidéo
 On souhaite déterminer si une solution S contenant des ions cuivre
On souhaite déterminer si une solution S contenant des ions cuivre
TP : dosage spectrophotométrique. On souhaite déterminer si une solution S contenant des ions cuivre II (Cu. 2+. (aq)) peut être rejetée sans danger pour l
 TP22 : Dosage par étalonnage
TP22 : Dosage par étalonnage
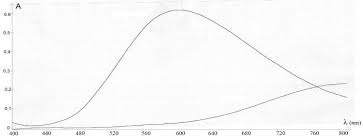
Ci-contre les courbes d'absorption des ions cuivre II et tetramine cuivre II II) Dosage par spectrophotométrie. II1) Mesures. Le spectrophotomètre étant ...
 Cuivre dosage par absorption atomique Méthode de type IV
Cuivre dosage par absorption atomique Méthode de type IV
PRINCIPE. Le cuivre est dosé par spectrophométrie d'absorption atomique à l'aide d'une flamme air acétylène oxydante en utilisant une lampe à cathode creuse
 Chapitre B1 : Comment effectuer un dosage par spectrophotométrie ?
Chapitre B1 : Comment effectuer un dosage par spectrophotométrie ?
TP : La bouillie bordelaise : Dosage par étalonnage. Document 1 : la Le cuivre est présent dans le produit sous la forme de sulfate de cuivre. CuSO4(s) ...
 Dosage spectrophotométrique
Dosage spectrophotométrique
L'absorbance de la solution S2 à 800 nm est mesurée elle vaut 0
 CORRECTION DU TP N°7
CORRECTION DU TP N°7
dosage par étalonnage. ➢ On part d'une solution mère de concentration c0 ... ions cuivre II (point rose). On trouve cM = 7.4*10. -2 mol/L c. Obtention du ...
 Une fausse pièce plus vraie que vraie ?
Une fausse pièce plus vraie que vraie ?
Dosage de solutions colorées par étalonnage. Loi de Beer-Lambert. Pratiquer cuivre à 10 × 10–1 mol.L–1. Chaque solution fille peut avoir
 Exercice 3 : Dosage dune solution de sulfate de cuivre Correction
Exercice 3 : Dosage dune solution de sulfate de cuivre Correction
Dosage par étalonnage utilisant l'absorbance: On réalise le dosage spectrophotométrique de la solution S1. Pour cela on prépare un ensemble de solutions
 TP Dosage Spectrophotométrique du Bleu Brillant contenu dans le
TP Dosage Spectrophotométrique du Bleu Brillant contenu dans le
La boisson Powerade est une boisson énergisante de couleur bleue mais il existe plusieurs bleu : Sulfate de cuivre
 [PDF] TP : dosage spectrophotométrique
[PDF] TP : dosage spectrophotométrique
TP : dosage spectrophotométrique On souhaite déterminer si une solution S contenant des ions cuivre II (Cu 2+ (aq)) peut être rejetée sans
 [PDF] TRAVAIL PRATIQUE N°1 DOSAGE DES IONS CUIVRE (II) PAR
[PDF] TRAVAIL PRATIQUE N°1 DOSAGE DES IONS CUIVRE (II) PAR
TP réalisé grâce à la conjonction des moyens du laboratoire de traitement des Dosage des ions cuivre par spectrophotométrie d'absorption moléculaire
 [PDF] TP22 : Dosage par étalonnage - Prophychi
[PDF] TP22 : Dosage par étalonnage - Prophychi
cette solution en ions cuivre II Le cuivre et ses composés ne doivent pas avoir une concentration massique II) Dosage par spectrophotométrie
 [PDF] Contrôles de qualité TP C1 DOSAGE DU CUIVRE DANS UN LAITON
[PDF] Contrôles de qualité TP C1 DOSAGE DU CUIVRE DANS UN LAITON
TP C1 DOSAGE DU CUIVRE DANS UN LAITON OBJECTIFS : ? Réaliser et exploiter une courbe d'étalonnage ? Exploiter un titrage
 [PDF] CORRECTION DU TP N°7 - Physagreg
[PDF] CORRECTION DU TP N°7 - Physagreg
CORRECTION DU TP N°7 Solution de sulfate de cuivre à : 1 0*10-1 réaliser une échelle de teinte pour pouvoir réaliser le dosage par étalonnage
 [PDF] TP N°1 : SPECTROPHOTOMETRIE : DOSAGE PAR ETALONNAGE
[PDF] TP N°1 : SPECTROPHOTOMETRIE : DOSAGE PAR ETALONNAGE
TP N°1 Chimie Prof 1 TP N°1 : SPECTROPHOTOMETRIE : DOSAGE PAR ETALONNAGE Introduction : 1) Pourquoi une solution est-elle colorée ?
 [PDF] TP-revisions-dosagepdf
[PDF] TP-revisions-dosagepdf
Révisions dosages 1) Dosage spectrophotométrique par étalonnage de commencer par fabriquer une solution mère S0 de sulfate de cuivre de concentration
 [PDF] Dosage spectrophotométrique
[PDF] Dosage spectrophotométrique
On donne ci-dessous les spectres d'absorption d'une solution d'ions cuivre (II) et d'une solution d'ions fer (III) ainsi qu'un tableau reliant longueur d'onde
 [PDF] Exo 3 spécialité Dosage des ions cuivre (II)
[PDF] Exo 3 spécialité Dosage des ions cuivre (II)
On veut maintenant réaliser le dosage spectrophotométrique de la solution S1 Pour cela on prépare un ensemble de solutions de sulfate de cuivre (Cu2+ (aq) +
 [PDF] TP C5 Dosage du cuivre dans un alliage
[PDF] TP C5 Dosage du cuivre dans un alliage
Quel est l'intérêt de l'utilisation du spectrophotomètre par rapport à l'œil ? 3) Mesure de l'absorbance et tracé de la courbe d'étalonnage E 15 :
 [PDF] On souhaite déterminer si une solution S contenant des ions cuivre
[PDF] On souhaite déterminer si une solution S contenant des ions cuivre
TP : dosage spectrophotométrique On souhaite déterminer si une solution S contenant des ions cuivre II (Cu 2+ (aq)) peut être rejetée sans
 [PDF] Dosage spectrophotométrique
[PDF] Dosage spectrophotométrique
On donne ci-dessous les spectres d'absorption d'une solution d'ions cuivre (II) et d'une solution d'ions fer (III) ainsi qu'un tableau reliant longueur d'onde
 [PDF] TP22 : Dosage par étalonnage - Prophychi
[PDF] TP22 : Dosage par étalonnage - Prophychi
Le cuivre et ses composés ne doivent pas avoir une concentration massique supérieure à 05 mg L-1 si les quantités de rejets sont supérieures à 5g jour-1
 [PDF] tp c1 dosage du cuivre dans un laiton - JF Noblet
[PDF] tp c1 dosage du cuivre dans un laiton - JF Noblet
Contrôles de qualité TP C1 DOSAGE DU CUIVRE DANS UN LAITON OBJECTIFS : ? Réaliser et exploiter une courbe d'étalonnage ? Exploiter un titrage
 [PDF] CORRECTION DU TP N°7 - Physagreg
[PDF] CORRECTION DU TP N°7 - Physagreg
TP N°7 Chimie Correction 1 CORRECTION DU TP N°7 Matériel : falloir réaliser une échelle de teinte pour pouvoir réaliser le dosage par étalonnage
 [PDF] Dosage des ions cuivre et détermination de la formule de la
[PDF] Dosage des ions cuivre et détermination de la formule de la
TP Géné n°2 Dosage des ions cuivre et détermination de la formule de la bronchantite Colorimétrie pH-métrie et conductimétrie La blouse et les lunettes
 [PDF] Chapitre B1 : Comment effectuer un dosage par spectrophotométrie ?
[PDF] Chapitre B1 : Comment effectuer un dosage par spectrophotométrie ?
Chapitre B1 : Comment effectuer un dosage par spectrophotométrie ? TP : La bouillie bordelaise : Dosage par étalonnage Document 1 : la spectroscopie UV-visible
 [PDF] Révisions dosages
[PDF] Révisions dosages
1) Dosage spectrophotométrique par étalonnage Il est conseillé de commencer par fabriquer une solution mère S0 de sulfate de cuivre de concentration
 [DOC] DOSAGE DUNE SOLUTION DE CHLORURE DE CUIVRE
[DOC] DOSAGE DUNE SOLUTION DE CHLORURE DE CUIVRE
TP N°12 : DOSAGE D'UNE SOLUTION DE SULFATE DE CUIVRE PARTIE 1 : dosage spectrophotométrique des ions cuivre à partir d'une gamme étalon
 Spectrophotométrie PDF Labsorbance Cuivre - Scribd
Spectrophotométrie PDF Labsorbance Cuivre - Scribd
Contrôle - Qualité - BEP MIP Spectrophotométrie But du TP: Dosage de substances colorées Principe: - Préparation des solutions de sulfate de cuivre
Classe de TS SPE TP N°7
Chimie Correction
1CORRECTION DU TP N°7
Matériel :
6 béchers Une fiole jaugée de 50 mL Une pipette jaugée de 5 mL Une pissette d"eau distillée 6 cuves à colorimètre Un colorimètre mesurant la transmittance Produits : Un petit morceau de laiton par binômeAu bureau :
Acide nitrique concentré Solution de sulfate de cuivre à : 1.0*10-1 ; 5*10-2 ; 5*10 -3 ; 1.0*10-3 mol/LRappel théorique :
Transmittance :
0IIT= I : intensité transmise à la sortie de la cuve I0 : intensité reçue à l"entrée de la cuveAbsorbance :
A = -log T =
ε×l×c (loi de Beer-Lambert)
I Manipulations :
Masse du morceau de laiton : m = 0.30g Mettez-le dans un bécher, et ajoutez de l"acide nitrique concentré afin de le dissoudre. On transfère la solution du bécher dans une fiole jaugée de V = 50 mL.Il va maintenant falloir réaliser une échelle de teinte pour pouvoir réaliser le dosage par étalonnage.
On part d"une solution mère de concentration c0 = 1.0*10-1 mol.L-1.Les élèves prépare une solution à 1.0*10-2 avec la fiole jaugée de 50 mL et une pipette jaugée de 5
mL. On mesure la transmittance des solutions de l"échelle de teinte :Concentration
(mol/L) 1.0*10 -1 5.0*10-2 1.0*10-2 5.0*10-3 1.0*10-3Transmittance 0.472 0.626 0.87 0.894 0.959
Absorbance 0.33 0.2 0.06 0.05 0.02
On mesure l"absorbance obtenue avec la solution issue du morceau de laiton : AM = 0.26 (T = 0.551)II Pourcentage en cuivre du morceau de laiton :
1) Questions :
a. Cu(s) = Cu2+(aq) + 2e-
Zn(s) = Zn
2+(aq) + 2e-
NO3-(aq) + 4 H+ + 3 e- = NO(g) + 2 H2O(l)
b. Les ions responsables de la coloration prise par la solution sont les ions cuivre II.c. Le monoxyde d"azote est incolore alors que le dioxyde d"azote est un gaz roux (irritant !). En effet, le
monoxyde d"azote se transforme au dioxyde d"azote au contact du dioxygène de l"air.Classe de TS SPE TP N°7
Chimie Correction
22) Calcul du pourcentage :
a. Loi de Beer-Lambert : A =ε×l×c = k×c
b. L"échelle de teinte nous permet de tracer une courbe (ou droite d"après la loi de Beer-Lambert)
d"étalonnage : A = f(c) :A = f(c)
y = 3,4746x 00,050,10,150,20,250,30,350,4
0,0E+00 2,0E-02 4,0E-02 6,0E-02 8,0E-02 1,0E-01 1,2E-01
c (mol/L) AOn reporte alors la valeur de l"absorbance A
M de la solution issue du laiton, et on lit sa concentration en ions cuivre II (point rose). On trouve cM = 7.4*10-2 mol/L
c. Obtention du pourcentage : On calcule la quantité de matière correspondante d"ions cuivre : n M = cM×VM = 7.4*10-2 × 50*10-3 = 3.7*10-3 mol On calcule ensuite la masse correspondante : mM = nM×MCu = 3.7*10-3 × 63.5 = 0.23 g
On finit par calculer le pourcentage proprement dit : %M =10030.0
23.0´= 76%
Il y a 76% de cuivre dans ce morceau de laiton
quotesdbs_dbs45.pdfusesText_45[PDF] oxydoréduction couple
[PDF] réaction entre le sulfate de cuivre et le zinc
[PDF] oxydoréduction exercice
[PDF] exercices rédaction lettre commerciale
[PDF] lame de zinc dans sulfate de fer
[PDF] oxydoréduction equation
[PDF] systeme lineaire et matrice
[PDF] résolution des systèmes d'équations linéaires
[PDF] système de cramer matrice
[PDF] relier 12 points avec 5 droites
[PDF] relier 9 points en 3 traits sans lever le crayon
[PDF] enigme relier 9 points sans croiser
[PDF] relier 9 points en 4 traits sans croiser
[PDF] exercices gratuits écrits professionnels
