 ECE : Analyse dun échantillon par spectrophotométrie
ECE : Analyse dun échantillon par spectrophotométrie
concentration inconnue lors d'un dosage spectrophotométrique par étalonnage puis des Le film est disponible dans le dossier TP 1ère S vidéo
 On souhaite déterminer si une solution S contenant des ions cuivre
On souhaite déterminer si une solution S contenant des ions cuivre
TP : dosage spectrophotométrique. On souhaite déterminer si une solution S contenant des ions cuivre II (Cu. 2+. (aq)) peut être rejetée sans danger pour l
 TP22 : Dosage par étalonnage
TP22 : Dosage par étalonnage
Ci-contre les courbes d'absorption des ions cuivre II et tetramine cuivre II II) Dosage par spectrophotométrie. II1) Mesures. Le spectrophotomètre étant ...
 Cuivre dosage par absorption atomique Méthode de type IV
Cuivre dosage par absorption atomique Méthode de type IV
PRINCIPE. Le cuivre est dosé par spectrophométrie d'absorption atomique à l'aide d'une flamme air acétylène oxydante en utilisant une lampe à cathode creuse
 Chapitre B1 : Comment effectuer un dosage par spectrophotométrie ?
Chapitre B1 : Comment effectuer un dosage par spectrophotométrie ?
TP : La bouillie bordelaise : Dosage par étalonnage. Document 1 : la Le cuivre est présent dans le produit sous la forme de sulfate de cuivre. CuSO4(s) ...
 Dosage spectrophotométrique
Dosage spectrophotométrique
L'absorbance de la solution S2 à 800 nm est mesurée elle vaut 0
 CORRECTION DU TP N°7
CORRECTION DU TP N°7
dosage par étalonnage. ➢ On part d'une solution mère de concentration c0 ... ions cuivre II (point rose). On trouve cM = 7.4*10. -2 mol/L c. Obtention du ...
 Une fausse pièce plus vraie que vraie ?
Une fausse pièce plus vraie que vraie ?
Dosage de solutions colorées par étalonnage. Loi de Beer-Lambert. Pratiquer cuivre à 10 × 10–1 mol.L–1. Chaque solution fille peut avoir
 Exercice 3 : Dosage dune solution de sulfate de cuivre Correction
Exercice 3 : Dosage dune solution de sulfate de cuivre Correction
Dosage par étalonnage utilisant l'absorbance: On réalise le dosage spectrophotométrique de la solution S1. Pour cela on prépare un ensemble de solutions
 TP Dosage Spectrophotométrique du Bleu Brillant contenu dans le
TP Dosage Spectrophotométrique du Bleu Brillant contenu dans le
La boisson Powerade est une boisson énergisante de couleur bleue mais il existe plusieurs bleu : Sulfate de cuivre
 [PDF] TP : dosage spectrophotométrique
[PDF] TP : dosage spectrophotométrique
TP : dosage spectrophotométrique On souhaite déterminer si une solution S contenant des ions cuivre II (Cu 2+ (aq)) peut être rejetée sans
 [PDF] TRAVAIL PRATIQUE N°1 DOSAGE DES IONS CUIVRE (II) PAR
[PDF] TRAVAIL PRATIQUE N°1 DOSAGE DES IONS CUIVRE (II) PAR
TP réalisé grâce à la conjonction des moyens du laboratoire de traitement des Dosage des ions cuivre par spectrophotométrie d'absorption moléculaire
 [PDF] TP22 : Dosage par étalonnage - Prophychi
[PDF] TP22 : Dosage par étalonnage - Prophychi
cette solution en ions cuivre II Le cuivre et ses composés ne doivent pas avoir une concentration massique II) Dosage par spectrophotométrie
 [PDF] Contrôles de qualité TP C1 DOSAGE DU CUIVRE DANS UN LAITON
[PDF] Contrôles de qualité TP C1 DOSAGE DU CUIVRE DANS UN LAITON
TP C1 DOSAGE DU CUIVRE DANS UN LAITON OBJECTIFS : ? Réaliser et exploiter une courbe d'étalonnage ? Exploiter un titrage
 [PDF] CORRECTION DU TP N°7 - Physagreg
[PDF] CORRECTION DU TP N°7 - Physagreg
CORRECTION DU TP N°7 Solution de sulfate de cuivre à : 1 0*10-1 réaliser une échelle de teinte pour pouvoir réaliser le dosage par étalonnage
 [PDF] TP N°1 : SPECTROPHOTOMETRIE : DOSAGE PAR ETALONNAGE
[PDF] TP N°1 : SPECTROPHOTOMETRIE : DOSAGE PAR ETALONNAGE
TP N°1 Chimie Prof 1 TP N°1 : SPECTROPHOTOMETRIE : DOSAGE PAR ETALONNAGE Introduction : 1) Pourquoi une solution est-elle colorée ?
 [PDF] TP-revisions-dosagepdf
[PDF] TP-revisions-dosagepdf
Révisions dosages 1) Dosage spectrophotométrique par étalonnage de commencer par fabriquer une solution mère S0 de sulfate de cuivre de concentration
 [PDF] Dosage spectrophotométrique
[PDF] Dosage spectrophotométrique
On donne ci-dessous les spectres d'absorption d'une solution d'ions cuivre (II) et d'une solution d'ions fer (III) ainsi qu'un tableau reliant longueur d'onde
 [PDF] Exo 3 spécialité Dosage des ions cuivre (II)
[PDF] Exo 3 spécialité Dosage des ions cuivre (II)
On veut maintenant réaliser le dosage spectrophotométrique de la solution S1 Pour cela on prépare un ensemble de solutions de sulfate de cuivre (Cu2+ (aq) +
 [PDF] TP C5 Dosage du cuivre dans un alliage
[PDF] TP C5 Dosage du cuivre dans un alliage
Quel est l'intérêt de l'utilisation du spectrophotomètre par rapport à l'œil ? 3) Mesure de l'absorbance et tracé de la courbe d'étalonnage E 15 :
 [PDF] On souhaite déterminer si une solution S contenant des ions cuivre
[PDF] On souhaite déterminer si une solution S contenant des ions cuivre
TP : dosage spectrophotométrique On souhaite déterminer si une solution S contenant des ions cuivre II (Cu 2+ (aq)) peut être rejetée sans
 [PDF] Dosage spectrophotométrique
[PDF] Dosage spectrophotométrique
On donne ci-dessous les spectres d'absorption d'une solution d'ions cuivre (II) et d'une solution d'ions fer (III) ainsi qu'un tableau reliant longueur d'onde
 [PDF] TP22 : Dosage par étalonnage - Prophychi
[PDF] TP22 : Dosage par étalonnage - Prophychi
Le cuivre et ses composés ne doivent pas avoir une concentration massique supérieure à 05 mg L-1 si les quantités de rejets sont supérieures à 5g jour-1
 [PDF] tp c1 dosage du cuivre dans un laiton - JF Noblet
[PDF] tp c1 dosage du cuivre dans un laiton - JF Noblet
Contrôles de qualité TP C1 DOSAGE DU CUIVRE DANS UN LAITON OBJECTIFS : ? Réaliser et exploiter une courbe d'étalonnage ? Exploiter un titrage
 [PDF] CORRECTION DU TP N°7 - Physagreg
[PDF] CORRECTION DU TP N°7 - Physagreg
TP N°7 Chimie Correction 1 CORRECTION DU TP N°7 Matériel : falloir réaliser une échelle de teinte pour pouvoir réaliser le dosage par étalonnage
 [PDF] Dosage des ions cuivre et détermination de la formule de la
[PDF] Dosage des ions cuivre et détermination de la formule de la
TP Géné n°2 Dosage des ions cuivre et détermination de la formule de la bronchantite Colorimétrie pH-métrie et conductimétrie La blouse et les lunettes
 [PDF] Chapitre B1 : Comment effectuer un dosage par spectrophotométrie ?
[PDF] Chapitre B1 : Comment effectuer un dosage par spectrophotométrie ?
Chapitre B1 : Comment effectuer un dosage par spectrophotométrie ? TP : La bouillie bordelaise : Dosage par étalonnage Document 1 : la spectroscopie UV-visible
 [PDF] Révisions dosages
[PDF] Révisions dosages
1) Dosage spectrophotométrique par étalonnage Il est conseillé de commencer par fabriquer une solution mère S0 de sulfate de cuivre de concentration
 [DOC] DOSAGE DUNE SOLUTION DE CHLORURE DE CUIVRE
[DOC] DOSAGE DUNE SOLUTION DE CHLORURE DE CUIVRE
TP N°12 : DOSAGE D'UNE SOLUTION DE SULFATE DE CUIVRE PARTIE 1 : dosage spectrophotométrique des ions cuivre à partir d'une gamme étalon
 Spectrophotométrie PDF Labsorbance Cuivre - Scribd
Spectrophotométrie PDF Labsorbance Cuivre - Scribd
Contrôle - Qualité - BEP MIP Spectrophotométrie But du TP: Dosage de substances colorées Principe: - Préparation des solutions de sulfate de cuivre
Chimie STL SPCL /Etude de cas
Dosage spectrophotométrique
Teneur en cuivre dans une pièce de 5 centimes d'euroLa pièce de 5 centimes d'euro est composée d'un centre en acier (constitué essentiellement de fer et de carbone) entouré de
cuivre. Elle a un diamètre de 21,25 mm, une épaisseur de 1,67 mm et une masse de 3,93 g.On cherche par une méthode spectrophotométrique à déterminer la teneur en cuivre d'une telle pièce.
Le cuivre, de masse molaire 63,5 g.mol-1
, est un métal qui peut être totalement oxydé en ions cuivre (II) par un oxydant puissant tel que l'acide nitrique selon la réaction d'équation3 Cu(s) + 8 H
(aq) + 2 NO 3- (aq) 3 Cu 2+ (aq) + 4 H 2O(l) + 2 NO(g)
Les ions cuivre (II) formés se retrouvent intégralement dissous en solution ; le monoxyde d'azote NO est un gaz peu soluble.
DOCUMENT 1 : protocole expérimental On dépose une pièce de 5 centimes dans un erlenmeyer de 100 mL, on place cet erlenmeyer sous la hotte et on met en
fonctionnement la ventilation.Équipé de gants et de lunettes de protection, on verse dans l'erlenmeyer 20 mL d'une solution d'acide nitrique d'une
concentration environ égale à 7 mol.L -1 La pièce est alors assez vite oxydée et on obtient une solution notée S1.On transfère intégralement cette solution S1 dans une fiole jaugée de 100 mL et on complète cette dernière
avec de l'eau distillée jusqu'au trait de jauge. On obtient une solution S2 qui contient également des ionsfer (III) provenant de la réaction entre l'acide nitrique et le fer contenu dans le centre d'acier de la pièce.
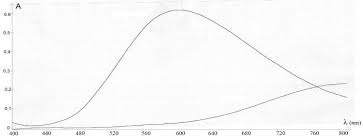
L'absorbance de la solution S2 à 800 nm est mesurée, elle vaut 0,575. DOCUMENT 2: Spectres d'absorption des ions cuivre (II) et fer (III) dans l'eau. On donne ci-dessous les spectres d'absorption d'une solution d'ions cuivre (II) et d'une solution d'ions fer (III), ainsi qu'un tableau reliant longueur d'onde d'absorption et couleur complémentaire. Le " blanc » a été fait avec de l'eau pure. couleur absorbée violet bleu vert jaune orange Rouge longueur d'onde d'absorption (nm) 400-424 424-491 491-575 575-585 585-647 647-850 couleur complémentaire jaune-vert jaune pourpre bleu vert-bleu bleu-vert
Solution aqueuse d'ions
cuivre (II) Cu 2+ de concentration 7,5× 10-3 mol.L -1Solution aqueuse d'ions fer (III) Fe
3+ de concentration 5,0×10 -2 mol.L -1DOCUMENT 3 : Courbe d'étalonnage.
Tableau donnan
t l'absorbance A à 800 nm de solutions aqueuses contenant des ions cuivre (II), obtenues à partir de diverséchantillons de métal cuivre pur :
Masse de l'échantillon de
cuivre (mg)0 25,1 50,6 103,8 206,2 300,6
Concentration (mol.L
-1 ) 0 3,95×10 -37,97×10
-31,63×10
-23,25×10
-24,74×10
-2Absorbance 0 0,055 0,121 0,231 0,452 0,649
Document 3 : Incertitude sur un mesurage.
On rappelle les différentes formules intervenant dans la détermination de l'incertitude sur le résultat du mesurage d'un
ensemble de n valeurs {x 1 , x 2 ... x nÉcart-type :
2 1 1 1 n ii n xx nIncertitude-type sur la moyenne :
1 n uxnIncertitude quotesdbs_dbs10.pdfusesText_16
[PDF] oxydoréduction couple
[PDF] réaction entre le sulfate de cuivre et le zinc
[PDF] oxydoréduction exercice
[PDF] exercices rédaction lettre commerciale
[PDF] lame de zinc dans sulfate de fer
[PDF] oxydoréduction equation
[PDF] systeme lineaire et matrice
[PDF] résolution des systèmes d'équations linéaires
[PDF] système de cramer matrice
[PDF] relier 12 points avec 5 droites
[PDF] relier 9 points en 3 traits sans lever le crayon
[PDF] enigme relier 9 points sans croiser
[PDF] relier 9 points en 4 traits sans croiser
[PDF] exercices gratuits écrits professionnels
