 Faculté des Sciences Meknès Cours ATOMISTIQUE SVTU/S1 Pr.H
Faculté des Sciences Meknès Cours ATOMISTIQUE SVTU/S1 Pr.H
D'une façon générale on représente un atome (élément chimique) X par la notation suivante : Avec : Z est le numéro atomique et correspond au nombre de protons
 Cours datomistique S1/SMP-SMC
Cours datomistique S1/SMP-SMC
L'atome étant très petit on préfère utiliser la masse molaire atomique qui correspond bien sur à la masse d'une mole d'atomes. Page 11. La mole est définie
 Cours Atomistique(1).pdf
Cours Atomistique(1).pdf
La masse d'une mole d'atomes d'un élément est appelée la masse molaire de l'atome. 1.3.6 Masse atomique relative. Dans le cas général un élément possède un ou
 FICHE 1 - Atomistique
FICHE 1 - Atomistique
nucléons) dans 1g d'hydrog`ene. 5. Unité de masse atomique = 1/12 de la masse d'un atome de. 12. 6.
 Cours dAtomistique
Cours dAtomistique
Atomistique / SMPC-S1. Prs. A. Hakam S. Ferfra & S. Sebbahi. Page 52. Ainsi En résumé
 Filière SVT-S1 Module 6 « Chimie Générale »
Filière SVT-S1 Module 6 « Chimie Générale »
COURS D'ATOMISTIQUE. Dispensé aux étudiants de SVT. Elaboré par : - Sanaâ Résumé : Couche. Valeur de n. Valeur de l Sous-couche Valeur de m. Nbre d'O. A ψ nl ...
 Cours dAtomistique
Cours dAtomistique
probabilité de désintégration d'un noyau par unité de temps. Elle s'exprime en s–1 . La constante λ ne dépend que du nucléide. Elle est indépendante du temps
 COURS DE CHIMIE GENERALE Semestre 1 SVI
COURS DE CHIMIE GENERALE Semestre 1 SVI
Partie I : COURS D'ATOMISTIQUE. CHAPITRE I : STRUCTURE DE L'ATOME. I La quantité totale de chaleur Q1 gagnée par S1 au cours de la transformation s'écrit donc ...
 Atomistique et Chimie Organique Cours et Exercices Corrigés
Atomistique et Chimie Organique Cours et Exercices Corrigés
Pour décrire totalement l'électron d'un atome il faut lui attribuer un quatrième nombre quantique (noté s ou ms) lié à la rotation autour de lui-même. Ce
 Chimie Générale (Chimie 1)
Chimie Générale (Chimie 1)
23 déc. 2020 Cette loi constitue avec la loi des proportions multiples
 Faculté des Sciences Meknès Cours ATOMISTIQUE SVTU/S1 Pr.H
Faculté des Sciences Meknès Cours ATOMISTIQUE SVTU/S1 Pr.H
D'une façon générale on représente un atome (élément chimique) X par la notation suivante : Avec : Z est le numéro atomique et correspond au nombre de protons
 FICHE 1 - Atomistique
FICHE 1 - Atomistique
Remarque : il y a environ NA moles d'atomes d'hydrog`ene (ou de nucléons) dans 1g d'hydrog`ene. 5. Unité de masse atomique = 1/12 de la masse d'un atome de.
 COURS DATOMISTIQUE
COURS DATOMISTIQUE
L'atome est un ensemble électriquement neutre comportant une partie centrale le noyau. ( protons + neutrons )
 COURS DE CHIMIE GENERALE Semestre 1 SVI
COURS DE CHIMIE GENERALE Semestre 1 SVI
COURS D'ATOMISTIQUE. CHAPITRE I : STRUCTURE DE L'ATOME. I. INTRODUCTION. La matière peut être décrite à deux niveaux : ? macroscopique qui concerne la
 COURS DE CHIMIE-PCSI/MPSI/TSI- elfilalisaid@yahoo.fr Page -2
COURS DE CHIMIE-PCSI/MPSI/TSI- elfilalisaid@yahoo.fr Page -2
? On rappelle que l'atome est constitué d'un noyau et des électrons. ? On appelle élément chimique l'entité qui se conserve lors des réactions chimiques ;
 Cours Atomistique(1).pdf
Cours Atomistique(1).pdf
La masse d'une mole d'atomes d'un élément est appelée la masse molaire de l'atome. 1.3.6 Masse atomique relative. Dans le cas général un élément possède un ou
 Cours de Chimie Structure de la matière
Cours de Chimie Structure de la matière
1mole (d'atomes ions
 Filière SVT-S1 Module 6 « Chimie Générale »
Filière SVT-S1 Module 6 « Chimie Générale »
COURS D'ATOMISTIQUE dispensé aux étudiants de SVT Elaboré par Sanaâ SAOIABI et Ahmed peut prendre que deux valeurs: s = 1/2 et s = -1/2. Résumé :.
 Rappels atomistiques structure des métaux
Rappels atomistiques structure des métaux
http://campus.cerimes.fr/odontologie/enseignement/chap1/site/html/cours.pdf
 Résumé-Formules et méthodes-III_2040-2041
Résumé-Formules et méthodes-III_2040-2041
L'atome est composé d'un noyau lui-même constitué de protons et Au cours d'une réaction chimique
 Résumés de Atomistique ( Excellent ) smpc s1 pdf - AL3ABKARI-PRO
Résumés de Atomistique ( Excellent ) smpc s1 pdf - AL3ABKARI-PRO
Atomistique smpc S1 sciences de la matière physique et chimie Semestre 1 Faculté Science Université cours résumé
 [PDF] Faculté des Sciences Meknès Cours ATOMISTIQUE SVTU/S1 PrH
[PDF] Faculté des Sciences Meknès Cours ATOMISTIQUE SVTU/S1 PrH
D'une façon générale on représente un atome (élément chimique) X par la notation suivante : Avec : Z est le numéro atomique et correspond au nombre de protons
 Cours Atomistique SMPC S1 (Excellent)
Cours Atomistique SMPC S1 (Excellent)
31 oct 2019 · Cours Atomistique SMPC S1 En Format PDF Limites) MIP PDF - OctoPrepa · Analyse 1: Série 2 (16 Exercices - Les Fonction D'un Variable
 Atomistique SMPC S1 _ Cours _ TD Et Exercices _ Résumés
Atomistique SMPC S1 _ Cours _ TD Et Exercices _ Résumés
3 mai 2020 · Module De Atomistique Pour SMPC - S1 _ Cours _ TD Et Exercices (Corrigés) _ Résumés _ Examens (Corrigés) En *PDF · Atomistique SMPC S1
 résumé du cour atomistique smpc s1 - UnivScience
résumé du cour atomistique smpc s1 - UnivScience
18 oct 2018 · Résumé atomistique smpc s1 pdf Un atome est la plus petite unité constitutive de la matière ordinaire possédant les propriétés d'un élément
 Cours Atomistique PDF (S1 SMPC) Gratuit - eBoikcom
Cours Atomistique PDF (S1 SMPC) Gratuit - eBoikcom
Au cours de ce chapitre nous étudierons les « briques élémentaires » de la matière : les atomes Un atome est constitué d'un noyau autour duquel gravitent un ou
 Cours Atomistique filière SMPC S1 PDF - EPrePare
Cours Atomistique filière SMPC S1 PDF - EPrePare
21 jui 2018 · Cours Atomistique filière SMPC S1 PDF · Atomistique · L'atomistique est un domaine de la chimie consacré à l'étude descriptive de la structure
 Atomistique - Cours-Résumés-Exercices et Examens corrigés
Atomistique - Cours-Résumés-Exercices et Examens corrigés
Atomistique: cours Résumés Exercices et examens corrigés I- Généralités sur l'atome L'atome est l'élément fondamental de la matière
 Résumé de Cours Datomistique pdf - Science
Résumé de Cours Datomistique pdf - Science
27 nov 2018 · Résumé de Cours D'atomistique pdf · L'atomistique est un domaine de la chimie consacré à l'étude descriptive de la structure interne de l'atome
 [PDF] Cours Atomistique(1)pdf
[PDF] Cours Atomistique(1)pdf
La masse d'une mole d'atomes d'un élément est appelée la masse molaire de l'atome 1 3 6 Masse atomique relative Dans le cas général un élément possède un ou
UNIVERSITE IBN ZOHR
Ecole Nationale des Sciences Appliquées
d'AgadirFilière Classe préparatoire
Première Année
COURS D'ATOMISTIQUE
Cours préparé par :
Dr. R. SALGHI, Professeur Habilité à l'Ecole Nationale des Sciences Appliquées d'Agadir Pr. L. BAZZI, Professeur à la Faculté des Sciences d'Agadir Pr. A. BELHACHEMI, Professeur à la Faculté des Sciences d'Agadir 2Chapitre I
STRUCTURE DE L'ATOME
CONSTITUANTS DE LA MATIERE
INTRODUCTION
La matière est formée à partir de grains élémentaires: les atomes. 112 atomes ou éléments
ont été découverts et chacun d'eux est désigné par son nom et son symbole.Exemple : Carbone : C ; Azote : N.
Les atomes diffèrent par leurs structures et leurs masses, et sont eux même fragmentés en petites particules : les électrons, les protons et les neutrons. En fait, l'atome n'existe pas souvent à l'état libre, il s'associe avec d'autres pour former des molécules. On a des molécules monoatomiques : gaz rares ( He, Ne, Ar,...), diatomiques (H 2 , O 2 , NaCl,...) et des molécules polyatomiques (H 2 O, H 2 SO 4I - ELECTRON
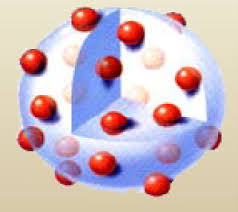
L'atome est un ensemble électriquement neutre comportant une partie centrale, le noyau ( protons + neutrons ), où est centrée pratiquement toute sa masse, et autour duquel se trouvent des électrons.1 - Mise en évidence : Expérience de J.J. Thomson
Sous l'effet d'une tension électrique très élevée ( 40 000 volts) appliquée entre les deux
parties internes d'un tube à décharge, un faisceau est émis de la cathode, appelé rayons cathodiques et recueilli par l'anode.Cathode tube en verre gaz Anode
vide rayons cathodiques2- Propriétés des rayons cathodiques :
- Se propagent de façon rectiligne et perpendiculaire à la cathode. - Ils sont constitués de particules qui transportent de l'énergie. - Ils sont déviés par un champs électrique vers le pôle positif, ce qui indique que les particules constituant ces rayons sont chargées négativement. En 1891, Stoney a donné le nom d'électron pour les particules constituant les rayons cathodiques. Les expériences de Thomson et Millikan, nous ont permis de déterminer la charge e et la masse m e de l'électron : e = 1,602 . 10 -19Coulomb ou C
m e = 9,109 . 10 -31 kg. 3II - NOYAU
1- Mise en évidence : Expérience de Rutherford
L'expérience consiste à bombarder une très mince feuille de métal (Or) par le rayonnement constitué de noyaux d'Helium (He 2+Ecran fluorescent
Feuille d'or
Source (He
2+INTERPRETATION
La matière de la feuille d'or est constituée essentiellement du vide. Sa masse se trouvedonc concentrée en certains points. Les particules passent dans leur grande majorité, entre ces
points de matière condensée que sont les noyaux atomiques. La quasi-totalité des noyaux traversent la feuille d'or sans être déviés. D'autres latraversent en étant simplement déviés (1/100). En fin, très peu de noyaux sont repoussés par la
feuille (1/20000).2- Constitution du noyau atomique
Le noyau est formé de particules élémentaires stables appelées nucléons, qui peuvent se présenter sous deux formes à l'état libre, le neutron et le proton. - Les protons sont chargés positivement : q p = +e = 1,602 . 10 -19 C - La masse du proton : m p = 1,673 . 10 -27 kg 1836 m e - Les neutrons sont de charge nulle, leur masse est : m n = 1,675 . 10 -27 kg. Conclusion : Toute la masse de l'atome est concentrée dans le noyau.III- IDENTIFICATION DES ELEMENTS
1- Représentation
A chaque élément chimique, on a associé un symbole. Il s'écrit toujours avec une majuscule, éventuellement suivie d'une minuscule : AZ X Z est appelé numéro atomique ou nombre de charge, il désigne le nombre de protons ( c'est aussi le nombre d'électrons pour un atome neutre). Pour un élément quelconque, la charge du noyau ( protons) est +Ze. De même la charge des électrons sera -Ze. A est appelé nombre de masse, il désigne le nombre de nucléons (protons + neutons). Si N représente le nombre de neutrons, on aura la relation :A = Z + N
42- Isotopes
Ce sont des atomes de même numéro atomique Z et de nombre de masse A différent. Un élément peut avoir un ou plusieurs isotopes. Il n'est pas possible de les séparer par des réactions chimiques, par contre cela peut être réalisé en utilisant des techniques physiques notamment la spectroscopie de masse.3- Masse atomique
La masse atomique est égale à la somme des masses des constituants de l'atome : m at = Zm e + Zm p + Nm n ( en kg ) L'utilisation de cette unité n'est pas commode, des unités chimiques plus faciles à manipuler ont donc été choisies ; le terme de référence étant le carbone 12. Par définition, l'unité de masse atomique qu'on note u.m.a est le 121ème de la
masse d'un atome de carbone 12 ( 12 C). u.m.a = 121m c
4- Mole et masse molaire
A notre échelle, on raisonne sur une certaine quantité de matière appelée mole : La mole est la quantité de matière qui contient autant d'atomes qu'il y a dans 12g de carbone 12. Le nombre est appelé nombre d'AvogadroN : N = 6,0221. 10
23Un tel nombre s'appelle donc une mole (
N molécules) ou atome -gramme (N atomes).
Par définition
Une mole d'atomes de carbone 12 pèse 12g. La masse d'un atome vaut 12 u.m.a, donc :N. 12 u.m.a
ou encore1 u.m.a = 1/
N = 1,66 . 10
-24 g = 1,66 . 10 -27 kg.Masse molaire :
La masse d'une mole d'atomes d'un élément est appelée la masse molaire de l'atome.5- Masse atomique relative
Dans le cas général, un élément possède un ou plusieurs isotopes ; donc la masse atomique sera la somme des proportions relatives à chaque isotope. m = (x i . m i ) u.m.a de même la masse molaire sera :M = (x
i . M i ) (g/mole) 5CHAPITRE II
MODELES CLASSIQUES DE L'ATOME
I - MODELE DE RUTHERFORD
Ce modèle est basé sur l'existence du noyau dans lequel est pratiquement concentrée toute la masse de l'atome et autour duquel gravitent des électrons. La stabilité mécanique résulte de la compensation des forces d'attractions F a par les forces centrifuges F c dues à la rotation des électrons autour du noyau. L'avantage de ce modèle c'est qu'il ne fait appel qu'aux lois de la mécanique classique.Par contre, il présente des inconvénients :
La théorie électromagnétique exige que l'électron rayonne des ondes électromagnétiques, donc il va perdre de l'énergie et finirait par tomber sur le noyau. L'énergie lumineuse émise varie de façon continue. Ces deux conclusions sont en contradiction avec l'expérience.II - MODELE DE BOHR
1- Description ( cas de l'atome d'hydrogène )
Pour lever les contradictions précédantes, Bohr propose quatre hypothèses : Dans l'atome, le noyau est immobile alors que l'électron de masse m se déplace autour du noyau selon une orbite circulaire de rayon r. L'électron ne peut se trouver que sur des orbites privilégiées sans émettre de l'énergie ; on les appelle "orbites stationnaires". Lorsqu'un électron passe d'un niveau à un autre il émet ou absorbe de l'énergie :E = h.
Le moment cinétique de l'électron ne peut prendre que des valeurs entières (quantification du moment cinétique) : mvr = n.h/2 h : constante de Planck et n : entier naturel.2 - Aspect quantitatif de l'atome de Bohr
Le système est stable par les deux forces F
a et F cForce d'attraction :
F a = e 2 / 4 0 r 2Force centrifuge :
F c = mv 2 / rLe système est en équilibre si :
F a = F c càd : mv 2 = e 2 / 4 0 r (1)Energie totale du système :
E T = Ec + Ep Ec : énergie cinétique Ep : énergie potentielle , elle est due à l'attraction du noyauDonc Ep = F
a dr = - e 2 / 4 0 rD'autre part : Ec = mv
2 /2Donc : E
T = - e 2 / 8 0 r (2) 6Rayon de l'orbite :
On sait que : mvr = n.h/2
Donc mv
2 = n 2 h 2 / 4 2 mr 2 (3) (1) et (3) donnent : r = 0quotesdbs_dbs11.pdfusesText_17[PDF] manuel d'échographie pdf
[PDF] ecologie végétale et environnement pdf
[PDF] cours écologie 2éme année biologie
[PDF] cours macroéconomie l1 eco gestion
[PDF] cours de management s1 pdf
[PDF] option sciences économiques secondaire
[PDF] programme sciences économiques
[PDF] le budget des ménages cours
[PDF] cours bts muc 2eme année
[PDF] cours economie bts muc 2ème année
[PDF] cours bts muc management des entreprises
[PDF] économie du sport master
[PDF] sport et développement économique
[PDF] sociologie du sport
