 Faculté des Sciences Meknès Cours ATOMISTIQUE SVTU/S1 Pr.H
Faculté des Sciences Meknès Cours ATOMISTIQUE SVTU/S1 Pr.H
D'une façon générale on représente un atome (élément chimique) X par la notation suivante : Avec : Z est le numéro atomique et correspond au nombre de protons
 Cours datomistique S1/SMP-SMC
Cours datomistique S1/SMP-SMC
L'atome étant très petit on préfère utiliser la masse molaire atomique qui correspond bien sur à la masse d'une mole d'atomes. Page 11. La mole est définie
 Cours Atomistique(1).pdf
Cours Atomistique(1).pdf
La masse d'une mole d'atomes d'un élément est appelée la masse molaire de l'atome. 1.3.6 Masse atomique relative. Dans le cas général un élément possède un ou
 FICHE 1 - Atomistique
FICHE 1 - Atomistique
nucléons) dans 1g d'hydrog`ene. 5. Unité de masse atomique = 1/12 de la masse d'un atome de. 12. 6.
 Cours dAtomistique
Cours dAtomistique
Atomistique / SMPC-S1. Prs. A. Hakam S. Ferfra & S. Sebbahi. Page 52. Ainsi En résumé
 Filière SVT-S1 Module 6 « Chimie Générale »
Filière SVT-S1 Module 6 « Chimie Générale »
COURS D'ATOMISTIQUE. Dispensé aux étudiants de SVT. Elaboré par : - Sanaâ Résumé : Couche. Valeur de n. Valeur de l Sous-couche Valeur de m. Nbre d'O. A ψ nl ...
 Cours dAtomistique
Cours dAtomistique
probabilité de désintégration d'un noyau par unité de temps. Elle s'exprime en s–1 . La constante λ ne dépend que du nucléide. Elle est indépendante du temps
 COURS DE CHIMIE GENERALE Semestre 1 SVI
COURS DE CHIMIE GENERALE Semestre 1 SVI
Partie I : COURS D'ATOMISTIQUE. CHAPITRE I : STRUCTURE DE L'ATOME. I La quantité totale de chaleur Q1 gagnée par S1 au cours de la transformation s'écrit donc ...
 Atomistique et Chimie Organique Cours et Exercices Corrigés
Atomistique et Chimie Organique Cours et Exercices Corrigés
Pour décrire totalement l'électron d'un atome il faut lui attribuer un quatrième nombre quantique (noté s ou ms) lié à la rotation autour de lui-même. Ce
 Chimie Générale (Chimie 1)
Chimie Générale (Chimie 1)
23 déc. 2020 Cette loi constitue avec la loi des proportions multiples
 Faculté des Sciences Meknès Cours ATOMISTIQUE SVTU/S1 Pr.H
Faculté des Sciences Meknès Cours ATOMISTIQUE SVTU/S1 Pr.H
D'une façon générale on représente un atome (élément chimique) X par la notation suivante : Avec : Z est le numéro atomique et correspond au nombre de protons
 FICHE 1 - Atomistique
FICHE 1 - Atomistique
Remarque : il y a environ NA moles d'atomes d'hydrog`ene (ou de nucléons) dans 1g d'hydrog`ene. 5. Unité de masse atomique = 1/12 de la masse d'un atome de.
 COURS DATOMISTIQUE
COURS DATOMISTIQUE
L'atome est un ensemble électriquement neutre comportant une partie centrale le noyau. ( protons + neutrons )
 COURS DE CHIMIE GENERALE Semestre 1 SVI
COURS DE CHIMIE GENERALE Semestre 1 SVI
COURS D'ATOMISTIQUE. CHAPITRE I : STRUCTURE DE L'ATOME. I. INTRODUCTION. La matière peut être décrite à deux niveaux : ? macroscopique qui concerne la
 COURS DE CHIMIE-PCSI/MPSI/TSI- elfilalisaid@yahoo.fr Page -2
COURS DE CHIMIE-PCSI/MPSI/TSI- elfilalisaid@yahoo.fr Page -2
? On rappelle que l'atome est constitué d'un noyau et des électrons. ? On appelle élément chimique l'entité qui se conserve lors des réactions chimiques ;
 Cours Atomistique(1).pdf
Cours Atomistique(1).pdf
La masse d'une mole d'atomes d'un élément est appelée la masse molaire de l'atome. 1.3.6 Masse atomique relative. Dans le cas général un élément possède un ou
 Cours de Chimie Structure de la matière
Cours de Chimie Structure de la matière
1mole (d'atomes ions
 Filière SVT-S1 Module 6 « Chimie Générale »
Filière SVT-S1 Module 6 « Chimie Générale »
COURS D'ATOMISTIQUE dispensé aux étudiants de SVT Elaboré par Sanaâ SAOIABI et Ahmed peut prendre que deux valeurs: s = 1/2 et s = -1/2. Résumé :.
 Rappels atomistiques structure des métaux
Rappels atomistiques structure des métaux
http://campus.cerimes.fr/odontologie/enseignement/chap1/site/html/cours.pdf
 Résumé-Formules et méthodes-III_2040-2041
Résumé-Formules et méthodes-III_2040-2041
L'atome est composé d'un noyau lui-même constitué de protons et Au cours d'une réaction chimique
 Résumés de Atomistique ( Excellent ) smpc s1 pdf - AL3ABKARI-PRO
Résumés de Atomistique ( Excellent ) smpc s1 pdf - AL3ABKARI-PRO
Atomistique smpc S1 sciences de la matière physique et chimie Semestre 1 Faculté Science Université cours résumé
 [PDF] Faculté des Sciences Meknès Cours ATOMISTIQUE SVTU/S1 PrH
[PDF] Faculté des Sciences Meknès Cours ATOMISTIQUE SVTU/S1 PrH
D'une façon générale on représente un atome (élément chimique) X par la notation suivante : Avec : Z est le numéro atomique et correspond au nombre de protons
 Cours Atomistique SMPC S1 (Excellent)
Cours Atomistique SMPC S1 (Excellent)
31 oct 2019 · Cours Atomistique SMPC S1 En Format PDF Limites) MIP PDF - OctoPrepa · Analyse 1: Série 2 (16 Exercices - Les Fonction D'un Variable
 Atomistique SMPC S1 _ Cours _ TD Et Exercices _ Résumés
Atomistique SMPC S1 _ Cours _ TD Et Exercices _ Résumés
3 mai 2020 · Module De Atomistique Pour SMPC - S1 _ Cours _ TD Et Exercices (Corrigés) _ Résumés _ Examens (Corrigés) En *PDF · Atomistique SMPC S1
 résumé du cour atomistique smpc s1 - UnivScience
résumé du cour atomistique smpc s1 - UnivScience
18 oct 2018 · Résumé atomistique smpc s1 pdf Un atome est la plus petite unité constitutive de la matière ordinaire possédant les propriétés d'un élément
 Cours Atomistique PDF (S1 SMPC) Gratuit - eBoikcom
Cours Atomistique PDF (S1 SMPC) Gratuit - eBoikcom
Au cours de ce chapitre nous étudierons les « briques élémentaires » de la matière : les atomes Un atome est constitué d'un noyau autour duquel gravitent un ou
 Cours Atomistique filière SMPC S1 PDF - EPrePare
Cours Atomistique filière SMPC S1 PDF - EPrePare
21 jui 2018 · Cours Atomistique filière SMPC S1 PDF · Atomistique · L'atomistique est un domaine de la chimie consacré à l'étude descriptive de la structure
 Atomistique - Cours-Résumés-Exercices et Examens corrigés
Atomistique - Cours-Résumés-Exercices et Examens corrigés
Atomistique: cours Résumés Exercices et examens corrigés I- Généralités sur l'atome L'atome est l'élément fondamental de la matière
 Résumé de Cours Datomistique pdf - Science
Résumé de Cours Datomistique pdf - Science
27 nov 2018 · Résumé de Cours D'atomistique pdf · L'atomistique est un domaine de la chimie consacré à l'étude descriptive de la structure interne de l'atome
 [PDF] Cours Atomistique(1)pdf
[PDF] Cours Atomistique(1)pdf
La masse d'une mole d'atomes d'un élément est appelée la masse molaire de l'atome 1 3 6 Masse atomique relative Dans le cas général un élément possède un ou
COURS DE CHIMIE-PCSI/MPSI/TSI-
elfilalisaid@yahoo.fr Page -2- -SAID EL FILAI-Deuxième partie
STRUCTURE DE LA MATIÈRE
3TABLE DES MATIÈRES
II STRUCTURE DE LA MATIÈRE3
1 STRUCTURE DE LA MATIÈRE7
1.1 Rappel . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .7
1.2 INTERPRÉTATION DU SPECTRE D'ÉMISSION DE L'ATOME D'HYDROGÈNE (MODÈLE DE
1.2.1 Données expérimentales : . . . . . . . . . . . . . . . . . . . . . . . .. .9
1.2.2 Interpretation de BOHR . . . . . . . . . . . . . . . . . . . . . . . . . ..10
1.2.2.1 Modèle de BOHR . . . . . . . . . . . . . . . . . . . . . . . . .10
1.2.2.2 Interpretation du spectre atomique d'Hydrogène . .. . . . . . .12
1.2.2.3 Diagramme énergétique de l'hydrogène : . . . . . . . . . .. .12
1.2.2.4 Théorie de BOHR appliquée aux hydrogènoides . . . . . .. . .13
1.3 L'ATOME A UN ÉLECTRON (HYDROGÉNOIDE) . . . . . . . . . . . . . . . .14
1.3.1 Dualité Onde-corpuscule . . . . . . . . . . . . . . . . . . . . . . . .. . .14
1.3.2 Principe d'incertitude de Heisenberg . . . . . . . . . . . . .. . . . . . . .14
1.3.3 Équation de Schrodinger . . . . . . . . . . . . . . . . . . . . . . . . .. .14
1.3.4 La densité de probabilité . . . . . . . . . . . . . . . . . . . . . . . .. . .14
1.3.5 L'électron en mécanique quantique . . . . . . . . . . . . . . . .. . . . .15
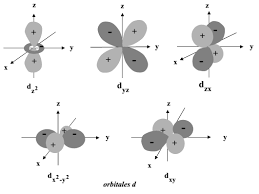
1.3.6 Les nombres quantiques . . . . . . . . . . . . . . . . . . . . . . . . . ..15
1.3.6.1 Le nombre quantique principaln. . . . . . . . . . . . . . . . .16
1.3.6.2 Le nombre quantique secondaire ou azimutal?. . . . . . . . .16
1.3.6.3 Le nombre quantique magnétiquem: . . . . . . . . . . . . . .16
1.3.7 Les orbitales atomiques (O.A) . . . . . . . . . . . . . . . . . . . .. . . .17
1.4 ATOMES POLYÉLECTRONIQUES . . . . . . . . . . . . . . . . . . . . . . . . .17
1.4.1 Le spin et la règle d'exclusion de Pauli. . . . . . . . . . . . . . . . . . .17
1.4.1.1 Définition . . . . . . . . . . . . . . . . . . . . . . . . . . . . .17
1.4.1.2 Règle (principe) d'exclusion de PAULI . . . . . . . . . . .. .18
1.4.1.3 Les niveaux d'énergie et la règle de KLECHKOVSKY . . .. .19
1.4.1.4 Règle de HUND . . . . . . . . . . . . . . . . . . . . . . . . .20
1.4.1.5 Structure électronique des atomes . . . . . . . . . . . . . .. .21
1.5 La classification périodique des éléments . . . . . . . . . . . .. . . . . . . . . . .22
1.5.1 Introduction . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .22
1.5.2 Presentation actuelle du tableau périodique . . . . . . .. . . . . . . . . .22
1.6 Périodicité et propriétés générales des éléments de la classification périodique . . .24
1.6.1 Comportement chimique et position dans la C-P . . . . . . .. . . . . . .24
5 TABLE DES MATIÈRESCOURS DE CHIMIE-PCSI/MPSI/TSI-1.6.2 Potentiel d'ionisation (énergie d'ionisation) . . . .. . . . . . . . . . . . .25
1.6.2.1 Définition . . . . . . . . . . . . . . . . . . . . . . . . . . . . .25
1.6.2.2 Evolution de l'énergie d'ionisation dans le T.P : . .. . . . . . .25
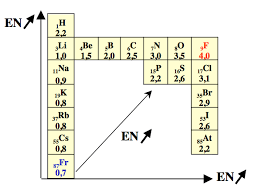
1.6.2.3 L'affinité électronique . . . . . . . . . . . . . . . . . . . . . . .26
1.6.2.4 L'électronégativité . . . . . . . . . . . . . . . . . . . . . . . . .26
1.6.2.4.1 Mulliken . . . . . . . . . . . . . . . . . . . . . . . . .27
1.6.2.4.2 Pauling . . . . . . . . . . . . . . . . . . . . . . . . .27
1.6.2.5 Les grandeurs géométriques . . . . . . . . . . . . . . . . . . .28
1.6.2.5.1 Rayon covalent . . . . . . . . . . . . . . . . . . . . .28
1.6.2.5.2 Rayon métallique . . . . . . . . . . . . . . . . . . . .28
1.6.2.5.3 Rayon ionique . . . . . . . . . . . . . . . . . . . . .28
1.6.2.5.4 Rayon de Van der Waals . . . . . . . . . . . . . . . .28
1.6.2.5.5 L'évolution dans le T-P . . . . . . . . . . . . . . . . .29
1.6.2.6 Nombre d'oxydation . . . . . . . . . . . . . . . . . . . . . . .29
1.6.2.7 La polarisation . . . . . . . . . . . . . . . . . . . . . . . . . .29
1.7 THÉORIE DE LEWIS . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .30
1.7.1 Representation de LEWIS . . . . . . . . . . . . . . . . . . . . . . . . ..30
1.7.2 Liaison covalente . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .30
1.7.3 Règle de l'octet . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .31
1.8 Théorie de Gillespie . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .. . . .33
1.9 Polarité . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . ..36
1.9.1 Définitions . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .36
1.9.2 Applications . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .36
1.9.3 Forces d'interaction . . . . . . . . . . . . . . . . . . . . . . . . . . .. .37
1.9.3.1 Interactions de Van Dear Waals . . . . . . . . . . . . . . . . . .37
1.9.3.2 Liaison hydrogène . . . . . . . . . . . . . . . . . . . . . . . . .37
1.9.3.3 Conséquences . . . . . . . . . . . . . . . . . . . . . . . . . . .37
1.9.4 Applications . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .37
elfilalisaid@yahoo.fr Page -6- -SAID EL FILAI-CHAPITRE1
STRUCTURE DE LA MATIÈRE
1.1 Rappel
?On rappelle que l'atome est constitué d'un noyau et des électrons.?On appelle élément chimique l'entité qui se conserve lors des réactions chimiques; autrement
dit une entité caractérisée par son numéro atomique notéZ.Exemple : H
+;H-;1H;2H;3H ?Le numéro atomiqueZreprésente le nombre de protons etNle nombre de neutrons. ?On appelle nombre de masseAla somme des nucleons (A=Z+N).?On appelle isotopes d'un élément chimique des atomes ayant le mêmeZet différent parN( ou
A). ?Quelques ordre de grandeur : ?La masse d'un électron : me=9,10938356×10-31kg ?Le rayon d'un électron : re=2,8179403227×10-15m ?La masse d'un proton : mp=1,672621898×10-27kg ?Le rayon d'un proton : rp=8,751×10-16m ?Le rayon de Bohr de l'atome d'Hydrogène : ao=0,52917721067×10-12m ?La masse d'un atome est concentrée dans le noyau puisquempme?1836 ( c'est à dire la masse des électrons est très négligeable devant celle des nucleons). 71.1. RAPPELCOURS DE CHIMIE-PCSI/MPSI/TSI-
?On appelle mole de particules un en ensemble deNAparticules;NAconstante d'AVOGADRO sa valeur :NA=6,022140857×1023mol-1
?On appelle masse molaire, la masse d'une mole notéeMexprimée en kgmol-1ou gmol-1.? On appelle abondance isotopique le pourcentage massique d'un isotope.Application: Autour du carbone
1?Le carbone, à l'état naturel, est constitué principalementpar les isotopes12
6C et13
6C.1.1?Que signifient l'indice 6 et l'exposant 13 relatifs à l'isotope13
6C?1.2?Combien de neutrons le noyau de l'isotope13
6C contient-il?
2?En ne considérant que les deux isotopes12
6C et13
6C , déduire de la masse molaire
atomique du carbone à l'état naturel (12,01115 gmol -1) sa fraction molaire en isotope13 6C.On donne :
?Masse molaire atomique de l'isotope126C : 12,000000 gmol-1.
?Masse molaire atomique de l'isotope136C : 13,000000 gmol-1.
Correction
M(C)=xM(12C)+yM(13C) ainsix+y=1 (une mole)A.NGGGGGGGGGGA x=0,98 ety=0,02N.B :x=m(12C)
M(12C)ety=m(13C)M(13C)
Autour du cuivre
Le numéro atomique du cuivre est Z=29.
L'élément cuivre possède deux isotopes naturels :63Cu et65Cu.
1?Quels sont les nombres de protons et de neutrons dans le noyaude63Cu? Même
question pour 65Cu?2?On donne les abondances isotopiques naturelles des atomes de63Cu et65Cu :
69,2% pour le
63Cu et 30,8% pour le65Cu.
Calculer la masse molaireMCude l'élément cuivre.Correction
M(Cu)=63,616 gmol-1
Autour du soufre
Le soufre naturel est constitué de quatre isotopes stables dont deux présents en majorité : x% de l'isotope32Sy% de l'isotope34S. La masse molaire de l'isotope 34 est de 33,968 gmol -1et celle de l'isotope 32 est de 31,972 gmol-1. Calculer les pourcentages isotopiquesxetysachant que la masse molaire atomique du soufre est de 32,066 gmol -1et en supposant que les autres isotopes sont en quantité négli- geable.Correction
x=0,96;y=0,04 elfilalisaid@yahoo.fr Page -8- -SAID EL FILAI-1.2. INTERPRÉTATION DU SPECTRE D'ÉMISSION DE L'ATOME D'HYDROGÈNE (MODÈLE DE
BOHR)COURS DE CHIMIE-PCSI/MPSI/TSI-
1.2 INTERPRÉTATIONDUSPECTRED'ÉMISSIONDEL'ATOME
D'HYDROGÈNE (MODÈLE DE BOHR)
1.2.1 Données expérimentales :
À l'état normal la matière n'émet aucun rayonnement ,mais lorsque elle est excitée elle émet une
radiation lumineuse qui correspond à un changement d'état de l'électron .On peut mettre en évidence les caractéristiques de cette lumière émise en la faisant passer à travers
un dispositif dispersif (prisme , réseau ,...). PrismeRouge (656,3 nm)Bleu (486 nm)Indigo (434 nm)Violet (410 nm)D'où le spectre :
λ(nm)
410 434 486 656.3
C'est un spectre discontinu constitué de quatres raies dansle visible :c'est la série de BALMER
qui a montré expérimentalement en 1885 queσ=1λ=RH(122-1m2)
avecm?N>2 ?σ:nombre d'onde. ?λ: La longueur d'onde. ?RHla constante de RYDBERG pour l'atome d'hydrogène il a trouvéexpérimentalement que :RH=109677,5 cm-1
En 1908 RITZ a généralisé la formule de BALMER .σ=1λ=RH(1n2-1m2)
avecm>n elfilalisaid@yahoo.fr Page -9- -SAID EL FILAI-1.2. INTERPRÉTATION DU SPECTRE D'ÉMISSION DE L'ATOME D'HYDROGÈNE (MODÈLE DE
BOHR)COURS DE CHIMIE-PCSI/MPSI/TSI-
?n=1=?série de LYMAN (UV) ?n=2=?série de BALMER (Visible) ?n=3=?série de PASCHEN (IR) ?n=4=?série de BRACKET (IR)1.2.2 Interpretation de BOHR
1.2.2.1 Modèle de BOHR
C'est un modèle planétaire où l'électron décrit un mouve- ment circulaire . Dans le repère de FRENET , la relation fondamentale de la dynamique s'écrit :F=m-→a=?e2
Par conséquent :
?La projection suivant-→Tdonne : dV dt=0=?V=cte OM(e) T N -→FeC'est à dire que l'électron décrit un
mouvement circulaire uniforme ?La projection suivant-→Ndonne : mV2=e24πεor ?L'énergie cinétique de l'électron :Ec=12mV2=?Ec=e28πεor
?L'énergie potentielle de l'électron ( Voir cours de mécanique) :Ep=-e24πεor
?L'énergie mécanique de l'électron :Em=Ec+Ep=?Em=-e28πεor
L"énergie mécanique de l"électron est une fonction continue deretrvarie defaçon continue;donc ce résultat ne permet pas d'expliquer le spectre discontinu de l'atome d'hy-
drogène. elfilalisaid@yahoo.fr Page -10- -SAID EL FILAI-1.2. INTERPRÉTATION DU SPECTRE D'ÉMISSION DE L'ATOME D'HYDROGÈNE (MODÈLE DE
BOHR)COURS DE CHIMIE-PCSI/MPSI/TSI-
BOHR a formulé certaines hypothèses :
L'électron sur la même trajectoire : état stationnaire .En→Em>En: absorption d'énergie
En→Ep D'après la théorie des quanta de PLANCK :
Em-En=hν=hcλ
Et commeν(λ) ne peut prendre que certaines valeurs discrètes; alorsL'énergie est quantifiée
BOHR a quantifié la norme du moment cinétique : σ=mrV=n?=nh2π
Ce qui donne :
V=nh2πrm=nh2πrμ
Avecμ=masse réduite en tenant compte du mouvement de l'électron autour du proton supposé l'atome isolé dans le référentiel barycentrique ( Voir cours de mécanique). μV2=nh
rn=εoh2πμe2n2=?rn=aon2 Quantification du rayonrde la trajectoire
Remarque
ao=rn(n=1) est appelé le rayon de BOHR sa valeur vautao=0,529 Å Ainsi :
En=-μe48ε2oh21n2=?En=-Eon2
Quantification de l'énergie totaleE
Eo=E(n=1)=μe48ε2oh2?13,6 eV
On retient donc :
rn=an2?En=-Eon2 elfilalisaid@yahoo.fr Page -11- -SAID EL FILAI- 1.2. INTERPRÉTATION DU SPECTRE D'ÉMISSION DE L'ATOME D'HYDROGÈNE (MODÈLE DE
BOHR) COURS DE CHIMIE-PCSI/MPSI/TSI-
De même on trouve la quantification de la vitesse : Vn=e22εoh1n=?Vn=Von
Avec Vo=Vn(n=1)=e22εohA.NGGGGGGGGGGA Vo=2,18×106ms-1 1.2.2.2 Interpretation du spectre atomique d'Hydrogène
On a :Em-En=hν=?ν=cλ=μe48ε2oh2(1n2-1m2) C'est à dire : σ=1λ=μe48ε2oh2(1n2-1m2)
On retrouve la formule de RITZ avec :
RH=μe48ε2oh2=109737,2 cm-1
Valeur très proche de la valeur expérimentale obtenue à partir du spectre de l'atome d'hydrogène;
d'où le grand succès du module de BOHR 1.2.2.3 Diagramme énergétique de l'hydrogène :
On a :En=-13,6n2:n=1 : c'est l'état fondamental . n→ ∞=?E(∞)=0
Pour ioniser l'électron dans l'atome d'hydrogène il faut communiquer une énergie telle que :
EI=E(∞)-E(1)=?E.I=13,6eV
Pour :
Pour les états excités :
rn=0,53n2(Å) elfilalisaid@yahoo.fr Page -12- -SAID EL FILAI- 1.2. INTERPRÉTATION DU SPECTRE D'ÉMISSION DE L'ATOME D'HYDROGÈNE (MODÈLE DE
BOHR) COURS DE CHIMIE-PCSI/MPSI/TSI-
Diagramme des états de l'atome d'Hydrogène :λ(nm) 0 -1 -2 -3 -4 -5 -6 -7 -8 -9 -10 -11 -12 -13 -14 -15 -13,6-3,4 -1,51 -0,86 -0,544-0,378E 121,57102,5897,2594,98
LYMAN BALMER
PASCHEN
BRACKET
656,2486,1434410,1
1005
1093,8
1281,8
1875,1
2630
4050
1.2.2.4 Théorie de BOHR appliquée aux hydrogènoides
On appelle hydrogénoide un atome qui possède un seul électron. D´efinition
Exemple
H , He+,Li2+,Be3+,...
elfilalisaid@yahoo.fr Page -13- -SAID EL FILAI- 1.3. L'ATOME A UN ÉLECTRON (HYDROGÉNOIDE)COURS DE CHIMIE-PCSI/MPSI/TSI-
Dans le calcul on remplaceeparZeon trouve :
quotesdbs_dbs5.pdfusesText_9
D'après la théorie des quanta de PLANCK :
Em-En=hν=hcλ
Et commeν(λ) ne peut prendre que certaines valeurs discrètes; alorsL'énergie est quantifiée
BOHR a quantifié la norme du moment cinétique :σ=mrV=n?=nh2π
Ce qui donne :
V=nh2πrm=nh2πrμ
Avecμ=masse réduite en tenant compte du mouvement de l'électron autour du proton supposé l'atome isolé dans le référentiel barycentrique ( Voir cours de mécanique).μV2=nh
rn=εoh2πμe2n2=?rn=aon2Quantification du rayonrde la trajectoire
Remarque
ao=rn(n=1) est appelé le rayon de BOHR sa valeur vautao=0,529 ÅAinsi :
En=-μe48ε2oh21n2=?En=-Eon2
Quantification de l'énergie totaleE
Eo=E(n=1)=μe48ε2oh2?13,6 eV
On retient donc :
rn=an2?En=-Eon2 elfilalisaid@yahoo.fr Page -11- -SAID EL FILAI-1.2. INTERPRÉTATION DU SPECTRE D'ÉMISSION DE L'ATOME D'HYDROGÈNE (MODÈLE DE
BOHR)COURS DE CHIMIE-PCSI/MPSI/TSI-
De même on trouve la quantification de la vitesse :Vn=e22εoh1n=?Vn=Von
Avec Vo=Vn(n=1)=e22εohA.NGGGGGGGGGGA Vo=2,18×106ms-11.2.2.2 Interpretation du spectre atomique d'Hydrogène
On a :Em-En=hν=?ν=cλ=μe48ε2oh2(1n2-1m2) C'est à dire :σ=1λ=μe48ε2oh2(1n2-1m2)
On retrouve la formule de RITZ avec :
RH=μe48ε2oh2=109737,2 cm-1
Valeur très proche de la valeur expérimentale obtenue à partir du spectre de l'atome d'hydrogène;
d'où le grand succès du module de BOHR1.2.2.3 Diagramme énergétique de l'hydrogène :
On a :En=-13,6n2:n=1 : c'est l'état fondamental .n→ ∞=?E(∞)=0
Pour ioniser l'électron dans l'atome d'hydrogène il faut communiquer une énergie telle que :
EI=E(∞)-E(1)=?E.I=13,6eV
Pour :
Pour les états excités :
rn=0,53n2(Å) elfilalisaid@yahoo.fr Page -12- -SAID EL FILAI-1.2. INTERPRÉTATION DU SPECTRE D'ÉMISSION DE L'ATOME D'HYDROGÈNE (MODÈLE DE
BOHR)COURS DE CHIMIE-PCSI/MPSI/TSI-
Diagramme des états de l'atome d'Hydrogène :λ(nm) 0 -1 -2 -3 -4 -5 -6 -7 -8 -9 -10 -11 -12 -13 -14 -15 -13,6-3,4 -1,51 -0,86 -0,544-0,378E121,57102,5897,2594,98
LYMANBALMER
PASCHEN
BRACKET
656,2486,1434410,1
10051093,8
1281,8
1875,1
26304050
1.2.2.4 Théorie de BOHR appliquée aux hydrogènoides
On appelle hydrogénoide un atome qui possède un seul électron.D´efinition
Exemple
H , He+,Li2+,Be3+,...
elfilalisaid@yahoo.fr Page -13- -SAID EL FILAI-1.3. L'ATOME A UN ÉLECTRON (HYDROGÉNOIDE)COURS DE CHIMIE-PCSI/MPSI/TSI-
Dans le calcul on remplaceeparZeon trouve :
quotesdbs_dbs5.pdfusesText_9[PDF] manuel d'échographie pdf
[PDF] ecologie végétale et environnement pdf
[PDF] cours écologie 2éme année biologie
[PDF] cours macroéconomie l1 eco gestion
[PDF] cours de management s1 pdf
[PDF] option sciences économiques secondaire
[PDF] programme sciences économiques
[PDF] le budget des ménages cours
[PDF] cours bts muc 2eme année
[PDF] cours economie bts muc 2ème année
[PDF] cours bts muc management des entreprises
[PDF] économie du sport master
[PDF] sport et développement économique
[PDF] sociologie du sport
