 Faculté des Sciences Meknès Cours ATOMISTIQUE SVTU/S1 Pr.H
Faculté des Sciences Meknès Cours ATOMISTIQUE SVTU/S1 Pr.H
D'une façon générale on représente un atome (élément chimique) X par la notation suivante : Avec : Z est le numéro atomique et correspond au nombre de protons
 Cours datomistique S1/SMP-SMC
Cours datomistique S1/SMP-SMC
L'atome étant très petit on préfère utiliser la masse molaire atomique qui correspond bien sur à la masse d'une mole d'atomes. Page 11. La mole est définie
 Cours Atomistique(1).pdf
Cours Atomistique(1).pdf
La masse d'une mole d'atomes d'un élément est appelée la masse molaire de l'atome. 1.3.6 Masse atomique relative. Dans le cas général un élément possède un ou
 FICHE 1 - Atomistique
FICHE 1 - Atomistique
nucléons) dans 1g d'hydrog`ene. 5. Unité de masse atomique = 1/12 de la masse d'un atome de. 12. 6.
 Cours dAtomistique
Cours dAtomistique
Atomistique / SMPC-S1. Prs. A. Hakam S. Ferfra & S. Sebbahi. Page 52. Ainsi En résumé
 Filière SVT-S1 Module 6 « Chimie Générale »
Filière SVT-S1 Module 6 « Chimie Générale »
COURS D'ATOMISTIQUE. Dispensé aux étudiants de SVT. Elaboré par : - Sanaâ Résumé : Couche. Valeur de n. Valeur de l Sous-couche Valeur de m. Nbre d'O. A ψ nl ...
 Cours dAtomistique
Cours dAtomistique
probabilité de désintégration d'un noyau par unité de temps. Elle s'exprime en s–1 . La constante λ ne dépend que du nucléide. Elle est indépendante du temps
 COURS DE CHIMIE GENERALE Semestre 1 SVI
COURS DE CHIMIE GENERALE Semestre 1 SVI
Partie I : COURS D'ATOMISTIQUE. CHAPITRE I : STRUCTURE DE L'ATOME. I La quantité totale de chaleur Q1 gagnée par S1 au cours de la transformation s'écrit donc ...
 Atomistique et Chimie Organique Cours et Exercices Corrigés
Atomistique et Chimie Organique Cours et Exercices Corrigés
Pour décrire totalement l'électron d'un atome il faut lui attribuer un quatrième nombre quantique (noté s ou ms) lié à la rotation autour de lui-même. Ce
 Chimie Générale (Chimie 1)
Chimie Générale (Chimie 1)
23 déc. 2020 Cette loi constitue avec la loi des proportions multiples
 Faculté des Sciences Meknès Cours ATOMISTIQUE SVTU/S1 Pr.H
Faculté des Sciences Meknès Cours ATOMISTIQUE SVTU/S1 Pr.H
D'une façon générale on représente un atome (élément chimique) X par la notation suivante : Avec : Z est le numéro atomique et correspond au nombre de protons
 FICHE 1 - Atomistique
FICHE 1 - Atomistique
Remarque : il y a environ NA moles d'atomes d'hydrog`ene (ou de nucléons) dans 1g d'hydrog`ene. 5. Unité de masse atomique = 1/12 de la masse d'un atome de.
 COURS DATOMISTIQUE
COURS DATOMISTIQUE
L'atome est un ensemble électriquement neutre comportant une partie centrale le noyau. ( protons + neutrons )
 COURS DE CHIMIE GENERALE Semestre 1 SVI
COURS DE CHIMIE GENERALE Semestre 1 SVI
COURS D'ATOMISTIQUE. CHAPITRE I : STRUCTURE DE L'ATOME. I. INTRODUCTION. La matière peut être décrite à deux niveaux : ? macroscopique qui concerne la
 COURS DE CHIMIE-PCSI/MPSI/TSI- elfilalisaid@yahoo.fr Page -2
COURS DE CHIMIE-PCSI/MPSI/TSI- elfilalisaid@yahoo.fr Page -2
? On rappelle que l'atome est constitué d'un noyau et des électrons. ? On appelle élément chimique l'entité qui se conserve lors des réactions chimiques ;
 Cours Atomistique(1).pdf
Cours Atomistique(1).pdf
La masse d'une mole d'atomes d'un élément est appelée la masse molaire de l'atome. 1.3.6 Masse atomique relative. Dans le cas général un élément possède un ou
 Cours de Chimie Structure de la matière
Cours de Chimie Structure de la matière
1mole (d'atomes ions
 Filière SVT-S1 Module 6 « Chimie Générale »
Filière SVT-S1 Module 6 « Chimie Générale »
COURS D'ATOMISTIQUE dispensé aux étudiants de SVT Elaboré par Sanaâ SAOIABI et Ahmed peut prendre que deux valeurs: s = 1/2 et s = -1/2. Résumé :.
 Rappels atomistiques structure des métaux
Rappels atomistiques structure des métaux
http://campus.cerimes.fr/odontologie/enseignement/chap1/site/html/cours.pdf
 Résumé-Formules et méthodes-III_2040-2041
Résumé-Formules et méthodes-III_2040-2041
L'atome est composé d'un noyau lui-même constitué de protons et Au cours d'une réaction chimique
 Résumés de Atomistique ( Excellent ) smpc s1 pdf - AL3ABKARI-PRO
Résumés de Atomistique ( Excellent ) smpc s1 pdf - AL3ABKARI-PRO
Atomistique smpc S1 sciences de la matière physique et chimie Semestre 1 Faculté Science Université cours résumé
 [PDF] Faculté des Sciences Meknès Cours ATOMISTIQUE SVTU/S1 PrH
[PDF] Faculté des Sciences Meknès Cours ATOMISTIQUE SVTU/S1 PrH
D'une façon générale on représente un atome (élément chimique) X par la notation suivante : Avec : Z est le numéro atomique et correspond au nombre de protons
 Cours Atomistique SMPC S1 (Excellent)
Cours Atomistique SMPC S1 (Excellent)
31 oct 2019 · Cours Atomistique SMPC S1 En Format PDF Limites) MIP PDF - OctoPrepa · Analyse 1: Série 2 (16 Exercices - Les Fonction D'un Variable
 Atomistique SMPC S1 _ Cours _ TD Et Exercices _ Résumés
Atomistique SMPC S1 _ Cours _ TD Et Exercices _ Résumés
3 mai 2020 · Module De Atomistique Pour SMPC - S1 _ Cours _ TD Et Exercices (Corrigés) _ Résumés _ Examens (Corrigés) En *PDF · Atomistique SMPC S1
 résumé du cour atomistique smpc s1 - UnivScience
résumé du cour atomistique smpc s1 - UnivScience
18 oct 2018 · Résumé atomistique smpc s1 pdf Un atome est la plus petite unité constitutive de la matière ordinaire possédant les propriétés d'un élément
 Cours Atomistique PDF (S1 SMPC) Gratuit - eBoikcom
Cours Atomistique PDF (S1 SMPC) Gratuit - eBoikcom
Au cours de ce chapitre nous étudierons les « briques élémentaires » de la matière : les atomes Un atome est constitué d'un noyau autour duquel gravitent un ou
 Cours Atomistique filière SMPC S1 PDF - EPrePare
Cours Atomistique filière SMPC S1 PDF - EPrePare
21 jui 2018 · Cours Atomistique filière SMPC S1 PDF · Atomistique · L'atomistique est un domaine de la chimie consacré à l'étude descriptive de la structure
 Atomistique - Cours-Résumés-Exercices et Examens corrigés
Atomistique - Cours-Résumés-Exercices et Examens corrigés
Atomistique: cours Résumés Exercices et examens corrigés I- Généralités sur l'atome L'atome est l'élément fondamental de la matière
 Résumé de Cours Datomistique pdf - Science
Résumé de Cours Datomistique pdf - Science
27 nov 2018 · Résumé de Cours D'atomistique pdf · L'atomistique est un domaine de la chimie consacré à l'étude descriptive de la structure interne de l'atome
 [PDF] Cours Atomistique(1)pdf
[PDF] Cours Atomistique(1)pdf
La masse d'une mole d'atomes d'un élément est appelée la masse molaire de l'atome 1 3 6 Masse atomique relative Dans le cas général un élément possède un ou

UNIVERSITE CADI AYYAD
Faculté Polydisciplinaire
SafiDépartement de Chimie
COURS DE CHIMIE GENERALE
Semestre 1
SVIPréparé par :
Moulay Rachid LAAMARI
2017-2018
1SOMMAIRE
Partie I :
CHAPITRE I :
I. INTRODUCTION
1. Représentation
2. Les isotopes
3. Mole et masse molaire
4.CHAPITRE II:
I. MODELE DE RUTHERFORD
II. MODELE DE BOHR
I. PROBABILITE ET DENSITE DE PROBABILITE.
II.III. LES NOMBRES QUANTIQUES.
III. LES ORBITALES ATOMIQUES : O.A.
CHAPITRE IV: LES ATOMES POLYELECTRONIQUES
I. CONFIGURATIONS ELECTRONIQUE DES ATOMES.
1.2. Principe de stabilité. Règle de KLECHOVSKI.
3. Règle de HUND.
II. LA CLASSIFICATION PERIODIQUE DES ELEMENTS
1. Les périodes.
2. Les groupes (ou familles).
3. Les principales familles du tableau périodique.
PARTIE II : THERMOCHIMIE
CHAPITRE I : INTRODUCTION A LA THERMODYNAMIQUE CHIMIQUEI. INTRODUCTION
II. LE SYSTEME
III. LES VARIABLES D'ETAT
2VI. TRANSFORMATION THERMOMECANIQUE
V. TRANSFORMATION CHIMIQUE
CHAPITRE II : PREMIER PRINCIPE DE LA THERMODYNAMIQUE ENERGIEINTERNE ET ENTHALPIE
I. II. ÉNONCÉ DU PREMIER PRINCIPE DE LA THERMODYNAMIQUEIII. ÉCHANGES
IV. ÉNERGIE INTERNE
V. DETERMINATION DE CHALEUR DE REACTION
VI. EFFET DE LA TEMPERATURE
PARTIE III : CHIMIE DES SOLUTIONS
Chapitre I : rappels et généralités
1. Définitions
1.1. Solution
1.2. La masse volumique
1.3. La densité
1.4. Pourcentage ou Fraction
CHAPITRE II : REACTIONS ACIDO-BASIQUES
1. Définitions
1.2. Définition de BRONSTED
1.3. Couple acide-base conjugués
1.4. Force des acides et des bases
2. CALCUL DE PH DES SOLUTIONS AQUEUSES
forte2.4. Cas des bases faibles.
33. Solutions tampon.
3.1. Définition de la ST.
3.2. Propriété de la ST.
3.3. Préparation de la ST.
3.4. Calcul du pH de ST
4. Titrages acide-base.
1.1. 1.2. -REDUCTION1. Généralités.
1.1. Oxydant, réducteur, oxydation, réduction.
1.2. Réaction -réduction
2.1. Définition.
: Equation de Nernst3.1. Potentiel normal (standard)
3.2. Equation de Nernst :
4. Réaction -réduction
4.1. Définition :
4.2. 4.34.4. -réduction
CHAPITRE IV : REACTIONS DE DISSOLUTION-PRECIPITATION1. Solubilité
2. Réaction de précipitation.
3. Produit de solubilité.
4. Facteurs influençant la solubilité.
4I. INTRODUCTION
La matière peut être décrite à deux niveaux : macroscopique qui concerne la partie observable et mesurable à notre échelle (Ensemble microscopique qui concerne les particules réelles (molécule, atome ou ion).92 sont naturels et les atomes restant
Chaque atome est désigné par son nom et son symbole. Exemple : Oxygène : O Chlore : ClLes atomes diffèrent par leurs structures et leurs masses, et sont eux même fragmentés en petites
particules : les électrons, les protons et les neutrons. -24 g à 10-27 g. Ces chiffres ne sont pas pratiques, on utilise la notion de mole.Une mole correspond à la quantité de matière contenue dans 6,02 ×1023 particules (atome ou
molécule). N= 6,02 ×1023 de particules " indivisibles ». La matière est formée de molécules qui sont constitué des contient essentiellement des électrons, des protons, et des neutrons.élément charge ( C ) masse (Kg)
électron -1,6 10-19 9,11 10-31
proton 1,6 10-19 1,672 10-27 neutron 0 1,6747 10-27 N.B. - Les protons et les neutrons sont appelés " les nucléons ». L'atome est un ensemble électriquement neutre comportant un noyau (protons + neutrons), où est centrée pratiquement toute sa masse, autour duquel se trouvent des électrons.III. LES CARACTERISTIQUE DE
5. Représentation
5A chaque
Z est appelé numéro atomique ou nombre de charge, il désigne le le A est appelé nombre de masse, il désigne le nombre de nucléons (protons + neutrons). Si N représente le nombre de neutrons, on aura la relation: A=Z+N.Exemple
6. Les isotopes
é, des atomes ayant le même nombre de protons (mêmeZ) mais un nombre de neutrons différent (A différent). Les isotopes ne diffèrent alors que par
la composition des noyaux.Exemple
7. Mole et masse molaire
Une mole correspond à la quantité de matière contenue dans 6.02 10 23 particules
élémentaires.
pourcentages restent constants. s. Elle correspond à la moyenne des masses des isotopes pondérés par leurs pourcentages.Exemple :
Le Bore existe sous forme de deux isotopes 10B et 11B avec les proportions respectives de19,91 % et 80,09 %. La masse molaire donnée dans les tables est 10,83 g. Cette
valeur est la moyenne des masses molaires des deux isotopes. ivement 10,0129 g et 11,0093 g. 6 8.Le Kg est mal adaptée
appelée unité de masse atomique noté u.m.a. Par définition une masse de 12 g de carbone renferme N atomes, donc1 u.m.a = Or N = 6,02 1023 donc 1 u.m.a = 1,6604 10-24 g.
Exemple :
Masse du proton = 1,6724 10-24 g = 1,0072 u.m.a.
Masse du neutron = 1,6747 10-24 g = 1,0087 u.m.a.
7CHAPITRE II:
I. MODELE DE RUTHERFORD
F c du noyau. (mouvement circulaire) de la compensation de la force ttraction Fa par la force centrifuge Fc due à la rotationT = EC + EP
on a : Ce modèle présente les inconvénients suivants : 8 une accélération elle doit rayonner. ETII. MODELE DE BOHR
1. Pour lever les contradictions précédentes, Bohr propose quatre hypothèses : du noyau selon une orbite circulaire de rayon r. on les appelle " orbites stationnaires ». (quantification du moment cinétique). h : constante de Planck = 6,626 10-34 j.s n : entier naturel 2. Le système est stable par les deux forces Fa et Fc. Le système est en équilibre si : F a = F c 9Les relations (1)et (3) donnent :
Si on remplace (4) dans (2) on obtient :
quantifiée. E = -qv = 1,602 10-19 X 1 = 1,602 10-19 J = 1 ev ; Donc : 1 ev = 1,602 10 -19 J3. Absorption et é
niveau (orbite) à un autre. niveaux (relation de Plaǻ Ȟ Ef : état final ; Ei : état initial ; h : Cste de Planck ȞAbsorption : à un niveau p (p>n)
Ȟn-p .
Emission :
de fréquence Ȟp-n ENE. 10 11I. PROBABILITE ET DENSITE DE PROBABILITE.
En mécanique classique (Théorie de Bohr), l'étude du mouvement d'un électron consiste à
chercher avec précision sa trajquantique on parle en terme de : Probabilité de présence de l'électron dans une certaine région de - son état énergétique - sa probabilité de présence à un endroit donné.Probabilité de présence
M par :
On dit que la fonction d'onde est normée.
Ainsi, la notion classique de position est remplacée par la notion de : Densité de probabilité de
présence. II-1- Cas général.
Cette équation représente la relation fonda
12III. LES NOMBRES QUANTIQUES.
1. Le nombre quantique principal n.
n2- Le nombre quantique secondaire ou azimutal l :
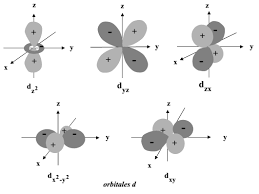
l est le nombre quantique secondaire ou azimutal, il prend toutes les valeurs comprises entre 0 et n--1. l définit la notion de sous couche et détermine la géométrie des orbitales atomiques. ne par une lettre.3- Le nombre quantique magnétique m.
m est le nombre magnétique, il définit la case quantique. m prend toutes les valeurs comprises entre l et +l. - Il y a 2l+1 valeurs de m, donc 2l+1 orbitales. Chaque orbitale atomique est donc caractérisée par une combinaison des trois nombres quantiques n, l et m.4. Le nombre quantique de spin
quantique (noté s) lié à la rotation autour de lui-même. Ce nombre ne peut prendre que deux
valeurs ±1/2.III. LES ORBITALES ATOMIQUES : O.A.
des nombres quantiques n, l, m, ȥn, l, m.ȥpermet de calculer la probabilité
dans un certain volume à la distance r du noyau.Ȍ2 n, l, m
13 1. La condition l=0 implique m=0, Ces ȥn, 0, 0 ȥns e varie avec r.2. Description des orbitales " p »
Les orbitales p (l=1) peuvent être représentées par deux lobes à peu près sphériques,
accolés, ayant pour axes de symétrie les axes x, y et z du trièdre de référence. On les appelle donc " npx», " npy» et " np z». 14Remarque : le signe + ou ȥ
Plan nodal : Les orbitales p possèdent un "plan nodal", dans lequel la probabilité de trouver l'électron est nulle.2. Description des orbitales " d »
ĺ-2, -1, 0, 1, 2 (n = 3)
CHAPITRE IV: LES ATOMES POLYELECTRONIQUES
I. CONFIGURATIONS ELECTRONIQUE DES ATOMES.
15énergétiques définies par les nombres quantiques n,l, m. Chaque orbitale atomique est
représentée par une case quantique, elle peut alors contenir :Une orbitale est définie par les trois nombres n, l et m. Il est commode de représenter les
valeurs possible de m.Le remplissage des orbitales atomiques
3. Dans un atome, deux électrons ne peuvent pas avoir leurs quatre nombres quantiquesquotesdbs_dbs32.pdfusesText_38[PDF] manuel d'échographie pdf
[PDF] ecologie végétale et environnement pdf
[PDF] cours écologie 2éme année biologie
[PDF] cours macroéconomie l1 eco gestion
[PDF] cours de management s1 pdf
[PDF] option sciences économiques secondaire
[PDF] programme sciences économiques
[PDF] le budget des ménages cours
[PDF] cours bts muc 2eme année
[PDF] cours economie bts muc 2ème année
[PDF] cours bts muc management des entreprises
[PDF] économie du sport master
[PDF] sport et développement économique
[PDF] sociologie du sport
