 Chapitre 2 : Réactions doxydoréduction
Chapitre 2 : Réactions doxydoréduction
2.4 Equilibre d'oxydoreduction en milieu basique . le plus simple est de commencer par équilibrer en milieu acide puis de passer en milieu basique ...
 Module 2.4 : Réactions des oxydes avec leau
Module 2.4 : Réactions des oxydes avec leau
Le BBT est jaune en milieu acide vert en milieu neutre et bleu en milieu basique. Un pH de 7 correspond à un milieu neutre
 INCOMPATIBILITES DES MEDICAMENTS: que faut-il savoir?
INCOMPATIBILITES DES MEDICAMENTS: que faut-il savoir?
Un acide est soluble en milieu basique. ? médicament en solution est basique. • Une base est soluble en milieu acide des solutions acides et basiques!
 MÉTHODE POUR ÉQUILIBRER LA DEMI-ÉQUATION DUN
MÉTHODE POUR ÉQUILIBRER LA DEMI-ÉQUATION DUN
demi-équation d'un couple oxydant-réducteur en milieu basique il faut : ? Écrire la demi –équation du couple en milieu acide donc avec des ions (aq).
 Réactivité de la Fonction Alcool
Réactivité de la Fonction Alcool
exactement ce qu'il se passe dans la solution (cf cours acido-basique au S2)) Cependant en milieu très acide l'alcool peut capter un proton
 DIAGRAMMES DEQUILIBRE POTENTIEL-ACIDITE (E-p02 - ) DANS
DIAGRAMMES DEQUILIBRE POTENTIEL-ACIDITE (E-p02 - ) DANS
En milieu basique les oxydes alcalino-terreux sont devenus insolubles
 ADDITIONS NUCLEOPHILES SUIVIES DELIMINATION (AN+E
ADDITIONS NUCLEOPHILES SUIVIES DELIMINATION (AN+E
Les milieux qui conduisent aux hydrolyses des esters et amides. •. Les produits différents selon le milieu acide ou basique. •. La chimiosélectivité possible
 LES GLUCIDES
LES GLUCIDES
En présence d'oxydants puissants en milieu acide et à chaud
 ENOLS ET ENOLATES O H OH Énol O H3C H Base O H3C Énolate
ENOLS ET ENOLATES O H OH Énol O H3C H Base O H3C Énolate
Jan 6 2017 Les réactions en milieu acide se font via la forme énol alors que les réactions en milieu basique se passent via la forme énolate.
 Chapitre 4 Oxydo-réduction
Chapitre 4 Oxydo-réduction
Les réactions d'oxydoréduction en milieu acide ou basique. Exemple de réaction se déroulant en milieu acide : Le peroxyde d'hydrogène H2O2(aq) réagit avec
 Chapitre 4 Oxydo-réduction - ac-montpellierfr
Chapitre 4 Oxydo-réduction - ac-montpellierfr
Les réactions d’oxydoréduction en milieu acide ou basique Exemple de réaction se déroulant en milieu acide : Le peroxyde d’hydrogène H 2 O 2 (aq) réagit avec les ions permanganate MnO4– (aq) pour donner du dioxygène gazeux O 2 (g) et des ions manganèse (II) Mn2+(aq) Couples mis en jeu : ????????????4–(aq) / Mn2+(aq) et O 2 (g
 LES REACTIONS ACIDE-BASE 1 Le pH
LES REACTIONS ACIDE-BASE 1 Le pH
• le point d’équivalence d’un titrage acide-base est souvent indiqué par le changement de couleur d’un indicateur coloré • un indicateur est habituellement un acide ou une base organique faible où la forme acide et la forme basique ont des couleurs différentes •dans un milieu acide la solution prend la couleur de la forme
 Faculté de Médecine Pierre-et-Marie-Curie
Faculté de Médecine Pierre-et-Marie-Curie
milieu acide milieu basique 0 7 14 pH (à 25°C) pH < 1/2 pK milieu neutre e pH > 1/2 pKe pH = 1/2 pKe 2 1 6 2 pH d’un monoacide fort Lorsque l’on dissout dans l’eau un acide fort HA de concentration initiale Co on a : - dissociation totale de l’acide : HA + H2O ? H3O+ + A? à t = 0 Co 0 0 à t = équilibre 0 Co Co
 LES REACTIONS DE PRECIPITATION 1 La solubilité
LES REACTIONS DE PRECIPITATION 1 La solubilité
3 2 2 Solubilité d’un sel acide La solubilité d’un sel acide augmente en milieu basique c’est-à-dire si le pH augmente Exemple : NH 4 Cl = NH 4 + + Cl-(1) En milieu basique (OH-) les ions ammonium NH 4 + sont consommés ils réagissent avec OH-selon la réaction : NH 4 + + OH-= NH 3 + H 2 O (2)
 Searches related to milieu acide milieu basique PDF
Searches related to milieu acide milieu basique PDF
+ (forme stable en milieu acide) Il joue le rôle d’acide avec les bases : COO-NH 3 + R HC + HO-COO-NH 2 R HC + H 2 O AH A-(forme stable en milieu basique) On peut donc définir les deux couples acide-base : - AH 2 +/AH pK a1 - AH /A-pK a2 D’où le diagramme de prédominance suivant : b) Point isoélectrique
Comment calculer la demi-équation acido-basique associée ?
La demi-équation acido-basique associée est : CH3COOH = CH3COO? + H+ 2.3 Couples acide/base de l’eau L’eau participe à deux couples acide/base dans lesquels elle joue soit le rôle d’acide soit le rôle de base. Ce sont les couples : H2O/HO? et H3O+/H2O Les demi-équations associées sont :
Quelle est la différence entre acide aminé et acide basique ?
Un acide aminé est dit neutre quand son pHi est compris entre 5 et 6. Il est dit acide quand son pHi est inférieur ou égal à 3. Il est dit basique quand son pHi est supérieur à 7. 4.4.3 L’acide phosphorique L'acide phosphorique H3PO4 est un triacide. On peut donc définir trois couples acide-base :
Quelle est la forme moléculaire des acides aminés ?
Définition Les acides aminés sont des composés qui possèdent à la fois une fonction acide carboxylique COOH et une fonction amine NH2. La forme moléculaire notée AH des acides aminés est : HCCOOHNH2
Comment fonctionne une réaction acido-basique ?
Une réaction acido-basique fait intervenir deux couples acide/base. L’acide d’un couple libère un proton H+ pour le céder à la base de l’autre couple. C’est un transfert de proton H+.
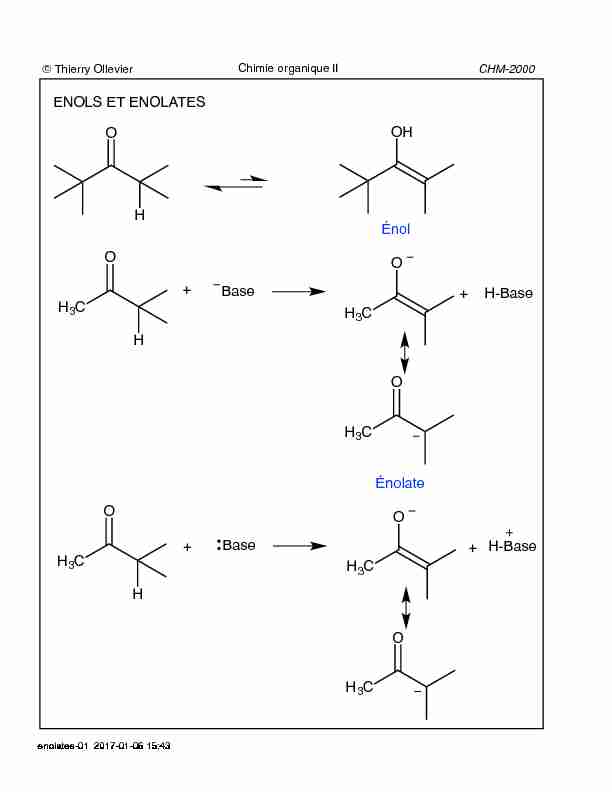
© Thierry OllevierCHM-2000Chimie organique IIENOLS ET ENOLATESOHOHÉnolOH3CHBaseOH3CÉnolateH-BaseOH3CHBaseOH3CH-Base++++OH3COH3Cenolates-01 2017-01-06 15:43
© Thierry OllevierCHM-2000Chimie organique IISchéma général de la déprotonation d'un composé carbonyléÉnolateOHBaseOH-Base++OOstabilisation de l'anionpar résonanceCCOHCHpKa 19-21pKa 40-50L'hydrogène en α (H) est anormalement acide car l'anion qui résulte de la déprotonation est très bien stabilisé !L'hydrogène en β (H) n'est pas acide.enolates-02 2017-01-06 15:45
© Thierry OllevierCHM-2000Chimie organique IIOCH3CH3BaseOH3CCH2énolateH-Base+pKa = 19-21cétoneLes protons en position α du carbonyle sont "acides".ROROOHHHHHHpKa = 19-21pKa = 25OH3CCH2-OCH3OCH3BaseOCH3OCH2énolateH-Base+pKa = 25esterOCH3OCH2-RROOROROOROOROOpKa = 9pKa = 11pKa = 13HHHHHHenolates-03 2017-01-06 15:45
© Thierry OllevierCHM-2000Chimie organique IIOH2CHProblème (solution)ProblèmeαOHH3COOOIdentifiez les hydrogènes les plus acides dans chacune des molécules suivantes. Donnez la structure de l'ion énolate qui résulte de la déprotonation. a) acétaldéhyde, b) propanal, c) propanone, d) heptan-4-one, e) cyclopentanone.OHa)OH3CHCHOH2COH3CH2CHCO- H+- H+- H+- H+- H+enolates-04 2017-01-06 15:46
© Thierry OllevierCHM-2000Chimie organique IILes énols et les énolates sont des nucléophiles qui peuvent réagir avec des électrophiles.Un énol est moins nucléophile qu'un énolate car il ne contient pas de charge négative :OHHHOHHOHEHOHEHHHE+-H+OHHHOHHOHEHE+dépend de la baseutiliséeLes réactions en milieu acide se font via la forme énol alors que les réactions en milieu basique se passent via la forme énolate.tautomèresTautomères céto et énolOOH> 99 %< 1 %très faible % de forme énol à l'équilibreenolates-05 2017-01-06 15:46
© Thierry OllevierCHM-2000Chimie organique IIPréparation d'un énolateOONi-Pri-PrLiHHHHHNi-Pri-Pr+THFLi+LDAOOion énolate de la cyclohexanoneComportement ambident de l'énolateOCH2CHCH2ClH+OHOC-alkylationO-protonationtautomérisationLa nature de l'électrophile peut être très variable : un halogénure d'alkyle (C-alkylation), un proton (O-protonation).enolates-06 2017-01-06 15:47
© Thierry OllevierCHM-2000Chimie organique IIRacémisationIsomérisationOOOKKOHCH3CH2OHIsomérisation du dérivé cis en dérivé trans (plus stable) via la forme énolate.CH3OH3CHPh(S)-3-phénylbutan-2-oneCH3OHH3CPh(R)-3-phénylbutan-2-oneEtOHEtOHachiralPhCH3CH3Oconséquence : une solution d'un énantiomère pur (R ou S) dans un mélange EtO-/EtOH conduira au mélange racémique du composéCH3OH3CHPhEtOHCH3OH3CHPhCH3OHH3CPh(S)(S)(R)+molécule chiralesous forme d'un seul énantiomèremolécule chirale en mélange racémique50 %50 %EtOEtOEtOenolates-07 2017-01-06 15:47
© Thierry OllevierCHM-2000Chimie organique IIMécanisme de l'isomérisationOHOcétone chiraleOHénolate achiralénol achiralα Catalyse basiqueα Catalyse acideOHcétone chiraleOHénol achiralOHOHHOHHOHHHOHH- OH- H3OPrincipe de l'isomérisation : on perd la chiralité via la formationd'un énol ou d'un énolate.enolates-08 2017-01-06 15:48
© Thierry OllevierCHM-2000Chimie organique IIRéactions des énols et des énolates1) Échange des H acides par des D (deutérium)CCH3OH3CH3CCH3D2O (excès)DCl(source de D+)CCD3OH3CH3CCH3via énol (milieu acide)CCH3OH3CH3CCH3D2O (excès)NaOD(source de OD-)CCD3OH3CH3CCH3via énolate (milieu basique)α Milieu acideenolates-09 2017-01-06 15:48
© Thierry OllevierCHM-2000Chimie organique II1) Échange des H acides par des D (deutérium) (suite)CCH3OH3CH3CCH3D2O (excès)NaOD(source de OD-)CCD3OH3CH3CCH3via énolate (milieu basique)α Milieu basiqueCCOH3CH3CCH3CCOH3CH3CCH3HHCCOH3CH3CCH3HHDon répète cette séquencedeux autres foispour obtenir le produitHHHODODDCCD3OH3CH3CCH3Problème 17.2 (S)☞Problème 17.3 (S)☞- OD- HODenolates-10 2017-01-06 15:48
© Thierry OllevierCHM-2000Chimie organique IICCH3OH3CH3CCH3Br2 (1 équiv.)CCH2BrOH3CH3CCH3via énol (milieu acide)CCH3OH3CH3CCH3Br2 (1 équiv.)CCBr3OH3CH3CCH3via énolate (milieu basique)2) HalogénationCH3CO2HNaOH33 % (+ 66 % de méthylcétone)CCH3OH3CH3CCH3Br2 (3 équiv.)CCBr3OH3CH3CCH3via énolate (milieu basique)NaOH100 %En milieu acide, la réaction s'arrête généralement à la mono-halogénation.En milieu basique, il est difficile de s'arrêter à la mono-halogénation.enolates-11 2017-01-06 15:49
© Thierry OllevierCHM-2000Chimie organique IIα Milieu acideHCCH3OH3CH3CCH3CCOH3CH3CCH3HHHHCCOH3CH3CCH3HHHCCOH3CH3CCH3HHBr2) Halogénation (suite)BrBrHL'étape initiale de l'halogénation en milieu acide est l'énolisation.L'énolisation du dérivé mono-bromé par protonation du carbonyle sera plus difficile (à cause de l'effet électroattracteur du brome) que l'énolisation du produit de départ non bromé. Il y a donc un ralentissement de l'halogénation après que le premier halogènea été introduit. On s'arrête donc généralement à la mono-halogénation.ExempleOBrOBrBrBr2CH3CO2H72 %- HBr- H+enolates-12 2017-01-06 15:49
© Thierry OllevierCHM-2000Chimie organique IIα Milieu basiqueCCOH3CH3CCH3CCOH3CH3CCH3HCCOH3CH3CCH3Br2) Halogénation (suite)BrBrOHHb est plus acide que Ha ; l'énolate du produit mono-bromé va doncse former plus facilement que l'énolate du produit non-bromé.La poly-bromation va donc se produire avant que toute la méthylcétone ne soit convertie en produit mono-bromé (voir pourcentages) !HaHHH- HaOHHbHCCOH3CH3CCH3BrBrHCCOH3CH3CCH3BrBrBrenolates-13 2017-01-06 15:50
© Thierry OllevierCHM-2000Chimie organique II2) Halogénation (suite)CCH3OH3CH3CCH3Br2 (3 équiv.)CCBr3OH3CH3CCH3via énolate (milieu basique)NaOHIntérêt de ces trihalogénocétones ?Réaction à l'haloformeCCBr3OH3CH3CCH31) OH-2) H3O+COHOH3CH3CCH3HCBr3+MécanismeCCBr3OH3CH3CCH3OHαenolates-14 2017-01-06 15:50
© Thierry OllevierCHM-2000Chimie organique IIRéaction à l'haloforme (suite)CH3O1) I2, NaOH2) H3O+HCI3+OHOIllustrationviaCI3O= Conversion d'une méthylcétone en acide carboxylique (!C=-1).Problèmes complémentaires☞1)OCH31) Br2, OH-, H2O2) H3O+?2)CH3O1) Cl2, OH-, H2O2) H3O+?enolates-15 2017-01-06 15:50
© Thierry OllevierCHM-2000Chimie organique IIRéponses aux problèmes complémentaires1)OCH31) Br2, OH-, H2O2) H3O+2)1) Cl2, OH-, H2O2) H3O+OOHOHOviaOCBr3CH3OviaCCl3OProblème 17.2 (S)αProblème 17.3 (S)αProblème 17.4 (S)αProblème 17.5 (S)αenolates-16 2017-01-06 15:51
© Thierry OllevierCHM-2000Chimie organique IIRéactions des énols et des énolates3) Réactions d'alkylation des énolatesCCH3OH3CH3CCH3CCH2OH3CH3CCH3Électrophiles : halogénures d'alkyles primaires et secondaires (SN2)Nucléophiles : énolates (énols pas assez nucléophiles)Les énolates doivent être préformés quantitativement avec une base forte.ExemplesNaOHNa++H2OpKa = 19pKa = 15,7NaOH ne sera donc pas utilisé dans une réaction d'alkylation (NaOH n'estpas une base assez forte pour générer l'énolate quantitativement).NaOH peut en outre réagir avec l'halogénure d'alkyle !SolutionNi-Pri-PrLiHNi-Pri-Pr+LDACCH3OH3CH3CCH3CCH2OH3CH3CCH3+pKa = 19pKa = 35LiTHFCCOH3CH3CCH3HHCH3CH3Ienolates-17 2017-01-06 15:51
© Thierry OllevierCHM-2000Chimie organique IIFormation régiosélective des énolatesOHH3CHHOHHOHH3CH3CHBénolatecinétiqueénolatethermodynamiqueénolate cinétique- énolate le moins stable (double liaison la moins substituée)- énolate formé en arrachant le proton le moins encombré (se forme généralement plus rapidement)OHH3CHHOHH3CHBénolate thermodynamique- énolate le plus stable (double liaison la plus substituée)- énolate formé en arrachant le proton le plus encombréOHH3CHHOHHH3CBbase typique :base faible dans solvant protique (MeONa/MeOH)base typique :base forte dans solvant aprotique (LDA/THF)enolates-18 2017-01-06 15:52
© Thierry OllevierCHM-2000Chimie organique IIénolate cinétique- l'hydrogène arraché est le moins encombré stériquement- l'énolate cinétique sera formé majoritairement quand la réaction est "cinétiquement controlée"énolate thermodynamique- l'hydrogène arraché est le plus encombré stériquement- l'énolate thermodynamique sera formé majoritairement quand les conditions équilibrantes conduisent à l'énolate le plus substituéExemplesOHH3CHHOHH3CHLDA, 0°C (conditions cinétiques)99 %1 %Et3N (conditions thermodynamiques)22 %78 %OHHH3COHH3CHHOHH3CH1) LDA2) CH3ILiOHH3CHCH3viaH3CIenolates-19 2017-01-06 15:52
© Thierry OllevierCHM-2000Chimie organique IIExemplesOO1) LDA2)BrOOPhO1) NaH, benzène, α2)BrPhOPhOOPhO1) LDA2)BrBuPhOOPhOBuOBrLDAétherOenolates-20 2017-01-06 15:52
quotesdbs_dbs33.pdfusesText_39[PDF] oxydoréduction en milieu basique cours
[PDF] mno4- mno2 milieu basique
[PDF] oxydoréduction en milieu basique exercice
[PDF] oxydoreduction exercice corrigé
[PDF] oxydoréduction cours
[PDF] exercices oxydoréduction 1s
[PDF] projet eps nouveaux programmes
[PDF] exemple projet eps college 2016
[PDF] projet eps 2017
[PDF] projet eps 2016-2017
[PDF] projet pédagogique eps collège 2016
[PDF] projet pédagogique eps collège
[PDF] projet eps collège 2016
[PDF] exercice perimetre 6eme
