 TP 21 : Dosage du glucose
TP 21 : Dosage du glucose
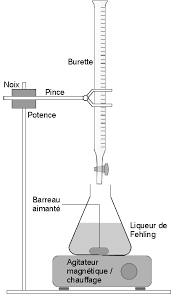
TP 21 : Dosage du glucose. I- Principe. Le glucose réagit à chaud avec la liqueur de Fehling. La transformation est visualisée par un changement de couleur
 TP : Détermination de la concentration en glucose dune boisson de
TP : Détermination de la concentration en glucose dune boisson de
C- DOSAGE A L'AIDE D'UN SPECTROPHOTOMETRE. Il faut travailler en plusieurs étapes. ☞ Réglage du zéro. Pour que la diminution de l'intensité lumineuse ne
 DOSAGE DU GLUCOSE EN SOLUTION PAR
DOSAGE DU GLUCOSE EN SOLUTION PAR
TP de Biochimie. 1. DOSAGE DU GLUCOSE EN SOLUTION PAR. SPECTROPHOTOMETRIE. 1. Présenter le but et le principe de la réaction. (Vous présenterez notamment les
 TP Paquot
TP Paquot
dosage des sucres de l'échantillon inconnu ainsi que sur la préparation d'une solution de standard et d'une solution test de glucose. Ils seront également ...
 RAPPORT DE STAGE
RAPPORT DE STAGE
b- Les concentrations du TP. Dans ce TP il est proposé d'utiliser : ✗ Une solution de glucose à doser. ✗ De l'iode à environ 0
 dosage des sucres réducteurs: méthode de Fehling
dosage des sucres réducteurs: méthode de Fehling
On peut aussi acheter la solution 1 et la solution 2 et préparer la liqueur de. Fehling au moment du TP. Equations. Le sulfate de cuivre attaqué par la solution
 I. PROTOCOLE OPERATOIRE II. SECURITE
I. PROTOCOLE OPERATOIRE II. SECURITE
TP BIOCHIMIE N°06. DOSAGE ENZYMATIQUE DU GLUCOSE SERIQUE EN POINT FINAL : Respecter les précautions liées à la manipulation de sérum humain. Page 2. T STL. TP ...
 Dosage des glucides présents dans un jus de fruit
Dosage des glucides présents dans un jus de fruit
(TP enseignant). Objectif : on se propose de déterminer la concentration en Déterminer la concentration en glucose libre du jus d'orange. Déterminer la ...
 On cherche à mesurer la glycémie en utilisant lenzyme GOD
On cherche à mesurer la glycémie en utilisant lenzyme GOD
TP Dosage de la glycémie à l'aide d'une enzyme. Objectifs de la séance 1- Sélectionner un intervalle de temps de 30s à partir de l'injection de la glucose ...
 TP 21 : Dosage du glucose
TP 21 : Dosage du glucose
TP 21 : Dosage du glucose. I- Principe. Le glucose réagit à chaud avec la liqueur de Fehling. solution S de glucose de concentration 20 x 10-2 mol.L-1.
 DOSAGE DU GLUCOSE PAR LA METHODE DE BERTRAND
DOSAGE DU GLUCOSE PAR LA METHODE DE BERTRAND
TP BIOCHIMIE N°05. 1. DOSAGE DU GLUCOSE. PAR LA METHODE DE BERTRAND. I. PROTOCOLE OPERATOIRE. 1. Etalonnage de la solution de KMnO4 par pesée d'oxalate de
 TP de Méthodes Spectrales
TP de Méthodes Spectrales
1 mars 2018 Dosage du glucose par la méthode de Trinder (spectrophotométrie indirecte)… Dosage des protéines totales par la méthode du biuret…
 Dosage dun analyte S par méthode enzymatique en phase
Dosage dun analyte S par méthode enzymatique en phase
et [S]échantillon à doser = Ns dans le volume essai E / E. 2. Cas de la mesure d'une concentration en glucose par méthode à la glucose oxydase. On va
 TP Chimie N° 7 Spécialité Dosage des sucres dun jus de fruit
TP Chimie N° 7 Spécialité Dosage des sucres dun jus de fruit
- Première étape : oxydation du glucose. Verser le prélèvement S dans un erlenmeyer ajouter un volume V2 = 20 mL de la solution de diiode de
 DOSAGE DU GLUCOSE EN SOLUTION PAR
DOSAGE DU GLUCOSE EN SOLUTION PAR
BTS Diététique. Glucide. TP de Biochimie. 1. DOSAGE DU GLUCOSE EN SOLUTION PAR. SPECTROPHOTOMETRIE. 1. Présenter le but et le principe de la réaction.
 TRAVAUX PRATIQUES de BIOCHIMIE
TRAVAUX PRATIQUES de BIOCHIMIE
TP BIOCHIMIE : Cours et TD. Page 2/23 Le principe de base d'un dosage enzymatique consiste à suivre la production ou la ... glucose dans un sérum.
 dosage des sucres réducteurs: méthode de Fehling
dosage des sucres réducteurs: méthode de Fehling
TP enseignant : à rédiger pour un TP élève. 1/3. Dosage des sucres réducteurs : filtrer titrer avec une solution de glucose (sucres réducteurs) à 5 ...
 TP 21 : Dosage du glucose par comparaison dans une boisson pour
TP 21 : Dosage du glucose par comparaison dans une boisson pour
Contrairement aux sodas classiques qui utilisent du saccharose (comme les sucres en morceau) et du fructose (le sucre présent dans les fruits).
 AT17 DOSAGE ENZYMATIQUE DU GLUCOSE
AT17 DOSAGE ENZYMATIQUE DU GLUCOSE
Dans le dosage du glucose par la GOD on peut dire : I- Le Principe (réactions biochimiques). Que la réaction principale est ? :.
 [PDF] TP 21 : Dosage du glucose
[PDF] TP 21 : Dosage du glucose
TP 21 : Dosage du glucose I- Principe Le glucose réagit à chaud avec la liqueur de Fehling La transformation est visualisée par un changement de couleur
 [PDF] DOSAGE DU GLUCOSE EN SOLUTION PAR
[PDF] DOSAGE DU GLUCOSE EN SOLUTION PAR
BTS Diététique Glucide TP de Biochimie 1 DOSAGE DU GLUCOSE EN SOLUTION PAR SPECTROPHOTOMETRIE 1 Présenter le but et le principe de la réaction
 [PDF] Kit dosage du glucose à la Glucose Oxydase / Peroxydase Réf GOD
[PDF] Kit dosage du glucose à la Glucose Oxydase / Peroxydase Réf GOD
- Préparer une solution mère de glucose à 0 5g/L (10 ml par binôme) MANIPULATION Réaliser la réaction enzymatique de dosage à la Glucose Oxydase / Peroxydase
 [PDF] DOSAGE DU GLUCOSE PAR LA METHODE DE BERTRAND
[PDF] DOSAGE DU GLUCOSE PAR LA METHODE DE BERTRAND
TP BIOCHIMIE N°05 1 DOSAGE DU GLUCOSE PAR LA METHODE DE BERTRAND I PROTOCOLE OPERATOIRE 1 Etalonnage de la solution de KMnO4 par pesée d'oxalate de
 TP 2 Dosage Du Glucose Dans Le Sang PDF - Scribd
TP 2 Dosage Du Glucose Dans Le Sang PDF - Scribd
Mettre en œuvre une technique expérimentale de dosage du glucose dans le sang à la glucose oxydase/peroxydase II- Principe du TP La glucose oxydase (GOD)
 Dosage Glucose PDF Concentration molaire - Scribd
Dosage Glucose PDF Concentration molaire - Scribd
TP – Ch 01 Dosage du glucose dans une boisson Objectifs : - Utilisation d'une pipette et d'une propipette - Réalisation d'une solution diluée
 [PDF] TP : Détermination de la concentration en glucose dune boisson de
[PDF] TP : Détermination de la concentration en glucose dune boisson de
TP : Détermination de la concentration en glucose d'une boisson de réhydratation Deuxième Partie Rappel : Lorsque l'on chauffe un mélange d'une solution
 [PDF] tp de chimie biologique 2ème - ORBi
[PDF] tp de chimie biologique 2ème - ORBi
Les étudiants seront contrôlés sur le dosage des sucres de l'échantillon le glucose 1000 ppm pour le fructose 2000 ppm pour le saccharose et 2000 ppm
 [PDF] polycopie-tp-s3-biochimie-structuralepdf - takweencom
[PDF] polycopie-tp-s3-biochimie-structuralepdf - takweencom
Poids moléculaire du glucose = 180156 signifie : 1 mole de glucose pèse 180156 g Exemple : TP dosage des protéines : voir réaction de Biuret
 [PDF] Dosage des glucides présents dans un jus de fruit - Sites ENSFEA
[PDF] Dosage des glucides présents dans un jus de fruit - Sites ENSFEA
Dosage des glucides présents dans un jus de fruit (TP enseignant) Objectif : on se propose de déterminer la concentration en saccharose glucose
T STL TP BIOCHIMIE N°05
1DOSAGE DU GLUCOSE
PAR LA METHODE DE BERTRAND
I. PROTOCOLE OPERATOIRE
1. Etalonnage de la solution de KMnO4
- Remplir la burette de solution de permanganate de potassium. - Dissoudre moxalate de sodium (nécessaire pour avoir une chute de burette proche de 15 mL) d - A sulfurique à 2,2 mol.L-1. - Chauffer la f favoriser la réaction rédox. - Verser à la burette la solution de permanganate en agitant constamment. La fin du dosage est repérée par une coloration rose persistante 30 secondes.Recommencer ltalonnage .
2. a) Réduction de la solution cuivrique (Cu2+) par la solution de glucose Dans une fiole erlenmeyer de 250 mL propre (lavée avec HCl dilué et rincée soigneusement), placer : - Environ 20 mL de la solution cuivrique : liqueur de Fehling A. - Environ 20 mL de la solution tartro-sodique : liqueur de Fehling B. - E = 10,0 mL de la solution de glucose à doser. - V = 10 . - Une ou deux pierres ponce afin de régu projections. - ébullition douce pendant3 minutes exactement.
Remarque :
- Laisser refroidir le mélange en maintenant la fiole inclinée pour décanter (déposer) le précipité . - 20 mL de la solution cuivrique (Fehling A) - 20 mL de la solution tartro-sodique (Fehling B) - E = 10 mL de glucose à doser - 10 mL H2O - pierres ponce Chauffer 3 min exactement à ébullition douceT STL TP BIOCHIMIE N°05
2 Remarque : le surnageant doit être franchement bleu indiquant que le Cu2+ est en excès. Dans le cas contraire, recommencer dilution de la solution à doser. b) - Verser le s . Prendre soin e et de ne jamais le laisser en liquide (Erlen incliné). - Faire une légère aspiration pour faire passer le liquide versé précédemment particules de précipité éventuellement passées prématurément sur le filtre. - minimum de surnageant e précipité et laisser décanter le précipité, fiole inclinée. - Verser à nouveau le surnageant de la fiole rlenmeyer sur le filtre selon la technique décrite précédemment et recommencer le lavage au moins 6 fois liminer toute trace de tartrate. - A la fin du lavage, on obtient : toujours débrancher ici avant de fermer le robinet (sinon ne jamais (sec) trompe à eau (création du vide) faire passer le surnageant (bleu) pour ne garder que le précipité de Cu2 minimum2O possible
Attention : Ne jamais laisser le précipité de Cu2 l liquide précipité rouge de Cu2O1 cm de liquide
T STL TP BIOCHIMIE N°05
3 c) Oxydation du précipité de Cu2O par une solution ferrique (Fe3+) - Vider la fiole à vide, la rincer soigneusement et replacer le filtre. - Verser 10 mL de solution ferrique sur le précipité (resté dans la fiole rlenmeye précipité. La solution devient verte (présence de fer II). - Verser cette solution sur le filtre en veillant à dissoudre les particules de précipité qui se trouveraient sur celui-ci. Faire passer lentement le liquide dans la fiole à vide. - Rincer la fiole erlenmeyer avec 2 x 10 mL de solution ferrique, transvaser sur le filtre et faire passer lentement. - re passer les eaux de rinçage sur le filtre. d) Dosage du fer ferreux formé (Fe2+) par manganimétrie - Effectuer le dosage des ions fer II formés, directement dans la fiole à vide à solution de permanganate de potassium étalonnée la semaine précédente. le volume équivalent.Recommencer le dosage avec une nouvelle
glucose.II. SECURITE
produits Identification du dangerSolution de KMnO4 à
Acide sulfurique à 2,2 mol.L-1
Liqueur de Fehling B portée à
ébullition
10 mL de
solution Fe3+ complète du précipité Cu2O couleur verteFiltrer lentement
contenu de la fiole est précieux et sera dosé par KMnO4T STL TP BIOCHIMIE N°05
4Eau distillée bouillie
III. COMPTE-RENDU
1. Etalonnage de la solution de KMnO4
a) Quels sont les précautions à adopter ? b) Donner le principe (avec les équations). Quel est le rôle de c) Réaliser un schéma de la manipulation en indiquant les données de départ. d) e) f) Etablir la formule littérale permettant de calculer CKMnO4. g) Réaliser un tableau de résultats selon le modèle suivant : Essai m oxalate de sodium (en g) V MnO4- (en mL) CMnO4- (en mol.L-1) 1 2 h) Calculer CKMnO4 (sr = 2.10-4 mol.L-1).2. Dosage de la solution de glucose inconnue par la méthode de
Bertrand
a) Quels sont les précautions à adopter ? b) Rappeler la concentration de la solution de KMnO4 étalonnée. Noter les volumes V1 et V2 de KMnO4 versé. Calculer le volume moyen Vm.Utilisation de la table de Bertrand
c) A partir du volume Vm de KMnO4, calculer la masse de cuivre en mg ayant réagit (MCu = 63,54 g.mol-1). d) En déduire la masse de glucose table de Bertrand. e) Calculer la concentration massique puis molaire de la solution de glucose inconnue (Mglucose = 180 g.L-1).Utilisation de la table de
f) Calculer le volume de permanganate à 0,02 mol.L-1 (= VKMnO4 de la table) correspondant à Vm. g) h) Calculer la concentration massique puis molaire de la solution de glucose inconnue (Mglucose = 180 g.L-1). i) Conclure en comparant la concordance des résultats obtenus à partir des 2 tables.quotesdbs_dbs35.pdfusesText_40[PDF] tp dosage de la vitamine c dans un comprimé
[PDF] dosage de la vitamine c dans un comprimé corrigé
[PDF] dosage en retour exercice corrigé
[PDF] dosage vitamine c jus d'orange
[PDF] dosage en retour de la vitamine c
[PDF] dosage vitamine c dcpip
[PDF] dosage indirect définition
[PDF] dosage indirect vitamine c
[PDF] dosage indirect de l'eau de javel
[PDF] tp conductivité des électrolytes et dosage conductimétrique
[PDF] dosage conductimétrique principe
[PDF] tp conductivité dune solution
[PDF] conductivité d'une solution en fonction de la concentration en tensioactifs
[PDF] concentration micellaire critique conductivité
