 TP 21 : Dosage du glucose
TP 21 : Dosage du glucose
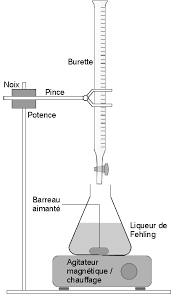
TP 21 : Dosage du glucose. I- Principe. Le glucose réagit à chaud avec la liqueur de Fehling. La transformation est visualisée par un changement de couleur
 TP : Détermination de la concentration en glucose dune boisson de
TP : Détermination de la concentration en glucose dune boisson de
C- DOSAGE A L'AIDE D'UN SPECTROPHOTOMETRE. Il faut travailler en plusieurs étapes. ☞ Réglage du zéro. Pour que la diminution de l'intensité lumineuse ne
 DOSAGE DU GLUCOSE PAR LA METHODE DE BERTRAND
DOSAGE DU GLUCOSE PAR LA METHODE DE BERTRAND
TP BIOCHIMIE N°05. 1. DOSAGE DU GLUCOSE. PAR LA METHODE DE BERTRAND. I. PROTOCOLE OPERATOIRE. 1. Etalonnage de la solution de KMnO4 par pesée d'oxalate de
 DOSAGE DU GLUCOSE EN SOLUTION PAR
DOSAGE DU GLUCOSE EN SOLUTION PAR
TP de Biochimie. 1. DOSAGE DU GLUCOSE EN SOLUTION PAR. SPECTROPHOTOMETRIE. 1. Présenter le but et le principe de la réaction. (Vous présenterez notamment les
 TP Paquot
TP Paquot
dosage des sucres de l'échantillon inconnu ainsi que sur la préparation d'une solution de standard et d'une solution test de glucose. Ils seront également ...
 RAPPORT DE STAGE
RAPPORT DE STAGE
b- Les concentrations du TP. Dans ce TP il est proposé d'utiliser : ✗ Une solution de glucose à doser. ✗ De l'iode à environ 0
 dosage des sucres réducteurs: méthode de Fehling
dosage des sucres réducteurs: méthode de Fehling
On peut aussi acheter la solution 1 et la solution 2 et préparer la liqueur de. Fehling au moment du TP. Equations. Le sulfate de cuivre attaqué par la solution
 I. PROTOCOLE OPERATOIRE II. SECURITE
I. PROTOCOLE OPERATOIRE II. SECURITE
TP BIOCHIMIE N°06. DOSAGE ENZYMATIQUE DU GLUCOSE SERIQUE EN POINT FINAL : Respecter les précautions liées à la manipulation de sérum humain. Page 2. T STL. TP ...
 Dosage des glucides présents dans un jus de fruit
Dosage des glucides présents dans un jus de fruit
(TP enseignant). Objectif : on se propose de déterminer la concentration en Déterminer la concentration en glucose libre du jus d'orange. Déterminer la ...
 On cherche à mesurer la glycémie en utilisant lenzyme GOD
On cherche à mesurer la glycémie en utilisant lenzyme GOD
TP Dosage de la glycémie à l'aide d'une enzyme. Objectifs de la séance 1- Sélectionner un intervalle de temps de 30s à partir de l'injection de la glucose ...
 TP 21 : Dosage du glucose
TP 21 : Dosage du glucose
TP 21 : Dosage du glucose. I- Principe. Le glucose réagit à chaud avec la liqueur de Fehling. solution S de glucose de concentration 20 x 10-2 mol.L-1.
 DOSAGE DU GLUCOSE PAR LA METHODE DE BERTRAND
DOSAGE DU GLUCOSE PAR LA METHODE DE BERTRAND
TP BIOCHIMIE N°05. 1. DOSAGE DU GLUCOSE. PAR LA METHODE DE BERTRAND. I. PROTOCOLE OPERATOIRE. 1. Etalonnage de la solution de KMnO4 par pesée d'oxalate de
 TP de Méthodes Spectrales
TP de Méthodes Spectrales
1 mars 2018 Dosage du glucose par la méthode de Trinder (spectrophotométrie indirecte)… Dosage des protéines totales par la méthode du biuret…
 Dosage dun analyte S par méthode enzymatique en phase
Dosage dun analyte S par méthode enzymatique en phase
et [S]échantillon à doser = Ns dans le volume essai E / E. 2. Cas de la mesure d'une concentration en glucose par méthode à la glucose oxydase. On va
 TP Chimie N° 7 Spécialité Dosage des sucres dun jus de fruit
TP Chimie N° 7 Spécialité Dosage des sucres dun jus de fruit
- Première étape : oxydation du glucose. Verser le prélèvement S dans un erlenmeyer ajouter un volume V2 = 20 mL de la solution de diiode de
 DOSAGE DU GLUCOSE EN SOLUTION PAR
DOSAGE DU GLUCOSE EN SOLUTION PAR
BTS Diététique. Glucide. TP de Biochimie. 1. DOSAGE DU GLUCOSE EN SOLUTION PAR. SPECTROPHOTOMETRIE. 1. Présenter le but et le principe de la réaction.
 TRAVAUX PRATIQUES de BIOCHIMIE
TRAVAUX PRATIQUES de BIOCHIMIE
TP BIOCHIMIE : Cours et TD. Page 2/23 Le principe de base d'un dosage enzymatique consiste à suivre la production ou la ... glucose dans un sérum.
 dosage des sucres réducteurs: méthode de Fehling
dosage des sucres réducteurs: méthode de Fehling
TP enseignant : à rédiger pour un TP élève. 1/3. Dosage des sucres réducteurs : filtrer titrer avec une solution de glucose (sucres réducteurs) à 5 ...
 TP 21 : Dosage du glucose par comparaison dans une boisson pour
TP 21 : Dosage du glucose par comparaison dans une boisson pour
Contrairement aux sodas classiques qui utilisent du saccharose (comme les sucres en morceau) et du fructose (le sucre présent dans les fruits).
 AT17 DOSAGE ENZYMATIQUE DU GLUCOSE
AT17 DOSAGE ENZYMATIQUE DU GLUCOSE
Dans le dosage du glucose par la GOD on peut dire : I- Le Principe (réactions biochimiques). Que la réaction principale est ? :.
 [PDF] TP 21 : Dosage du glucose
[PDF] TP 21 : Dosage du glucose
TP 21 : Dosage du glucose I- Principe Le glucose réagit à chaud avec la liqueur de Fehling La transformation est visualisée par un changement de couleur
 [PDF] DOSAGE DU GLUCOSE EN SOLUTION PAR
[PDF] DOSAGE DU GLUCOSE EN SOLUTION PAR
BTS Diététique Glucide TP de Biochimie 1 DOSAGE DU GLUCOSE EN SOLUTION PAR SPECTROPHOTOMETRIE 1 Présenter le but et le principe de la réaction
 [PDF] Kit dosage du glucose à la Glucose Oxydase / Peroxydase Réf GOD
[PDF] Kit dosage du glucose à la Glucose Oxydase / Peroxydase Réf GOD
- Préparer une solution mère de glucose à 0 5g/L (10 ml par binôme) MANIPULATION Réaliser la réaction enzymatique de dosage à la Glucose Oxydase / Peroxydase
 [PDF] DOSAGE DU GLUCOSE PAR LA METHODE DE BERTRAND
[PDF] DOSAGE DU GLUCOSE PAR LA METHODE DE BERTRAND
TP BIOCHIMIE N°05 1 DOSAGE DU GLUCOSE PAR LA METHODE DE BERTRAND I PROTOCOLE OPERATOIRE 1 Etalonnage de la solution de KMnO4 par pesée d'oxalate de
 TP 2 Dosage Du Glucose Dans Le Sang PDF - Scribd
TP 2 Dosage Du Glucose Dans Le Sang PDF - Scribd
Mettre en œuvre une technique expérimentale de dosage du glucose dans le sang à la glucose oxydase/peroxydase II- Principe du TP La glucose oxydase (GOD)
 Dosage Glucose PDF Concentration molaire - Scribd
Dosage Glucose PDF Concentration molaire - Scribd
TP – Ch 01 Dosage du glucose dans une boisson Objectifs : - Utilisation d'une pipette et d'une propipette - Réalisation d'une solution diluée
 [PDF] TP : Détermination de la concentration en glucose dune boisson de
[PDF] TP : Détermination de la concentration en glucose dune boisson de
TP : Détermination de la concentration en glucose d'une boisson de réhydratation Deuxième Partie Rappel : Lorsque l'on chauffe un mélange d'une solution
 [PDF] tp de chimie biologique 2ème - ORBi
[PDF] tp de chimie biologique 2ème - ORBi
Les étudiants seront contrôlés sur le dosage des sucres de l'échantillon le glucose 1000 ppm pour le fructose 2000 ppm pour le saccharose et 2000 ppm
 [PDF] polycopie-tp-s3-biochimie-structuralepdf - takweencom
[PDF] polycopie-tp-s3-biochimie-structuralepdf - takweencom
Poids moléculaire du glucose = 180156 signifie : 1 mole de glucose pèse 180156 g Exemple : TP dosage des protéines : voir réaction de Biuret
 [PDF] Dosage des glucides présents dans un jus de fruit - Sites ENSFEA
[PDF] Dosage des glucides présents dans un jus de fruit - Sites ENSFEA
Dosage des glucides présents dans un jus de fruit (TP enseignant) Objectif : on se propose de déterminer la concentration en saccharose glucose
Université Mohamed Boudiaf-M'sila
Faculté des Sciences
Département de Microbiologie & Biochimie
Polycopié de Travaux Pratiques
TP de Méthodes Spectrales
Polycopié destiné aux Etudiants en 3ième Année Licence en BiochimieChargé de TP : Dr. RÉGGAMI Yassine
Année universitaire : 2017-2018
Semestre : 6
Unité d'enseignement Fondamentale 2 (UEM 3.2): Techniques biochimiques et méthodes spectralesMatière 2: Méthodes spectrales
Crédits : 6
Coefficient : 3
Objectifs de l'enseignement
Connaitre les différentes méthodes spectrales et leurs applications en analyse biochimique. Mode d'évaluation : Contrôle continu, Exposés, Posters, Interrogations, Compte rendu deTP, examen de TD et de TP.
SOMMAIRE
TP n° 0 :
TP n° 1 :
TP n° 2 :
TP n° 3 :
TP n° 4 :
TP n° 5 :
TP n° 6 :
Consignes de sécurité et matériel de laboratoire...................................... Dosage d'un colorant alimentaire (SIN110) dans une boisson gazeuse par spectrophotométrie directe................................................................ Dosage du glucose par la méthode de Trinder (spectrophotométrie indirecte)... Dosage des protéines totales par la méthode du biuret............................... Dosage des protéines tissulaires par la méthode de Bradford ...................... Dosage du cholestérol total par la méthode Enzymatique-Colorimétrique CHOD-POD ................................................................................ Dosage de triglycérides par la méthode Enzymatique-Colorimétrique GPO- POD ........................................................................................ Références bibliographiques............................................................ 1 9 18 2429
34
37
41
TP n° 0: Consignes de sécurité et matériel de laboratoire TP n° 0: Consignes de sécurité et matériel de laboratoire.
Page 2
1. Consignes de sécurité
Par mesure d'hygiène, il est interdit de manger dans le laboratoire. Le port de la blouse 100% coton est obligatoire. La blouse doit être de longueur raisonnable et à manches longues. Les étudiants doivent toujours manipuler debout. Aucun objet ne doit encombrer les paillasses. Les tabourets ou les chaises doivent être rangés sous les paillasses afin de ne pas encombrer les allées. Pour chaque manipulation présentant un risque, le port des lunettes de protection et degants en latex est impératif. Les cheveux longs doivent être attachés derrière la tête.
Toute manipulation de produits chimiques présentant un risque doit être réalisée sous une hotte ventilée, avec vitres protectrices. Le pipetage à la bouche est interdit. Utiliser les propipettes. IL est interdit de regarder de près les récipients contenant des liquides en ébullition. Ne pas respirer le contenu d'un récipient pour l'identifier à son odeur. Reboucher tout flacon immédiatement après usage. Ne jamais prendre de produits solides avec les doigts, utiliser une spatule. Utiliser des verreries résistantes aux hautes températures (verrerie Pyrex) lorsqu'il faut chauffer. Éviter de faire subir des chocs thermiques à la verrerie (ne pas refroidir brutalement un récipient chaud). Les paillasses doivent être nettoyées au cours de la séance et laissées parfaitement propres et sèches en fin de séance. Il est impératif de se laver soigneusement les mains après manipulation. TP n° 0: Consignes de sécurité et matériel de laboratoire.Page 3
Il est recommandé de ne jamais jeter dans les éviers de laboratoires, les produits à risque : Verser les solutions dans les flacons de récupération prévus à cet effet. Les pictogrammes de sécurité de produits chimiques doivent être connus.Le SGH (ou en Europe " règlement CLP ») s'applique de façon obligatoire aux substances depuis fin 2010. Ce nouveau système comprend 9 pictogrammes. Baptisé " Système Général Harmonisé (SGH) » ou " Globally Harmonized System (GHS) », il a pour but d'uniformiser l'étiquetage des produits chimiques à l'échelle mondiale. Il est appliqué en Europe sous le
nom de " Règlement CLP ». Le système européen préexistant et le nouveau système SGH
cohabitent ainsi depuis le 1 er décembre 2010.2. Connaissance des risques de produits utilisés
Il existe trois grandes catégories de dangers intrinsèques aux substances chimiques : les dangers physiques (risque d'explosion, d'inammation, etc.) ;les dangers pour la santé (toxicité aiguë, lésion oculaire, toxicité pour la reproduction, etc.) ;
les dangers pour l'environnement (danger pour les milieux aquatiques). TP n° 0: Consignes de sécurité et matériel de laboratoire.Page 4
TP n° 0: Consignes de sécurité et matériel de laboratoire.Page 5
3. Etiquetage de produits chimiques
La première information sur les dangers d'une substance chimique est fournie par l'étiquette sur laquelle doit apparaître au moins : le nom du produit ; des pictogrammes de danger ; des mentions de dangers (phrases H) ; des conseils de prudence (phrases P) ; une mention d'avertissement. Sur l'étiquette, peuvent aussi figurer des grandeurs physiques (densité, masse molaire, composition, etc.). L'image suivante donne l'exemple d'une étiquette d'acide chlorhydrique concentré. TP n° 0: Consignes de sécurité et matériel de laboratoire.Page 6
Pictogrammes de danger
Ces schémas représentent des types de dangers particuliers. Ils sont notés SGHXX et sont présentés dans la figure suivante.Mentions de danger (phrases H)
Les mentions de danger complètent les pictogrammes. Elles commencent toujours par la lettre H (pour Hazard = danger) qui est suivie d'un nombre à 3 chiffres. Le 1er chiffre correspond à la catégorie de danger. H2XX : mentions de dangers relatives aux dangers physiques ; H3XX : mentions de dangers relatives aux dangers pour la santé ; H4XX : mentions de dangers relatives aux dangers pour l'environnement.Conseils de prudence (phrases P)
Les conseils de prudence complètent également les pictogrammes. Ils commencent toujours par la lettre P (pour Prudence) qui est suivie d'un nombre à 3 chiffres. Le 1er chiffre correspond à la catégorie de conseil de prudence.P1XX : conseils de prudence généraux ;
P2XX : conseils de prudence - Prévention ;
P3XX : conseils de prudence - Intervention ;
P4XX : conseils de prudence - Stockage ;
P5XX : conseils de prudence - Élimination.
TP n° 0: Consignes de sécurité et matériel de laboratoire.Page 7
Mention d'avertissement
Sur l'étiquette figure une mention d'avertissement " Attention » ou " Danger » quiindique le degré relatif de dangerosité. " Danger » est utilisé pour les dangers les plus
graves. Substances C.M.R. : Cancérogène, Mutagène, toxique pour la Reproduction Il existe une classification européenne de produits chimiques C.M.R. qui s'appuie sur desrésultats d'études animales et/ou humaines. La liste des substances C.M.R. évolue car tous les
produits n'ont pas été testés.Les composés C.M.R. doivent être stockés sous clé et utilisés en
respectant scrupuleusement les consignes de sécurité. Quelques exemples de substances C.M.R. : aniline, benzène, 1,3-butadiène, chlorure de cobalt (II), dichromate de potassium, mercure, phénol...4. Premiers soins aux victimes d'accident
4.1. En cas de projection cutanée
Rincer la peau longuement et abondamment à l'eau claire jusqu'à ce que le produit soitéliminé.
Attention, ne pas chercher à neutraliser les produits acides ou basiques.4.2. En cas de projection oculaire
Rincer immédiatement et abondamment à l'eau froide.Consulter systématiquement un ophtalmologue.
4.3. En cas d'ingestion accidentelle
En cas d'ingestion, rincer la bouche. Boire un verre d'eau. En cas d'inhalation de vapeurs (Eau de Javel, Brome...), amener la personne dans un endroit aéré. TP n° 0: Consignes de sécurité et matériel de laboratoire.Page 8
5. Matériel de Laboratoire
TP n° 1 : Dosage d'un colorant alimentaire
(SIN110) dans une boisson gazeuse par spectrophotométrie directe.TP n° 1 : Dosage d'un colorant alimentaire (SIN110) dans une boisson gazeuse par spectrophotométrie
directe.Page 10
1. Rappel : SPECTROPHOTOMETRIE D'ABSORPTION MOLECULAIRE UV/Vis.
La spectrophotométrie d'absorption moléculaire UV-visible est une méthode d'analyse très commune dans les laboratoires, basée sur la propriété d'absorption des radiations lumineuses par la matière, ou en d'autres termes l'interaction molécule/ rayonnement électromagnétique. Le domaine de longueur d'onde utilisable correspond au spectre visible :400 (violet) à 800 (rouge) nm environ ou au proche ultraviolet (200 à 400 nm).
Cette méthode nécessite l'utilisation d'un spectrophotomètre et permet de caractériser des molécules, de déterminer des concentrations d'espèces chimiques en solution et par extension de réaliser des suivis cinétiques des réactions (chimiques et enzymatiques).1.1. PRINCIPE DE LA TECHNIQUE :
Lorsqu'une solution est traversée par un rayonnement polychromatique, elle peut diminuer l'intensité des radiations à certaines longueurs d'onde: on dit alors qu'elle absorbe ces radiations. La mesure de la fraction d'intensité lumineuse absorbée à cette longueur d'onde permet de déterminer la concentration de la substance absorbante dans la solution étudiée.REMARQUE : " Absorption et couleur »
De façon simplifiée, si une solution absorbe dans le visible, elle apparaît de la couleur complémentaire à la longueur d'onde absorbée (violet/jaune, bleu/orange, vert/rouge) comme illustré par le cercle chromatique suivant :TP n° 1 : Dosage d'un colorant alimentaire (SIN110) dans une boisson gazeuse par spectrophotométrie
directe.Page 11
1.2. LOIS DE LA SPECTROPHOTOMETRIE :
Représentation d'une cuve
traversée par un faisceau incident d'intensité I0 Ȝ.Un faisceau d'intensité It Ȝ
en émerge. Soit un rayonnement monochromatique (de longueur d'onde Ȝ) d'intensité incidente IȜ traversant une solution absorbante de longueur du trajet optique). Une partie de cette radiation incidente sera absorbée par la solution et l'autre sera transmise et son intensité est notée It Ȝ avec It Ȝ < I0 Ȝ. A fin de quantifier l'intensité de la radiation absorbée à une longueur d'onde Ȝ donnée, deux grandeurs sont introduites: la transmittance, notée TȜ et l'absorbance, notée AȜ: Ces grandeurs sont sans unité ; la transmittance est souvent exprimée en % : Si TȜ = 100 %, le milieu est parfaitement transparent et AȜ = 0 ; Si TȜ = 0 %, le milieu est parfaitement opaque et AȜ . L'absorbance AȜ est souvent appelée Densité Optique (D.O.).TP n° 1 : Dosage d'un colorant alimentaire (SIN110) dans une boisson gazeuse par spectrophotométrie
directe.Page 12
Loi de Beer-Lambert :
Considérons une solution contenant une espèce chimique de concentration c absorbant à la longueur d'onde Ȝ. La loi de Beer-Lambert donne une relation entre l'absorbance AȜ et la concentration c de l'espèce chimique en solution:Avec :
utilise des cuves de 1 cm. c la concentration de l'espèce considérée en solution (exprimée en mol.L-1). İ le coefficient d'absorption molaire (exprimé usuellement en L. mol-1. cm-1). C'est une grandeur qui dépend de l'espèce chimique considérée, de la longueur d'onde d'analyse, du solvant et de la température.Limitations de la loi de Beer-Lambert
La loi de Beer-Lambert, qui ne concerne que la fraction de la lumière absorbée, est vérifiée dans les conditions suivantes : La lumière utilisée doit être monochromatique ;Les concentrations doivent être faibles ;
La solution ne doit être ni fluorescente ni hétérogène ; le soluté ne doit pas donner lieu à des transformations photochimiques ; le soluté ne doit pas donner des associations variables avec le solvant.TP n° 1 : Dosage d'un colorant alimentaire (SIN110) dans une boisson gazeuse par spectrophotométrie
directe.Page 13
1.3. MESURES D'ABSORPTION :
a) Principe de l'appareil : L'absorbance (ou la transmittance) peut être mesurée par un spectrophotomètre dont le schéma de principe est représenté sur la figure suivante. S : Source de lumière blanche (polychromatique). F1 : Fente (diaphragme) permettent de sélectionner l'intensité de la lumière blanche.P : Dispositif dispersif (prisme).
F2 : Fente sélectionnant une longueur d'onde souhaitée.C : Photodétecteur (cellule photoélectrique) engendrant un courant d'intensité proportionnelle
à l'intensité de la lumière reçue. L'intensité de ce courant est traduite en absorbance sur le
galvanomètre G (afficheur). b) Mesure de l'absorbance : Pour mesurer l'absorbance, il fallait effectuer ces étapes suivantes :Choisir une longueur d'onde "Ȝmax ».
Les mesures sont faites de préférence à une longueur d'onde correspondant à un maximum courbe est appelé spectre d'absorption.TP n° 1 : Dosage d'un colorant alimentaire (SIN110) dans une boisson gazeuse par spectrophotométrie
directe.Page 14
Placer dans le porte-cuve une cuve contenant une solution du blanc* de même composition que la solution dont on veut mesurer l'absorbance, à l'exception de la substance étudiée. "Afficher " une absorbance nulle. Remplacer la solution du blanc par la solution étudiée* et lire l'absorbance. L'utilisation de la cuve du blanc permet de mesurer uniquement l'absorbance du produitétudié en éliminant l'absorption du solvant et de la cuve, les phénomènes de diffusion et
les réflexions aux interfaces. * cuve remplie aux 2/3 seulement, extérieur bien essuyé. Si l'absorbance de la solution étudiée est supérieure à 2, il convient de la diluer en conséquence. c) Utilisation des mesures : rapport des absorbances de deux solutions contenant la même substance est égal au rapport des concentrations : A1 / A2 = c1 / c2. Il suffit donc de mesurer les absorbances d'une solution "étalon" (concentration connue) et de la solution étudiée pour déterminer la concentration dans cette dernière. Pour diminuer l'incertitude sur la détermination de la concentration, il est préférable de tracer une courbe d'étalonnage en utilisant des concentrations variables et connues de la substance à doser. Les mesures faites à plusieurs dilutions avec la solution à doser sont alors comparées à la courbe d'étalonnage.TP n° 1 : Dosage d'un colorant alimentaire (SIN110) dans une boisson gazeuse par spectrophotométrie
directe.Page 15
2. Les colorants alimentaires
Les colorants alimentaires sont des additifs utilisés pour normaliser ou restaurer la couleur des aliments. L'un des colorants de synthèse les plus utilisés dans l'industrie agroalimentaire et surtout dans la production des jus de fruits et des boissons gazeuses à l'orange est le " jaune orangé S/ jaune soleil FCF (SIN110) ». Ce colorant chimique est une poudre ou granules rouge orangé très soluble dans l'eau. Sa formule brute est : C16H10N2Na2O7S2 et sa masse molaire est de 452,37 g/mole.
N.B. La norme maximum tolérée du SIN 110 est de 50 mg/L. Ce colorant est utilisé également dans certaines sirops, soupes instantanées, fromages, gâteaux, pâtisseries, pâtes de fruits, glaces, bonbons...en cosmétologie sous l'appellation
"CI 15985" et dans certains produits pharmaceutiques (par exemple : agent colorant pour les comprimés de vitamine C).La consommation de SIN110 peut provoquer : Un syndrome d'hyperactivité chez les enfants s'il est associé à des benzoates (= les additifs de SIN210 à SIN215).
De l'urticaire et de l'eczéma notamment si il est associé avec de l'aspirine (intolérance aux salicylates), des diarrhées et des troubles gastriques.
Le cancer, le SIN110 est possiblement cancérigène et classé catégorie 3 au CIRC (Centre International de Recherches sur le Cancer). Il a été montré qu'il accroit le
nombre de tumeurs chez les animaux.le SIN110 est interdit dans certains pays comme la Norvège et la Finlande. SIN : Système International de Numérotation des additifs alimentaires.
TP n° 1 : Dosage d'un colorant alimentaire (SIN110) dans une boisson gazeuse par spectrophotométrie
directe.Page 16
3. Objectif
Le but de cette manipulation est la détermination de la longueur d'onde d'absorption maximale "Ȝmax » et de la teneur en "SIN110 jaune orangé S » d'une boisson gazeuse.
4. Produits et matériel
4.1. Produits utilisés
Poudre du colorant alimentaire SIN110 ; 1g
Eau distillée ; 3 L
4.2. Matériel : Spectrophotomètre.
2 cuves.
Papiers joseph.
Balance analytique.
Verre de montre.
Spatule. 8 tubes à essais.
Agitateur des tubes.
2 Fiole jaugée de 100 mL.
Entonnoir.
Pipettes 10 et 2 mL
Pro-pipettes. 5. Mode opératoire
5.1 - Détermination de la longueur d'onde d'absorption maximale "Ȝmax » :
Dans une cuve, mettre le solvant (eau distillée) sur lequel on fera le "zéro optique". Dans une autre cuve, mettre une solution du colorant alimentaire SIN110 à 4,42 x 10-4 M.
A partir de Ȝ = 450 nm, faire une mesure tous les 5 nm ou moins quand l'absorbance varie rapidement, dans le sens croissant des longueurs d'onde, jusqu'à 550 nm. Pour chaque longueur d'onde, ne pas oublier de "refaire le zéro optique" avec une cuve remplie d'eau distillée.TP n° 1 : Dosage d'un colorant alimentaire (SIN110) dans une boisson gazeuse par spectrophotométrie
directe.Page 17
5.2 - Préparation de la gamme des étalons
Préparer la gamme d'étalonnage en suivant le tableau 01 : Tableau 01 : Préparation de la gamme d'étalonnage.Tubes Témoin 1 2 3 4 5 6 7 SIN110 à 4,42 x 10-4 M (ml) 0 0,3 0,5 0,8 1,0 1,2 1,5 2,0 H2O q.s.p 10 ml 10 9,7 9,5 9,2 9,0 8,8 8,5 8,0
Lire l'absorbance à la longueur d'onde d'absorption maximale " Ȝ max ».6.2- Pour quelle longueur d'onde Ȝ l'absorbance est-elle maximale ? La noter sur le
graphe. 6.3- Quelle est la couleur de la solution du colorant alimentaire "SIN110»? La longueur d'onde Ȝmax correspond-elle à la couleur complémentaire de cette solution?6.4- Déterminer les concentrations massiques et les dilutions des étalons.
6.7- Déterminer la concentration massique du "SIN110 jaune orangé S» dans la boisson
gazeuse. Est-ce que le fabricant de la boisson gazeuse a respecté la norme internationale ?6.8- Calculer le coefficient d'absorption molaire.
TP n° 2 : Dosage du glucose par la méthode deTrinder.
(Spectrophotométrie indirecte) TP n° 2 : Dosage du glucose par la méthode de Trinder. (Spectrophotométrie indirecte)Page 19
1. Rappel : Méthodes de dosage spectrophotométrique
Spectrophotométrie directe et indirecte
Deux cas sont possibles selon la substance à doser : (1)- la substance à doser possède un pic d'absorption caractéristique dans le visible (substance colorée) ou dans l'UV ; on fait alors un dosage spectrophotométrique direct de cette substance. (2)- la substance à doser ne possède pas un pic d'absorption caractéristique dans le visible (substance incolore) ou dans l'UV ; on fait alors un dosage spectrophotométrique indirect de cette substance en dosant un produit coloré résultant d'une réaction de coloration spécifique à la substance à doser. Substance incolore + réactifs de coloration Produit coloré Comment calculer la concentration c d'un échantillon :Méthode directe :
Elle consiste à mesurer l'absorbance Aéch et à calculer directement la concentration céch en appliquant la loi de Beer-Lambert.
Elle nécessite de connaitre le coefficient d'absorption molaire İ de la substance à doser à la longueur d'onde choisie, et de bien caler le monochromateur, car İ varie avec TP n° 2 : Dosage du glucose par la méthode de Trinder. (Spectrophotométrie indirecte)Page 20
Méthodes indirectes : Elles ne nécessitent pas de connaitre İ : a)- Méthode par comparaison avec un étalon unique : Elle consiste à mesurer dans les mêmes conditions l'absorbance Aéch de la solution à doser "échantillon" et l'absorbance Aet d'une solution "étalon" ou "standard" de concentration connue cet, puis à calculer la concentration de la solution à doser céch ; en utilisant l'équation suivante : céch= (Aéch x cet) /Aet . Elle suppose mais ne vérifie pas la linéarité. b)- Méthode par comparaison avec une gamme d'étalonnage : Elle consiste à préparer une gamme de dilutions d'une solution étalon "mère", à mesurer l'absorbance de chacune de ces solutions étalons "filles", puis à tracer la courbe conditions, puis reportée sur la courbe d'étalonnage; on fait ainsi une détermination graphique de la concentration de la solution à doser (la gamme doit encadrer la valeur probable de la solution à doser) ; Elle permet de vérifier la linéarité, et tient compte des éventuelles erreurs de manipulation.2. Introduction
Le glucose est un hexose (ose à 6 C), possédant comme fonction réductrice une fonction aldéhyde (aldose). En tant qu'aldohexose, le glucose en solution se présente sous plusieursformes en équilibre : linéaire ou cyclisées. Les plus stables, et donc les plus abondantes dans
la nature, sont les formes cycliques pyrannes.L'enzyme (la glucose-oxydase) étant très spécifique, le glucose peut être décelé et dosé
seul dans un mélange complexe de glucides. La méthode proposée est la plus employée pour déterminer le taux de glucose dans le sang (glycémie) ou dans les urines (glycosurie), sous TP n° 2 : Dosage du glucose par la méthode de Trinder. (Spectrophotométrie indirecte)Page 21
forme liquide ou sous forme de bandelettes réactives, que ce soit en laboratoire d'analyses, en milieu hospitalier ou par les diabétiques (autocontrôle de la glycémie).3. Principe
La Glucose-oxydase (GOD) catalyse l'oxydation du glucose en acide gluconique. Le peroxyde d'hydrogène (H2O2) formé de cette réaction est détecté par un accepteur d'oxygène
chromogénique, le Phénol-Aminophénazone, ce chromogène réduit incolore, en présence
de la Peroxydase (POD), sera oxydé en un dérivé coloré en rose (Quinone). L'intensité de la
coloration obtenue est proportionnelle à la quantité initiale en glucose. ȕ-D-Glucose + O2 + H2O GOD Acid gluconique + H2O2 H2O2 + Phénol + Aminophenazone POD Quinone + H2O
On peut simplifier l'ensemble de ces réactions ainsi :L'intérêt d'utiliser un chromogène est d'obtenir un produit coloré permettant d'effectuer des
mesures spectrophotométriques faciles à mettre en oeuvre.quotesdbs_dbs35.pdfusesText_40[PDF] tp dosage de la vitamine c dans un comprimé
[PDF] dosage de la vitamine c dans un comprimé corrigé
[PDF] dosage en retour exercice corrigé
[PDF] dosage vitamine c jus d'orange
[PDF] dosage en retour de la vitamine c
[PDF] dosage vitamine c dcpip
[PDF] dosage indirect définition
[PDF] dosage indirect vitamine c
[PDF] dosage indirect de l'eau de javel
[PDF] tp conductivité des électrolytes et dosage conductimétrique
[PDF] dosage conductimétrique principe
[PDF] tp conductivité dune solution
[PDF] conductivité d'une solution en fonction de la concentration en tensioactifs
[PDF] concentration micellaire critique conductivité
