 Corrigé exercice 5 - TITRAGE SUIVI PAR POTENTIOMÉTRIE
Corrigé exercice 5 - TITRAGE SUIVI PAR POTENTIOMÉTRIE
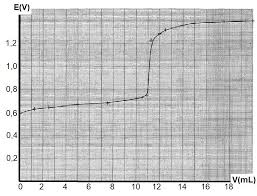
Exercice 5. Page 1 sur 6. Corrigé exercice 5. TITRAGE SUIVI PAR POTENTIOMÉTRIE. On note : ° = ¸. ℱ ln 10 = 0059 V à 298 K. 1). Couple Fe /Fe : n.o. du fer
 Les dosages doxydoréduction
Les dosages doxydoréduction
EXERCICES. Partie 1/ Chimie minérale. Fiche 11 : Les dosages d'oxydoréduction Exercice 9 : Dosage potentiométrique d'une solution d'ions fer 2. Le sulfate ...
 Dosage doxydoréduction - Suivi potentiométrique - CORRECTION
Dosage doxydoréduction - Suivi potentiométrique - CORRECTION
Dosage d'oxydoréduction - Suivi potentiométrique - CORRECTION. Objectifs du TP. Dans ce TP on réalise le dosage d'une solution de sel de Mohr (ions. ) par une
 Untitled
Untitled
Exercice 1 : Calculer la 1- Dans le cas d'un dosage potentiométrique de chlorures utilisant une électrode au calomel saturée comme électrode de référence que.
 Oxydoréduction
Oxydoréduction
On déterminera les concentrations des différentes espèces à l'équilibre sous la tension imposée. Exercice 7 : Dosage potentiométrique Corrigés en TD : ...
 CORRECTION TP :DOSAGE POTENTIOMETRIQUE DU FER
CORRECTION TP :DOSAGE POTENTIOMETRIQUE DU FER
CORRECTION TP :DOSAGE POTENTIOMETRIQUE DU FER. II Premier dosage rapide: suivi colorimétrique. 1. Equation de la réaction: Fe2+ + Ce4+ = Fe3+ + Ce3+.
 Dosages Dosages
Dosages Dosages
6 - Déterminer la concentration C1 de la solution de dichromate de potassium. Exercice 4 : Lire un protocole de dosage. [♢♢0]. Tous les documents suivants
 Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
Celle-ci est liée à l'apparition d'acide lactique dans les muscles pouvant entraîner des crampes douloureuses après un exercice physique prolongé. 2. Test d'
 COURS ET EXERCICES DE CHIMIOMETRIE
COURS ET EXERCICES DE CHIMIOMETRIE
a). Erreur systématique : elle est appelée aussi erreur déterminée qui peut être détecté et corrigée. titrage potentiométrique du Cr+6 avec le ...
 Exercices et problèmes CHIMIE - 1re année MPSI/PTSI
Exercices et problèmes CHIMIE - 1re année MPSI/PTSI
Les corrigés de tous les exercices sont regroupés à la fin de chaque dosage par le logiciel Simultit est donnée ci-dessous. a) Identifier chacune des ...
 Corrigé exercice 5 - TITRAGE SUIVI PAR POTENTIOMÉTRIE
Corrigé exercice 5 - TITRAGE SUIVI PAR POTENTIOMÉTRIE
Exercice 5. Page 1 sur 6. Corrigé exercice 5. TITRAGE SUIVI PAR POTENTIOMÉTRIE. On note : ° = ¸. ? ln 10 = 0059 V à 298 K. 1). Couple Fe /Fe :.
 Chapitre I
Chapitre I
Chapitre V : Potentiométrie dosage précis. ... Kadri M. Chater & A. Cours et exercices corrigés de chimie générale à l'usage des étudiants des troncs ...
 Les dosages doxydoréduction
Les dosages doxydoréduction
Le but de l'exercice est d'illustrer le dosage de solutions parfois utilisées en Exercice 8 : Dosage potentiométrique d'une solution d'ions fer 2.
 EXERCICES DE REVISION : LES REACTIONS D
EXERCICES DE REVISION : LES REACTIONS D
redox. • Dosages par potentiométrie. Exercice 1 (D'après BTS ABM 2001 Etude d'une pile). On considère la pile dont les deux compartiments sont formés :.
 Dosage doxydoréduction - Suivi potentiométrique - CORRECTION
Dosage doxydoréduction - Suivi potentiométrique - CORRECTION
Dans ce TP on réalise le dosage d'une solution de sel de Mohr (ions. ) potentiométrie à l'aide de deux électrodes : une électrode de mesure en platine et ...
 Chimie Analytique 2éme année pharmacie - Electrochimie - Dr
Chimie Analytique 2éme année pharmacie - Electrochimie - Dr
Electrodes à membrane liquide ? Dosage de Ca2+ K+
 TP de potentiométrie : éléments de correction 1 Question
TP de potentiométrie : éléments de correction 1 Question
mon hypothèse sur la concentration de la solution titrante est incorrecte 2 Dosage potentiométrique : sulfate de fer hydraté a) Les nombres d'oxydation des ...
 Untitled
Untitled
Exercice 1 : Exercice 2 : ... 1- Dans le cas d'un dosage potentiométrique de chlorures utilisant une électrode au calomel saturée comme électrode de ...
 Dosage potentiométrique : Fe par MnO4
Dosage potentiométrique : Fe par MnO4
Dosage potentiométrique : Fe. 2+ par MnO4. -. (TP2 – Série 8 Redox et Exo 4 du TD23). Présentation du dosage. Présentation du dosage :.
 Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
EXERCICE 2 – UN EXEMPLE DE CHIMIE VERTE : LA SYNTHÈSE DE L'IBUPROFÈNE. ACCÈS CORRECTION. Troisième partie : titrage d'un comprimé d'ibuprofène.
 [PDF] Corrigé exercice 5 - TITRAGE SUIVI PAR POTENTIOMÉTRIE
[PDF] Corrigé exercice 5 - TITRAGE SUIVI PAR POTENTIOMÉTRIE
Exercice 5 Page 1 sur 6 Corrigé exercice 5 TITRAGE SUIVI PAR POTENTIOMÉTRIE On note : ° = ¸ ? ln 10 = 0059 V à 298 K 1) Couple Fe /Fe :
 [PDF] Les dosages doxydoréduction
[PDF] Les dosages doxydoréduction
EXERCICES Partie 1/ Chimie minérale Fiche 11 : Les dosages d'oxydoréduction Exercice 1 : Teneur en dioxyde de soufre dans un vin blanc
 [PDF] Ch18 Exercice corrigé p : 478 n°8 CONTRÔLE DE QUALITE PAR
[PDF] Ch18 Exercice corrigé p : 478 n°8 CONTRÔLE DE QUALITE PAR
Contrôle de qualité par dosage Ch 18 Exercice corrigé p : 478 n°8 CONTRÔLE DE QUALITE PAR DOSAGE Qu'est-ce qu'un dosage par titrage direct ?
 Exercices corriges TITRAGE POTENTIOMETRIQUE pdf
Exercices corriges TITRAGE POTENTIOMETRIQUE pdf
TITRAGE POTENTIOMETRIQUE Le candidat doit restituer ce document avant de sortir de la salle d'examen Le candidat doit agir en autonomie et faire preuve
 [PDF] Dosage doxydoréduction - Suivi potentiométrique
[PDF] Dosage doxydoréduction - Suivi potentiométrique
Dosage d'oxydoréduction - Suivi potentiométrique - CORRECTION Objectifs du TP Dans ce TP on réalise le dosage d'une solution de sel de Mohr (ions )
 [PDF] Dosages - Étienne Thibierge
[PDF] Dosages - Étienne Thibierge
Dosages Exercices sur les titrages directs Pour contourner la difficulté sans montage de potentiométrie on effectue un dosage en retour
 Examen corrige 1 POTENTIOMÉTRIE
Examen corrige 1 POTENTIOMÉTRIE
1 POTENTIOMÉTRIE dosage c) la courbe théorique de titrage potentiométrique à deux électrodes 62 exercices et problemes corriges - Dunod
 [PDF] CORRECTION TP :DOSAGE POTENTIOMETRIQUE DU FER
[PDF] CORRECTION TP :DOSAGE POTENTIOMETRIQUE DU FER
CORRECTION TP :DOSAGE POTENTIOMETRIQUE DU FER II Premier dosage rapide: suivi colorimétrique 1 Equation de la réaction: Fe2+ + Ce4+ = Fe3+ + Ce3+
 Dosage d oxydoréduction - Suivi potentiométrique - CORRECTION
Dosage d oxydoréduction - Suivi potentiométrique - CORRECTION
Dosage d oxydoréduction - Suivi potentiométrique - CORRECTION Objectifs du TP Dans ce TP on réalise le dosage d une solution de sel de Mohr (ions ) par une
Dosages par titrage direct
10 Extraits de sujets corrigés du bac S
© http://labolycee.org
Notions et contenus Compétences exigibles
Dosages par titrage direct.
Réaction support de titrage ; caractère
quantitatif.Équivalence dans un titrage ; repérage
de l'équivalence pour un titrage pH- métrique, conductimétrique et par réaction.à part
Pratiquer une démarche expérimentale pour de couleur, dans le domaine de la santé, de t ou du contrôle de la qualité.Interpréter qualitativement un changement de
pente dans un titrage conductimétrique. Les sujets sur les titrages se prêtent à des questions sur la précision des mesures et lesIncertitudes et notions associées
Évaluer, à l'aide d'une formule fournie, l'incertitude d'une mesure obtenue lors de la réalisation d'un protocole dans lequel interviennent plusieurs sources d'erreurs.Expression et acceptabilité du résultat
Maîtriser l'usage des chiffres significatifs et l'écriture scientifique. Associer l'incertitude à cette écriture.Évaluer la précision relative.
Commenter le résultat d'une opération de mesure en le comparant à une valeur de référence.Faire des propositions pour améliorer la
démarche. Compétences attendues (mais officiellement non exigibles)Savoir schématiser un dispositif de titrage direct (pH-métrique, conductimétrique ou
colorimétrique).Connaître l
-métrique (méthode des tangentes parallèles ou méthode de la dérivée) ou dans un titrage conductimétrique. Savoir choisir un indicateur coloré adapté à un titrage acido-basique. usser le résultat du titrage. en autonomie, les étapes nécessaires à la par exemple).MÉTHODE :
- (placée dans la burette).- différencier le volume titré (prélèvement) du volume de la solution dont on cherche la
on !)- noter si la solution a été diluée avant le titrage : la concentration trouvée sera donc celle
de la solution fille et il faudra la multiplier par le facteur de dilution pour trouver la concentration
de la solution mère. étape indispensable à la résolution du problème)Mettre des indices aux grandeurs utilisées dans les relations (Vtitré, VE, V1, Vsolution, n(A)titré,
n(B)versé, CA mais pas V, n ou C tout court) Comme toujours, vérifier la cohérence de vos résultats. Les corrigés sont rédigés par les professeurs Ces corrigés sont accessibles gratuitement et sans inscription sur http://labolycee.org Contacts : https://twitter.com/Labolycee ; https://www.facebook.com/labolycee/ ; labolycee@labolycee.org Extrait 1 Bac S Antilles Guyane Session de remplacement 09/2013 http://labolycee.org EXERCICE 2 UN EXEMPLE DE CHIMIE VERTE : LA SYNTHÈSE DE LIBUPROFÈNEACCÈS CORRECTION
Troisième partie
ibuprofène 400 mg » : - on sépare la molécule active des excipients pa - ntenant une solution aqueuse +(aq) + HO(aq)) de concentration molaire apportée cb = 0,20 mol.L-1. Letitrage est suivi par pH-métrie (les courbes obtenues sont tracées dans le document 3 ci-après).
3.1. Réaliser un schéma du mont
3.3. On rentre dans un tableur-grapheur les différentes valeurs du pH mesurées en fonction du
volume Vb tés du tableur- grapheur pour dériver le pH par rapport à Vb, la grandeur obtenue est notée b dpH dV . Les courbes tracées suite au titrage pH-métrique sont pH = f(Vb) et b dpH dV = g(Vb) (document 8).3.3.1. Parmi les courbes 1 et 2, quelle est celle qui représente pH = f(Vb) et celle qui
représente b dpH dV = g(Vb) ? Justifier.3.3.2. Déterminer la valeur du volume équivalent VE par une méthode de votre choix.
COOH. ACCÈS CORRECTION
3.6. Quelles caractéristiques doit posséder une réaction chimique
titrage ? nE(HOi3.10. Déduire des résulta
à la valeur attendue.
3.12. Parmi les indicateurs colorés acido-basiques proposés dans le tableau ci-après, quel est
celui qui est le mieux adapté au titrage précédent ? Justifier. Indicateur coloré Couleur acide Zone de virage Couleur basiqueVert de bromocrésol jaune 3,8 5,4 bleu
Phénolphtaléine incolore 8,2 10 rose
jaune 10,1 12,0 rouge-orangéDonnées :
: M(C13H18O2) = 206 g.mol-1.ACCÈS CORRECTION
Extrait 2 : Bac S 2013 Polynésie http://labolycee.orgEXERCICE I.
ACCÈS CORRECTION
européenne. Celle- tartrique dans le vin.Dans cet exercice,
Les parties 1 et 2 sont indépendantes.
Données :
Masses molaires atomiques :
Élément H C O N S
M (g/mol) 1,00 12,0 16,0 14,0 32,1
2A : M(H2A) = 150 g.mol-1.
foncé. Les ions iodure I, les ions sulfate SO42 et le dioxyde de soufre en solution sont incolores.1. Dosage du dioxyde de soufre dans le vin.
SO2(aq)
diiode aqueux I2(aq). Pour cela, il introduit dans un erlenmeyer, un volume V1 = (20,000,05) mL de vin blanc
également incolore.
La solution titrante, de concentration en diiode C2 = (1,000,01)×102 mol.L-1 est ensuite
E = (6,28
0,05) mL de solution de
diiode. I2(aq) + SO2(aq) + 2H2O(l) 2I(aq) + SO42(aq) + 4H+(aq) ivalence.1.2. Déterminer la concentration molaire C1 en dioxyde de soufre de ce vin et en déduire que sa
concentration massique Cmexp en dioxyde de soufre est égale à 0,201 g.L-1. mexp mexp C dont on admet que, dans les conditions de 222mexpE2 mexp E 2
ǻquotesdbs_dbs35.pdfusesText_40
[PDF] dosage potentiométrique des ions chlorure par nitrate d'argent
[PDF] dosage volumétrique mot fleche
[PDF] analyse volumétrique définition
[PDF] causer sa ruine
[PDF] dosage volumétrique acido-basique
[PDF] dosage gravimétrique
[PDF] dosage volumétrique principe
[PDF] doseur poudre industriel
[PDF] dose équivalente
[PDF] dose engagée
[PDF] dose efficace formule
[PDF] dose efficace définition
[PDF] dose efficace radiologie
[PDF] dose efficace corps entier
