 Physique tout-en-un 1re année MPSI-PCSI-PTSI - 3ème édition
Physique tout-en-un 1re année MPSI-PCSI-PTSI - 3ème édition
Vous pouvez accéder à des exercices supplémentaires et leurs corrigés complets sur le site Internet www.dunod.com. • Pour cela entrez « Sanz » (le nom du
 Physique tout-en-un MPSI-PTSI
Physique tout-en-un MPSI-PTSI
physique la dimension de x divisée par un temps au carré. Donc ω2. 0 a la dimension des s. -2 et ω0 a la dimension des s. -1. Le radian n'a pas de dimension ...
 Physique tout-en-un 1re année MPSI-PCSI-PTSI - 3ème édition
Physique tout-en-un 1re année MPSI-PCSI-PTSI - 3ème édition
Vous pouvez accéder à des exercices supplémentaires et leurs corrigés complets sur le site Internet www.dunod.com. • Pour cela entrez « Sanz » (le nom du
 Chimie Tout-en-un MPSI-PTSI - 2e éd.
Chimie Tout-en-un MPSI-PTSI - 2e éd.
On appelle phase une forme de la matière qui est uniforme en tout point par sa composition chimique et par son état physique. Définition. Nous parlerons donc de
 Physique Exercices incontournables MPSI-PTSI - 2e éd.
Physique Exercices incontournables MPSI-PTSI - 2e éd.
que l'on fait passer d'un côté de l'équation tout ce qui est en u et du et de l'autre tout ce qui est en t et dt. On n'a alors plus qu'à intégrer par bloc
 Chimie (problèmes et exercices) Indice 540.76 Nombres de Titres
Chimie (problèmes et exercices) Indice 540.76 Nombres de Titres
Chimie tout-en-un : MPSI PTSI. Fosset
 Réussir son entrée en prépa Physique-Chimie
Réussir son entrée en prépa Physique-Chimie
PHYSIQUE MPSI-PCSI-PTSI M. Cavelier
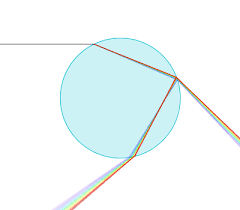 Cours doptique géométrique – femto-physique.fr
Cours doptique géométrique – femto-physique.fr
La notion de rayon est par exemple purement conceptuelle et toute expérience cherchant à isoler un rayon lumineux est vouée à l'échec à cause du phénomène de
 Désignation
Désignation
Physique tout -en- un PSIPSI*. Physique tout -en- un- 1ère année MPSI-PTSI. Physique MPSI/PCSI/PTSI. Physique 2e année MP-MP* -PT-PT*. Sciences physiques pour
 Tout-en-un
Tout-en-un
© Vuibert – juillet 2019 – 5 allée de la 2e DB 75015 Paris. Page 5. SOMMAIRE. PHYSIQUE Physique-Chimie PTSI. Figure 1.14. Capture d'écran du logiciel de ...
 Physique tout-en-un MPSI-PTSI
Physique tout-en-un MPSI-PTSI
Physique tout-en-un. MPSI
 Physique tout-en-un 1re année MPSI-PCSI-PTSI - 3ème édition
Physique tout-en-un 1re année MPSI-PCSI-PTSI - 3ème édition
3e édition. PHYSIQUE. TOUT-EN-UN• 1re année. MPSI - PCSI - PTSI. Un cours complet. De nombreux exercices et problèmes. Toutes les solutions détaillées
 Physique tout-en-un 1re année MPSI-PCSI-PTSI - 3ème édition
Physique tout-en-un 1re année MPSI-PCSI-PTSI - 3ème édition
3e édition. PHYSIQUE. TOUT-EN-UN• 1re année. MPSI - PCSI - PTSI. Un cours complet. De nombreux exercices et problèmes. Toutes les solutions détaillées
 Chimie Tout-en-un MPSI-PTSI - 2e éd.
Chimie Tout-en-un MPSI-PTSI - 2e éd.
On appelle phase une forme de la matière qui est uniforme en tout point par sa composition chimique et par son état physique. Définition.
 Exercices problèmes physique MPSI PCSI PTSI
Exercices problèmes physique MPSI PCSI PTSI
– Lors de la résolution d'un exercice nous avons privilégié les arguments physiques
 Désignation
Désignation
electrocinetique ; 1e annee mpsi pcsi
 EXERCICES PROBLEMES PHYSIQUE MPSI PCSI PTSI
EXERCICES PROBLEMES PHYSIQUE MPSI PCSI PTSI
– Lors de la résolution d'un exercice nous avons privilégié les arguments physiques
 Réussir son entrée en prépa Physique-Chimie
Réussir son entrée en prépa Physique-Chimie
Vuibert – mai 2018 – 5 allée de la 2e DB 75015 Paris PHYSIQUE MPSI-PCSI-PTSI
 Chimie (problèmes et exercices) Indice 540.76 Nombres de Titres
Chimie (problèmes et exercices) Indice 540.76 Nombres de Titres
Auteur. Cote Nbr. Exp. 1. 9782100521210. Physique tout en un premiere année : cours et exercices corrigés : MPSI-PCSI-PTSI. Badel Anne-Emmanuelle 530/188.
 sciences LMD campus 2014-2015 GLOBALE
sciences LMD campus 2014-2015 GLOBALE
2e éd. Mini Manuel de Chimie générale -. 2e édition Mathématique tout-en-un PCSI-. PTSI. Mathématiques Méthodes et ... QCM de prépa PHYSIQUE MPSI. PTSI ...
 [PDF] Physique tout-en-un MPSI-PTSI
[PDF] Physique tout-en-un MPSI-PTSI
Physique tout-en-un MPSI PTSI Sous la direction de Bernard Salamito damien Jurine Stéphane Cardini marie-noëlle Sanz Avec la collaboration de :
 [PDF] Physique tout-en-un 1re année MPSI-PCSI-PTSI - Index of /
[PDF] Physique tout-en-un 1re année MPSI-PCSI-PTSI - Index of /
3e édition PHYSIQUE TOUT-EN-UN• 1re année MPSI - PCSI - PTSI Un cours complet De nombreux exercices et problèmes Toutes les solutions détaillées
 (PDF) Physique Tout en Un MPSI PTSI - DOKUMENTIPS
(PDF) Physique Tout en Un MPSI PTSI - DOKUMENTIPS
TOUT-EN UN Physique tout-en-un MPSI PTSI Sous la direction de Bernard Salamito damien Jurine Stéphane Cardini marie-noëlle Sanz Avec la collaboration de
 Physique tout-en-un MPSI-PCSI-PTSI 1re année - 3e édition
Physique tout-en-un MPSI-PCSI-PTSI 1re année - 3e édition
Cet ouvrage propose aux étudiants de première année MPSI PCSI et PTSI un cours complet et 380 exercices et problèmes intégralement corrigés
 Physique tout-en-un MPSI-PTSI (Jintègre) PDF - Télécharger Lire
Physique tout-en-un MPSI-PTSI (Jintègre) PDF - Télécharger Lire
17 oct Télécharger Physique tout-en-un MPSI-PTSI - 2e éd PDF En Ligne Gratuitement Les Tout-en-un J'intègre vous proposent le cours de physique tout-en-un
 [PDF] Physique Tout En Un Mpsi (PDF)
[PDF] Physique Tout En Un Mpsi (PDF)
Physique PC-PC* Dunod Cet ouvrage propose aux étudiants de 2e année PSI PSI* un cours complet et 300 exercices et problèmes intégralement résolus Un cours
 Physique tout-en-un MPSI MP2I 2021 - Dunod
Physique tout-en-un MPSI MP2I 2021 - Dunod
Existe au format livre et ebook Ce « Tout-en-un » de physique MPSI est conforme aux nouveaux programmes 2021 Il comporte : • Tout le cours MPSI traité
 [PDF] Physique Exercices incontournables MPSI-PTSI - WordPresscom
[PDF] Physique Exercices incontournables MPSI-PTSI - WordPresscom
EXERCICES INCONTOURNABLES Physique exercices incontournables SÉVERINE BAGARD NICOLAS SIMON 2e ÉDITION partagelivrescpge blogspot com
 [PDF] Chimie Tout-en-un MPSI-PTSI - WordPresscom
[PDF] Chimie Tout-en-un MPSI-PTSI - WordPresscom
On appelle phase une forme de la matière qui est uniforme en tout point par sa composition chimique et par son état physique Définition
TOUT-EN UN
Chimie
tout-en-un MPSI PTSIBruno FOSSET
Jean-Bernard BAUDIN
Frédéric LAHIT»TE
© Dunod, Paris, 2013
ISBN 978-2-10-08-
Conception et crÈation de couverture : Atelier 3+ 70110i i "MPSI-fin" - 2013/7/22 - 9:45 - page i - #1i i i i i i
Table des matières
1TransformationdelamatiËre1
1 Les états de la matière . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .1
1.1 ...tats d'agrÈgation de la matiËre, notion de phase . . . . . . . . . . .1
1.2 Distinction microscopique entre Ètats d'agrÈgation . . . . . . . . . .2
1.3 PropriÈtÈs des gaz . . . . . . . . . . . . . . . . . . . . . . . . . . .3
1.4 L'Ètat liquide . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .7
1.5 ...tats solides . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .11
2 Les transformations de la matiËre . . . . . . . . . . . . . . . . . . . . . . . .13
2.1 Transformation physique. Diagramme d'Ètat(p;T). . . . . . . . . .13
2.2 Transformations nuclÈaires . . . . . . . . . . . . . . . . . . . . . . .18
2.3 Transformations chimiques . . . . . . . . . . . . . . . . . . . . . . .22
2.4 Description d'un systËme physico-chimique . . . . . . . . . . . . . .29
3 ...tude de la transformation chimique . . . . . . . . . . . . . . . . . . . . . .32
3.1 ...quilibre chimique, constante d'Èquilibre . . . . . . . . . . . . . . .32
3.2 ...volution d'un systËme vers l'Èquilibre chimique . . . . . . . . . . .37
3.3 Calcul des activitÈs ‡ l'Èquilibre . . . . . . . . . . . . . . . . . . . .42
3.4 Cas des Èquilibres physiques, coefcient de partage . . . . . . . . . .44
3.5 Cas des systËmes hÈtÈrogËnes . . . . . . . . . . . . . . . . . . . . .46
SynthËse . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .48 Exercices . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .50 CorrigÈs . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .591 Structure de l"atome . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .71
1.1 Protons, neutrons et Èlectrons . . . . . . . . . . . . . . . . . . . . .71
1.2 Existence d'isotopes, masse atomique . . . . . . . . . . . . . . . . .75
1.3 Taille d'un atome ou d'un ion . . . . . . . . . . . . . . . . . . . . .77
1.4 L'avËnement de la chimie quantique : contexte historique . . . . . . .77
2 Quantication de l'Ènergie . . . . . . . . . . . . . . . . . . . . . . . . . . .78
2.1 Structure ondulatoire/corpusculaire de la lumiËre . . . . . . . . . . .78
2.2 ...nergie Èlectronique, transition entre Ètats . . . . . . . . . . . . . . .79
2.3 ...tats d'Ènergie de l'atome d'hydrogËne et des ions hydrogÈnoÔdes . .83
i i i "MPSI-fin" - 2013/7/22 - 9:45 - page ii - #2i i i i i iTABLE DES MATIÈRES
3 Nombres quantiques, notion d"orbitale atomique . . . . . . . . . . . . . . . .88
3.1 Nombres quantiquesn,`,m. . . . . . . . . . . . . . . . . . . . . .88
3.2 Notion d'orbitale atomique; dÈgÈnÈrescence . . . . . . . . . . . . .89
4 Atome polyÈlectronique . . . . . . . . . . . . . . . . . . . . . . . . . . . . .90
4.1 Le spin de l'Èlectron . . . . . . . . . . . . . . . . . . . . . . . . . .91
4.2 Conguration Èlectronique des atomes et des ions . . . . . . . . . . .92
5 Classication pÈriodique des ÈlÈments . . . . . . . . . . . . . . . . . . . . .101
5.1 GenËse du tableau pÈriodique . . . . . . . . . . . . . . . . . . . . .102
5.2 Aspect gÈnÈral de la classication pÈriodique . . . . . . . . . . . . .102
5.3 MÈtaux et non-mÈtaux, mÈtalloÔdes . . . . . . . . . . . . . . . . . .105
5.4 Conguration Èlectronique et classication pÈriodique . . . . . . . .105
6 ...volution de quelques propriÈtÈs atomiques . . . . . . . . . . . . . . . . . .111
6.1 ...nergie d'ionisation et afnitÈ Èlectronique . . . . . . . . . . . . . .111
7 ...tude de quelques familles de la classication . . . . . . . . . . . . . . . . .116
7.1 Les ÈlÈments du blocs. . . . . . . . . . . . . . . . . . . . . . . . .116
7.2 Les ÈlÈments du blocp. . . . . . . . . . . . . . . . . . . . . . . . .117
7.3 Les ÈlÈments du blocd. . . . . . . . . . . . . . . . . . . . . . . . .119
8 Mise en úuvre expÈrimentale . . . . . . . . . . . . . . . . . . . . . . . . . .119
8.1 Combustion de quelques corps simples dans le dioxygËne . . . . . .119
8.2 PropriÈtÈs rÈductrices des alcalins et des alcalino-terreux . . . . . . .121
8.3 PropriÈtÈs chimiques des dihalogËnes et des halogÈnures . . . . . . .121
SynthËse . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .124 ActivitÈ documentaire : les radionuclÈides . . . . . . . . . . . . . . . . . . .125 Exercices . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .131 CorrigÈs . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .1383 Modèle de LEWISdesmolÈculesetdesions147
1 Association d"atomes : molécules et ions . . . . . . . . . . . . . . . . . . . .147
1.1 StabilitÈ des structures polyatomiques; Ènergie de liaison . . . . . . .147
1.2 GÈomÈtrie des molÈcules et des ions . . . . . . . . . . . . . . . . . .148
2 ModËle de LEWISdes molécules et des ions . . . . . . . . . . . . . . . . . .149
2.1 Introduction : les modËles de la liaison chimique . . . . . . . . . . .149
2.2 ...lectrons de valence des atomes des blocssetp. . . . . . . . . . . .150
2.3 Octet des composÈs monoatomiques stables . . . . . . . . . . . . . .150
2.4 Partage des Èlectrons de valence; symbolisme de LEWIS. . . . . . .151
2.5 RËgle de l'octet . . . . . . . . . . . . . . . . . . . . . . . . . . . . .151
2.6 Les symboles de LEWIS. . . . . . . . . . . . . . . . . . . . . . . .152
2.7 Nombre total d'Èlectrons et de paires de valence . . . . . . . . . . .152
2.8 ReprÈsentation de LEWISdes molécules simples . . . . . . . . . . .153
2.9 Liaisons multiples . . . . . . . . . . . . . . . . . . . . . . . . . . .154
2.10 ComposÈs dÈcients en Èlectrons . . . . . . . . . . . . . . . . . . .155
2.11 Charges formelles . . . . . . . . . . . . . . . . . . . . . . . . . . .156
2.12 ComposÈs prÈsentant des Èlectrons cÈlibataires . . . . . . . . . . . .159
2.13 DÈpassement de la rËgle de l'octet; hypervalence . . . . . . . . . . .160
ii i i "MPSI-fin" - 2013/7/22 - 9:45 - page iii - #3i i i i i iTABLE DES MATIÈRES
2.14 Molécules possédant des atomes du blocd. . . . . . . . . . . . . .163
2.15 ReprÈsentations de LEWISet réactivité chimique . . . . . . . . . . .164
3 MÈsomÈrie . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .164
3.1 Plusieurs reprÈsentations de LEWISpossibles . . . . . . . . . . . . .164
3.2 DÈlocalisation des Èlectrons . . . . . . . . . . . . . . . . . . . . . .164
3.3 Formes mÈsomËres et structure Èlectronique . . . . . . . . . . . . . .165
3.4 Symbole de mouvement Èlectronique . . . . . . . . . . . . . . . . .166
3.5 SystËme conjuguÈ et longueur de liaison . . . . . . . . . . . . . . . .168
4 PolaritÈ des molÈcules . . . . . . . . . . . . . . . . . . . . . . . . . . . . .169
4.1 Notion de moment dipolaire Èlectrostatique . . . . . . . . . . . . . .169
4.2 Moment dipolaire d'une distribution de charge . . . . . . . . . . . .170
4.3 Moment dipolaire des molÈcules diatomiques . . . . . . . . . . . . .170
4.4 MolÈcules polyatomiques . . . . . . . . . . . . . . . . . . . . . . .171
4.5 Inuence de la gÈomÈtrie sur le moment dipolaire . . . . . . . . . . .171
SynthËse . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .173 Exercices . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .174 CorrigÈs . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .1794CinÈtiquechimique189
1 Concepts fondamentaux de la cinétique chimique . . . . . . . . . . . . . . .189
1.1 SystËme considÈrÈ . . . . . . . . . . . . . . . . . . . . . . . . . . .189
1.2 Vitesse de formation d'un produit, de disparition d'un rÈactif . . . . .190
1.3 Vitesse de rÈaction . . . . . . . . . . . . . . . . . . . . . . . . . . .191
1.4 ...quation empirique de vitesse, notion d'ordre . . . . . . . . . . . . .192
1.5 Types de rÈactions chimiques . . . . . . . . . . . . . . . . . . . . .194
2 MÈthodes expÈrimentales . . . . . . . . . . . . . . . . . . . . . . . . . . . .195
2.1 MÈthodes physiques et chimiques en cinÈtique . . . . . . . . . . . .195
2.2 Exemples de mÈthodes physiques . . . . . . . . . . . . . . . . . . .197
3 Analyse des rÈsultats expÈrimentaux . . . . . . . . . . . . . . . . . . . . . .200
3.1 MÈthode diffÈrentielle . . . . . . . . . . . . . . . . . . . . . . . . .200
3.2 MÈthode des vitesses initiales . . . . . . . . . . . . . . . . . . . . .202
3.3 MÈthode d'intÈgration . . . . . . . . . . . . . . . . . . . . . . . . .203
3.4 Temps de demi-rÈaction . . . . . . . . . . . . . . . . . . . . . . . .208
3.5 Analyse des donnÈes . . . . . . . . . . . . . . . . . . . . . . . . . .210
4 Inuence de la tempÈrature sur la vitesse . . . . . . . . . . . . . . . . . . . .212
4.1 RÈsultats expÈrimentaux . . . . . . . . . . . . . . . . . . . . . . . .212
4.2 ...quation d'ARRHÉNIUS. . . . . . . . . . . . . . . . . . . . . . . .213
4.3 Autres facteurs inuenÁant la vitesse des rÈactions . . . . . . . . . .216
SynthËse . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .218 ActivitÈ documentaire : notions de mÈcanisme rÈactionnel . . . . . . . . . .219 Exercices . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .228 CorrigÈs . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .236 iii i i "MPSI-fin" - 2013/7/22 - 9:45 - page iv - #4i i i i i iTABLE DES MATIÈRES
5ForcesintermolÈculaires247
1 Existence de forces intermoléculaires . . . . . . . . . . . . . . . . . . . . .247
1.1 NÈcessaire modÈlisation des systËmes ÈtudiÈs . . . . . . . . . . . . .247
1.2 Interactions engageant un ion . . . . . . . . . . . . . . . . . . . . .248
1.3 Interactions entre un ion et un dipole mobile . . . . . . . . . . . . . .249
1.4 Interactions entre molÈcules polaires . . . . . . . . . . . . . . . . . .249
1.5 Interactions entre molÈcules polaires et non polaires . . . . . . . . .250
1.6 Interaction de dispersion . . . . . . . . . . . . . . . . . . . . . . . .252
1.7 Interaction d'attraction totale, interaction de rÈpulsion . . . . . . . .252
1.8 Existence de la liaison hydrogËne . . . . . . . . . . . . . . . . . . .254
1.9 Effets des diffÈrentes interactions intermolÈculaires . . . . . . . . . .255
2 CaractÈristiques des solvants; dissolution . . . . . . . . . . . . . . . . . . .261
2.1 CaractÈristiques d'un solvant . . . . . . . . . . . . . . . . . . . . . .261
2.2 Dissolution d'un composÈ, solvatation . . . . . . . . . . . . . . . . .264
2.3 SolubilitÈ d'un constituant, miscibilitÈ entre deux solvants . . . . . .267
2.4 PropriÈtÈs de conduction Èlectrique dans un solvant . . . . . . . . . .268
2.5 Choix d'un solvant, chimie verte . . . . . . . . . . . . . . . . . . . .272
3 Utilisations des solvants (extraction, purication) . . . . . . . . . . . . . . .273
3.1 Extraction liquide-liquide . . . . . . . . . . . . . . . . . . . . . . .273
3.2 Recristallisation . . . . . . . . . . . . . . . . . . . . . . . . . . . .276
3.3 Chromatographie sur couche mince (CCM) . . . . . . . . . . . . . .277
3.4 Catalyse par transfert de phase (CTP) . . . . . . . . . . . . . . . . .278
SynthËse . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .281 ActivitÈ documentaire : efuents industriels . . . . . . . . . . . . . . . . . .282 Exercices . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .290 CorrigÈs . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .2966Lesolidecristallin303
1 La cristallographie . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .303
1.1 AperÁu historique . . . . . . . . . . . . . . . . . . . . . . . . . . . .303
1.2 L'Ètude expÈrimentale des cristaux . . . . . . . . . . . . . . . . . . .304
2 Le cristal parfait . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .306
2.1 DÈnitions . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .306
3 Origine de la cohÈsion des solides . . . . . . . . . . . . . . . . . . . . . . .310
3.1 UnitÈ et diversitÈ des solides . . . . . . . . . . . . . . . . . . . . . .312
3.2 Cristaux mÈtalliques . . . . . . . . . . . . . . . . . . . . . . . . . .312
3.3 Cristaux ioniques . . . . . . . . . . . . . . . . . . . . . . . . . . . .314
3.4 Cristaux covalents . . . . . . . . . . . . . . . . . . . . . . . . . . .317
3.5 Cristaux molÈculaires . . . . . . . . . . . . . . . . . . . . . . . . . .319
3.6 ValiditÈ des modËles structuraux . . . . . . . . . . . . . . . . . . . .321
4 Cristaux mÈtalliques . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .322
4.1 DÈnitions . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .322
4.2 Principe de construction des assemblages compacts . . . . . . . . . .323
4.3 Structure cubique faces centrÈes (c.f.c.) . . . . . . . . . . . . . . . .325
iv i i "MPSI-fin" - 2013/7/22 - 9:45 - page v - #5i i i i i iTABLE DES MATIÈRES
4.4 Structure hexagonale compacte (h.c.) . . . . . . . . . . . . . . . . .331
4.5 Assemblage non compact : structure cubique centrÈe (c.c.) . . . . . .336
4.6 Structures cristallines des principaux mÈtaux . . . . . . . . . . . . .338
5 Cristaux covalents . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .340
5.1 Le diamant . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .340
5.2 Le graphite . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .342
6 Cristaux ioniques . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .344
7 Cristaux molÈculaires . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .349
SynthËse . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .352 ActivitÈ documentaire : les alliages . . . . . . . . . . . . . . . . . . . . . . .353 Exercices . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .360 CorrigÈs . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .3677...quilibresacido-basiques-Titrages379
1 Équilibres acido-basiques, généralités . . . . . . . . . . . . . . . . . . . . .379
1.1 DÈnitions prÈliminaires, constantes d'Èquilibre . . . . . . . . . . .379
1.2 Force d'un acide ou d'une base . . . . . . . . . . . . . . . . . . . .384
1.3 Diagrammes de prÈdominance . . . . . . . . . . . . . . . . . . . . .386
1.4 ...change de proton H+: prévision du sens d"échange . . . . . . . . .387
2 MÈthode de la rÈaction prÈpondÈrante . . . . . . . . . . . . . . . . . . . . .389
2.1 DÈnitions : rÈaction prÈpondÈrante, solution Èquivalente . . . . . . .389
2.2 Mise en úuvre simpliÈe de la mÈthode . . . . . . . . . . . . . . . .390
2.3 Un premier exemple simple . . . . . . . . . . . . . . . . . . . . . .391
3 ...tat nal d'Èquilibre : acides et bases . . . . . . . . . . . . . . . . . . . . . .393
3.1 Monoacides et monobases forts dans l'eau . . . . . . . . . . . . . . .393
3.2 Acides faibles, bases faibles . . . . . . . . . . . . . . . . . . . . . .393
4 ...tat nal d'Èquilibre : ampholytes, mÈlanges . . . . . . . . . . . . . . . . . .396
4.1 Ampholyte (espËce amphotËre) . . . . . . . . . . . . . . . . . . . .396
4.2 MÈlange acide faible/base conjuguÈe . . . . . . . . . . . . . . . . .398
4.3 MÈlange acide faible/base non conjuguÈe . . . . . . . . . . . . . . .399
4.4 MÈlange quelconque : exemple . . . . . . . . . . . . . . . . . . . . .400
5 Titrages acido-basiques . . . . . . . . . . . . . . . . . . . . . . . . . . . . .401
5.1 GÈnÈralitÈs sur les titrages . . . . . . . . . . . . . . . . . . . . . . .401
5.2 Suivi pH-mÈtrique ou conductimÈtrique d'un titrage . . . . . . . . .404
5.3 Titrage acide fort/base forte . . . . . . . . . . . . . . . . . . . . . .405
5.4 Titrage d'un acide faible par une base forte . . . . . . . . . . . . . .412
5.5 Titrage de polyacides (polybases) ou de mÈlanges d'acides (de bases)418
6 DÈtermination d'une constante d'aciditÈ . . . . . . . . . . . . . . . . . . . .423
6.1 RÈsultat conductimÈtrique, titrages . . . . . . . . . . . . . . . . . . .423
6.2 MÈthode spectrophotomÈtrique . . . . . . . . . . . . . . . . . . . .424
7 Suivi pHmÈtrique et conductimÈtrique d'un titrage . . . . . . . . . . . . . .425
7.1 ExpÈrience rÈalisÈe, donnÈes . . . . . . . . . . . . . . . . . . . . . .425
7.2 RÈsultats expÈrimentaux . . . . . . . . . . . . . . . . . . . . . . . .426
7.3 InterprÈtation . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .428
v i i "MPSI-fin" - 2013/7/22 - 9:45 - page vi - #6i i i i i iTABLE DES MATIÈRES
Synthèse . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .430 ActivitÈ documentaire : pouvoir tampon et pH sanguin . . . . . . . . . . . .431 Exercices . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .434 CorrigÈs . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .4468...quilibresdesolubilitÈ459
1 Équilibre hétérogène en solution aqueuse . . . . . . . . . . . . . . . . . . .459
1.1 Conditions d'existence d'un solide . . . . . . . . . . . . . . . . . . .459
1.2 Diagrammes d'existence/absence de solide . . . . . . . . . . . . . .462
1.3 SolubilitÈ, calcul de solubilitÈ dans l'eau pure . . . . . . . . . . . . .463
2 Effet d'ion commun. Inuence sur la solubilitÈ . . . . . . . . . . . . . . . .464
2.1 Exemple, mise en Èvidence . . . . . . . . . . . . . . . . . . . . . . .464
2.2 GÈnÈralisation, loi de modÈration . . . . . . . . . . . . . . . . . . .464
3 Intervention des rÈactions de complexation . . . . . . . . . . . . . . . . . . .464
3.1 Existence de complexes . . . . . . . . . . . . . . . . . . . . . . . .465
3.2 Mise en Èvidence expÈrimentale . . . . . . . . . . . . . . . . . . . .466
3.3 GÈnÈralisation, Ècriture de la rÈaction prÈpondÈrante . . . . . . . . .467
3.4 Application : solubilitÈ en milieu complexant . . . . . . . . . . . . .467
3.5 Exploitation d'une rÈaction prÈpondÈrante de redissolution . . . . . .468
4 Inuence du pH sur la solubilitÈ . . . . . . . . . . . . . . . . . . . . . . . .469
4.1 Loi de modÈration - RÈaction prÈpondÈrante gÈnÈralisÈe . . . . . . .469
4.2 Exemples . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .469
4.3 Cas des hydroxydes - Hydroxydes amphotËres . . . . . . . . . . . .474
5 Titrages par prÈcipitation . . . . . . . . . . . . . . . . . . . . . . . . . . . .478
5.1 Principe du titrage . . . . . . . . . . . . . . . . . . . . . . . . . . .478
5.2 Expression pAg=f(v). . . . . . . . . . . . . . . . . . . . . . . . .479
5.3 DÈtermination du point Èquivalent, suivi du titrage . . . . . . . . . .480
5.4 MÈthode de VOHLARD. . . . . . . . . . . . . . . . . . . . . . . . .483
5.5 Titrage de mÈlanges . . . . . . . . . . . . . . . . . . . . . . . . . .483
5.6 Titrage du mÈlange H3O+/Mg2+. . . . . . . . . . . . . . . . . . . .485
6 Mise en úuvre expÈrimentale . . . . . . . . . . . . . . . . . . . . . . . . . .486
6.1 Protocole et rÈsultats expÈrimentaux . . . . . . . . . . . . . . . . . .486
6.2 InterprÈtation . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .487
SynthËse . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .491 Exercices . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .493 CorrigÈs . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .5049OxydorÈduction517
1 Généralités sur l"oxydoréduction . . . . . . . . . . . . . . . . . . . . . . . .517
1.1 Transfert Èlectronique, vocabulaire . . . . . . . . . . . . . . . . . . .517
1.2 ...quilibrage d'une rÈaction d'oxydorÈduction . . . . . . . . . . . . .520
1.3 Nombres d'oxydation . . . . . . . . . . . . . . . . . . . . . . . . . .522
1.4 Vocabulaire . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .528
2 ...tude des piles . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .529
vi i i "MPSI-fin" - 2013/7/22 - 9:45 - page vii - #7i i i i i iTABLE DES MATIÈRES
2.1 Définitions, structure d"une pile . . . . . . . . . . . . . . . . . . . .529
2.2 ...tude de la pile DANIELL. . . . . . . . . . . . . . . . . . . . . . .530
2.3 Potentiel d'Èlectrode, potentiel d'oxydorÈduction . . . . . . . . . . .532
2.4 Application ‡ la pile DANIELL, capacité d"une pile . . . . . . . . . .536
3 Types d'Èlectrodes . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .538
3.1 ...lectrodes de premiËre espËce . . . . . . . . . . . . . . . . . . . . .538
3.2 ...lectrodes de deuxiËme espËce . . . . . . . . . . . . . . . . . . . . .540
3.3 ...lectrodes de troisiËme espËce . . . . . . . . . . . . . . . . . . . . .542
4 PrÈvision du sens de rÈaction . . . . . . . . . . . . . . . . . . . . . . . . . .543
4.1 Diagrammes de prÈdominance ou d'existence . . . . . . . . . . . . .543
4.2 PrÈvision du sens d'Èchange d'Èlectrons, calculs deKT. . . . . . . .545
4.3 StabilitÈ d'un nombre d'oxydation . . . . . . . . . . . . . . . . . . .550
4.4 DÈtermination d'un potentiel standard inconnu . . . . . . . . . . . .550
5 Titrages par rÈaction d'oxydorÈduction . . . . . . . . . . . . . . . . . . . . .555
5.1 Titrage d'une solution d'ions Fe2+par des ions Ce4+. . . . . . . . .555
5.2 Titrage des ions Fe2+par les ions MnO-4. . . . . . . . . . . . . . . .560
6 Mise en úuvre expÈrimentale . . . . . . . . . . . . . . . . . . . . . . . . . .561
6.1 Buts, expÈriences rÈalisÈes . . . . . . . . . . . . . . . . . . . . . . .561
6.2 Exploitations des expÈriences rÈalisÈes . . . . . . . . . . . . . . . .565
SynthËse . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .570 ActivitÈ documentaire : les piles ‡ combustible . . . . . . . . . . . . . . . .571 Exercices . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .573 CorrigÈs . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .58510Diagrammespotentiel-pH605
1 Tracé du diagrammeE-pH de l"eau . . . . . . . . . . . . . . . . . . . . . . .605
1.1 Convention de tracÈ . . . . . . . . . . . . . . . . . . . . . . . . . . .606
1.2 DiagrammeEpH de l"eau, tracé du diagramme . . . . . . . . . . .607
2 DiagrammeE-pH du fer . . . . . . . . . . . . . . . . . . . . . . . . . . . .609
2.1 Conventions, diagramme de situation . . . . . . . . . . . . . . . . .609
2.2 FrontiËres entre espËces de nombre d'oxydation diffÈrent . . . . . . .613
2.3 Utilisation du diagramme . . . . . . . . . . . . . . . . . . . . . . . .616
3 DiagrammeE-pH du zinc . . . . . . . . . . . . . . . . . . . . . . . . . . . .618
3.1 Conventions, diagramme de situation . . . . . . . . . . . . . . . . .618
3.2 ...quations des frontiËres . . . . . . . . . . . . . . . . . . . . . . . .620
3.3 Utilisation du diagramme . . . . . . . . . . . . . . . . . . . . . . . .621
4 DiagrammeE-pH du cuivre . . . . . . . . . . . . . . . . . . . . . . . . . . .622
4.1 Conventions, diagramme de situation . . . . . . . . . . . . . . . . .622
4.2 ...quations des frontiËres . . . . . . . . . . . . . . . . . . . . . . . .624
5 Utilisation : analyse d'un protocole expÈrimental . . . . . . . . . . . . . . .628
5.1 Protocole expÈrimental et rÈsultat obtenu . . . . . . . . . . . . . . .628
5.2 InterprÈtation, lecture de diagrammesEpH . . . . . . . . . . . . .628
SynthËse . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .631 Exercices et problËmes . . . . . . . . . . . . . . . . . . . . . . . . . . . . .632 vii i i "MPSI-fin" - 2013/7/22 - 9:45 - page viii - #8i i i i i iTABLE DES MATIÈRES
Corrigés . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .644Index659
viii i i "MPSI-fin" - 2013/7/22 - 9:45 - page 1 - #9i i i i i i1Transformation de la matière
La matière est naturellement présente de façon courante sous forme solide, liquide ou ga-zeuse et ces Ètats de la matiËre possËdent des propriÈtÈs physiques propres que nous nous
attacherons ‡ dÈcrire. ¿ de trËs hautes tempÈratures (typiquement plusieurs millions de
degrÈs), les constituants de l'atome se sÈparent, noyaux et Èlectrons se dÈplacent indÈ-
pendamment et forment un mÈlange globalement neutre : on parle alors de plasma. CequatriËme Ètat de la matiËre, que l'on retrouve dans les Ètoiles et le milieu interstellaire,
constitue la majoritÈ de notre univers (autour de 99 %). Sur Terre, on ne le rencontre pas ‡ l'Ètat naturel mais on le produit articiellement en appliquant des champs Èlectriques sufsamment puissants pour sÈparer le noyau de ses Èlectrons dans les gaz. La matiËre subit des transformations de faÁon permanente, celles-ci peuvent Ítre de nature physique(changement d"état physique),nucléaire(transformation du noyau des atomes), ouchimique(modification de l"enchaînement des atomes au sein des entités chimiques prÈsentes). Nous introduirons les grandeurs permettant la description d'un systËme (com- position du systËme). La transformation chimique revÍt une importance particuliËre, en raison de l'Ètendue de son champ d'application : Èlaboration de nouveaux matÈriaux, utilisation de l'Ènergie li- bÈrÈe par la rÈorganisation des atomes. Uneéquation chimiquepermet de rendre comptede l'Èvolution constatÈe ‡ l'occasion de la transformation chimique. L'avancementévalue
l'Ètat d'Èvolution du systËme siËge d'une rÈaction chimique dont l'Èquation est donnÈe.
Nous Ètudierons ici l'Èvolution d'un systËme lors d'une transformation chimique, en nousattachant ‡ dÈterminer l'Ètat nal du systËme. L'issue d'une transformation chimique peut
correspondre ‡ l'équilibre chimiqueou à une situationhors équilibre chimique(cas des transformations totales).1 Les états de la matière
1.1 États d"agrégation de la matière, notion de phase
L"eau H2O peut être observée de façon courante danstrois états d"agrégation différents: la
glace (eau solide), l'eau liquide et la vapeur d'eau. La transformation de l'un de ces Ètats enun autre peut Ítre facilement observÈe. Par exemple en Èlevant la tempÈrature du corps pur
H2O, la glace fond à 0 °C et l"eau liquide bout (vapeur d"eau) à 100 °C (sous pression at-
mosphÈrique). Toutes les espËces chimiques peuvent exister sous ces trois Ètats d'agrÈgation,
mÍme si les conditions d'observation (pression et tempÈrature) ne sont pas toujours facile- i i "MPSI-fin" - 2013/7/22 - 9:45 - page 2 - #10i i i i i iCHAPITRE1- TRANSFORMATION DE LA MATIÈRE
ment accessibles à l"expérience. Nous résumons ci-après (figure 1.1) les noms des différents
changements d'Ètat d'agrÈgation de la matiËre.Žtat gazeuxétat liquideétat solidesolidiÞcationfusionliquéfaction(condensation liquide)condensation (solide)vaporisationsublimationFIGURE1.1 - Les différents changements d"états de la matière
On appellephaseune forme de la matière qui est uniforme en tout point par sa composition chimique et par son Ètat physique.Définition
Nous parlerons donc dephasegazeuse, liquide ou solide d"un corps ou bien des différentes phases solides d'un corps. Par exemple le phosphore P est rencontrÈ sous forme d'une pre- miËre phase solide (phosphore noir) ou d'une deuxiËme phase solide (phosphore blanc). Le phosphore blanc est une phase solide du phosphore, de couleur blanche, trËs fortement in- ammable et dÈgageant alors des vapeurs corrosives. Le phosphore noir est une phase solide du phosphore, de couleur noire, trËs peu rÈactive.1.2 Distinction microscopique entre états d"agrégation
Il n"est pas forcément évident de distinguer à l"échelle microscopique les différents états
d'agrÈgation de la matiËre, en particulier l'Ètat liquide et l'Ètat gazeux. Dans unsolide cris-
tallisÈ, il existe unordre de position: chaque atome, ion ou molécule occupe une position bien dÈnie. Il existe aussi unordre d"orientationpour les édifices polyatomiques : les mo- lÈcules ou les ions occupent une direction xe, il n'y a pas de libre rotation. Les ordres deposition et d'orientation sont observÈs sur des distances trËs grandes devant les distances in-
termolÈculaires ou interatomiques. Ainsi, dans la glace, on trouve des molÈcules d'eau qui occupent des positions bien prÈcises les unes par rapport aux autres, et qui s'orientent rÈci-proquement de faÁon dÈnie et prÈvisible, sur des distances qui peuvent dÈpasser 1000 fois
la distance entre deux molÈcules voisines. ¿ l'état fluide, il n"y a pas d"ordre de position
quotesdbs_dbs35.pdfusesText_40[PDF] j'intègre physique pcsi pdf
[PDF] réplication de l'adn chez les procaryotes
[PDF] réplication de l adn animation
[PDF] transcription adn pdf
[PDF] réplication de l'adn chez les eucaryotes pdf
[PDF] padlet photos
[PDF] dur dur d'être un bébé lilly
[PDF] dur dur d'être un bébé paroles
[PDF] jordy je t'apprendrai
[PDF] jordy aujourd'hui
[PDF] jordy pochette surprise
[PDF] naranja presse 24 oranges identiques
[PDF] conservation riz cuit hors frigo
[PDF] temps de conservation des aliments cuits
