 Evolution spontanée dun système chimique` TP : COMPRENDRE
Evolution spontanée dun système chimique` TP : COMPRENDRE
3/ Réaliser la pile sans mettre le pont salin et relever la valeur de l'intensité du courant électrique. Appeler le professeur pour vérifier votre montage
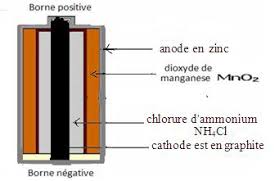 b) Fonctionnement de la pile Daniell : c) Réaction aux électrodes: d
b) Fonctionnement de la pile Daniell : c) Réaction aux électrodes: d
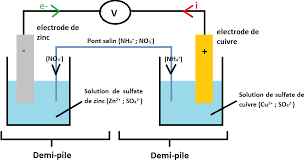
l'autre demi-pile qu'on appelle aussi électrode. ○ Le pont salin (ou ionique) qui relie les deux solutions il est constitué d'une solution de chlorure de
 FICHE DE PREPARATION
FICHE DE PREPARATION
15aine de ponts salins conservés dans un becher de chlorure de puis avec seringue introduire rapidement dans le pont salin tant que la solution est tiède.
 Fiche de synthèse n°4 : piles
Fiche de synthèse n°4 : piles
pont salin. Exemple : Ci-après un schéma légendé d'une pile Daniell. L'électrolyte utilisé dans le pont salin une solution de nitrate d'ammonium (NH4. + ...
 Structure et repliement des protéines - Cours 2
Structure et repliement des protéines - Cours 2
Pont salin (salt bridge ion-pairing) interaction électrostatique entre deux (ou plus) résidus chargés peut inclure des liaisons hydrogènes
 Pont salin
Pont salin
Page 1. +. - i e-. Cu(aq). 2+. SO4(aq). 2-. Zn(aq). 2+. SO4(aq). 2-. Cu(s). Zn(s). Pont salin.
 APRES EDF BDF BACTERIES DE FRANCE
APRES EDF BDF BACTERIES DE FRANCE
Des pistes futures de nouveaux paramètres : pont salin pH
 04 - Étude dune pile Ag Zn
04 - Étude dune pile Ag Zn
- dans les solutions aqueuses et dans le pont salin les porteurs de charge sont les ions : les cations se déplacent dans le sens du courant et les anions
 Electrode différentielle numérique pHD-S sc pour pH et ORP
Electrode différentielle numérique pHD-S sc pour pH et ORP
Le pont salin unique et remplaçable contient un volume considérable de solution tampon pour prolonger la durée de vie du capteur en protégeant l'électrode de
 b) Fonctionnement de la pile Daniell : c) Réaction aux électrodes: d
b) Fonctionnement de la pile Daniell : c) Réaction aux électrodes: d
Le pont salin (ou ionique) qui relie les deux solutions il est constitué d'une solution de chlorure de potassium (K++Cl-) qui.
 FICHE DE PREPARATION
FICHE DE PREPARATION
15aine de ponts salins conservés dans un becher de chlorure de potassium puis avec seringue introduire rapidement dans le pont salin tant que la ...
 Evolution spontanée dun système chimique` TP : COMPRENDRE
Evolution spontanée dun système chimique` TP : COMPRENDRE
Pont salin. Page 2. 2. 7/ Préciser la lame métallique qui est le siège d'une réaction de réduction. 8/ Sur le schéma ci-dessus indiquer la cathode et l'anode de
 Documents de Physique-Chimie – M. MORIN 1
Documents de Physique-Chimie – M. MORIN 1
Le pont salin sert à fermer le circuit grâce une migration d'ions qui viennent compenser les modifications de concentrations en d'ions dans les deux récipients.
 Chapitre 1
Chapitre 1
pont salin) la tension mesurée est égale à 1
 I. Principes de piles galvaniques
I. Principes de piles galvaniques
2) Les deux demi-piles sont reliées par un pont salin (ce pont est constitué du papier filtre de taille 1×8 cm mouillé avec une solution saturée de KNO3).
 T.4.1 T.P. N°1 Comment fabriquer une pile ?
T.4.1 T.P. N°1 Comment fabriquer une pile ?
Un pont salin (papier imbibé de nitrate d'ammonium). Un support en bois pour poser les béchers. III) Données : Les piles convertissent l'énergie chimique en
 lame de zinc lame dargent pont salin Ag Zn lame de zinc lame d
lame de zinc lame dargent pont salin Ag Zn lame de zinc lame d
document proposé sur le site « Sciences Physiques en BTS » : http://nicole.cortial.net lame de zinc lame d'argent pont salin.
 Piles électrochimiques
Piles électrochimiques
- Placer dans un bécher n° 2 un volume d'environ 40 mL de la solution de sulfate de cuivre et y plonger une lame de cuivre. - Préparer un pont salin – bande de
 TP N°10-PROF : LES PILES ELECTROCHIMIQUES
TP N°10-PROF : LES PILES ELECTROCHIMIQUES
pont salin. Conclure que la pile en fonctionnement est un système hors équilibre. b) Étude du fonctionnement d'une pile en circuit ouvert.
 [PDF] c) Réaction aux électrodes: d) Rôle du pont salin - AlloSchool
[PDF] c) Réaction aux électrodes: d) Rôle du pont salin - AlloSchool
Le pont salin (ou ionique) qui relie les deux solutions il est constitué d'une solution de chlorure de potassium (K++Cl-) qui
 [PDF] Fiche de synthèse n°4 : piles
[PDF] Fiche de synthèse n°4 : piles
Le pont salin/la membrane assure l'électroneutralité de la pile et permet de fermer le circuit électrique Dans une pile les réactifs (oxydant d'un couple et
 [PDF] tp : comprendre et modeliser le fonctionnement dune pile
[PDF] tp : comprendre et modeliser le fonctionnement dune pile
3/ Réaliser la pile sans mettre le pont salin et relever la valeur de l'intensité du courant électrique Appeler le professeur pour vérifier votre montage (
 [PDF] [PDF] Les piles - Chapitre 1
[PDF] [PDF] Les piles - Chapitre 1
Le pont salin permet de compenser les charges électriques : il y a apport d'anions vers la demi-pile dont l'électrode produit des cations (anode) et apport de
 [PDF] 10pilespdf
[PDF] 10pilespdf
La jonction entre demi-piles peut être réalisée par l'intermédiaire d'un pont salin constitué d'un tube rem- pli d'une solution gélifiée contenant des ions
 [PDF] Les piles dispositifs mettant en jeu des transformations spontanées
[PDF] Les piles dispositifs mettant en jeu des transformations spontanées
? Inversement la solution de sulfate de cuivre II s'appauvrit en ions cuivre II pour compenser ce défaut de charge positive des ions ammonium du pont salin
 Pont Salin PDF Ion Cuivre - Scribd
Pont Salin PDF Ion Cuivre - Scribd
La pile électrique chimique Il existe plusieurs types de piles électriques et la majorité d'entre elles sont des piles électriques chimiques
 [PDF] Oxydo-réduction et Piles électrochimiques SMPC2 fsr 2015
[PDF] Oxydo-réduction et Piles électrochimiques SMPC2 fsr 2015
Indiquer les sens de migration des ions dans le pont salin 5) Calculer à l'équilibre le potentiel de chacune des électrodes et la concentration des ions
 [PDF] cours-pc-2bac-sp-international-fr-27-1pdf - Moutamadrisma
[PDF] cours-pc-2bac-sp-international-fr-27-1pdf - Moutamadrisma
La pile Daniell est constituée de deux compartiments liés par un pont salin ? Le premier compartiment se compose d'une plaque de cuivre plongée dans une
 [PDF] I Principes de piles galvaniques
[PDF] I Principes de piles galvaniques
2) Les deux demi-piles sont reliées par un pont salin (ce pont est constitué du papier filtre de taille 1×8 cm mouillé avec une solution saturée de KNO3)
Piles électrochimiques
Mode opératoire
Partie 1 : Réactifs en présence dans une solution saline - Dans un bécher mélanger environ 20 mL d'une solution de sulfate de cuivre 0.1 mol/L et 20 mL de sulfate de zinc 0.1 mol/L. - Plonger dans le bécher une lame de zinc et une lame de cuivre. prĠalablement polies aǀec du papier Ġmeri et rincĠes ă l'eau. - Attendre une minute et observer. Partie 2 ͗ Echange indirect d'Ġlectrons - RĠalisation d'une pile (pile deDaniell)
- Placer dans un bĠcher nΣ 1 un ǀolume d'enǀiron 40 mL de la solution de sulfate de zinc et y plonger une lame de zinc. - Placer dans un bécher n° 2 un volume d'enǀiron 40 mL de la solution de sulfate de cuivre et y plonger une lame de cuivre. - Préparer un pont salin - bande de papier filtre imbibé d'une solution saline (sulfate de sodium). - Plonger les edžtrĠmitĠs du pont salin dans les bĠchers et fidžer le ă l'aide d'une pince. - Un voltmètre affiche la tension entre sa borne V et COM. En mettant l'appareil de mesure sur la position 20 V, mesurer la tension entre les deux métaux en reliant les deux béchers par le pont salin. Attention les deux lames métalliques ne peuvent se toucher ! - Quelle est la valeur de la tension de la pile ? - Faire une mesure en absence du pont salin. Que constatez-vous ? - En mettant l'appareil de mesure sur la position 200 ou 2000 µA, faire une mesure du courant généré par la pile en présence et absence de pont salin. Que constatez-vous ?Partie 3 : Combinaison de piles en série
- Réaliser une deuxième pile identique à celle de la partie 2. - Relier l'Ġlectrode de Cu d'une pile ă l'Ġlectrode de Zn de l'autre pile par un fil électrique. - A l'aide d'un ǀoltmètre mesurer la tension entre les deux métaux non reliés entre eux par le fil électrique. Quelle est la valeur de la tension de la pile ? Comparer avec la mesure obtenue avec une seule pile. - Mesurer le courant en changeant d'échelle. Quelle est la valeur du courant généré ? Comparer avec la mesure obtenue avec une seule pile. - A la place du voltmètre placer une ampoule LED (Light-Emitting Diode) et obserǀer (dans l'obscuritĠ en l'entourant par ǀotre main) si elle s'allume. Essayer de connecter la LED dans les deux sens. - Refaire une mesure de tension et de courant en reliant les deux béchers contenant les électrodes de nature différente par un pont salin Partie 4 : Système électrochimique - Magnésium - carbone (crayon) - Dans un petit bécher introduire une solution saline (NaCl env. 1 mol/L), le crayon (carbone) taillé aux deux extrémités et un ruban de magnésium. - Mesurer la tension et le courant de la pile. - Utiliser une carte musicale ou une calculette pour tester le fonctionnement de la pile. Réaction chimique et énergie électrique : les piles électrochimiquesMatériel et Réactifs:
- 4 béchers +/- 100 mL + 2 béchers - 2 lames de Cu - 2 lames de Zn - 1 ruban de magnésium (+/- 20 cm x 3 mm) - 1 crayon noir taillé aux 2 extrémités - Papier émeri - 1 multimètre + cables - 3 fils avec petites pinces croco - 3 x papier-filtre - 2 pinces à linge (pas indispensable) - 1 ampoule LED - 1 carte musicale /calculette + Réactifs - Solution de sulfate de cuivre 0.1 mol/L - Solution de sulfate de zinc 0.1 mol/L - Solution saline (NaCl +/- 1 mol/L)quotesdbs_dbs35.pdfusesText_40[PDF] electrode 1ere espece
[PDF] électrode au chlorure d'argent
[PDF] electrode de platine
[PDF] électrode d'argent
[PDF] électrode de référence au chlorure d'argent
[PDF] montage électrochimique 3 électrodes
[PDF] comment tracer une courbe courant potentiel
[PDF] montage ? trois électrodes
[PDF] comment tracer courbe intensité potentiel
[PDF] exercice courbe intensité-potentiel
[PDF] tracé des courbes ie de fe2+/fe3+
[PDF] courbe intensité potentiel exercices corrigés
[PDF] eeg interpretation
[PDF] eeg interpretation pdf

