 Evolution spontanée dun système chimique` TP : COMPRENDRE
Evolution spontanée dun système chimique` TP : COMPRENDRE
3/ Réaliser la pile sans mettre le pont salin et relever la valeur de l'intensité du courant électrique. Appeler le professeur pour vérifier votre montage
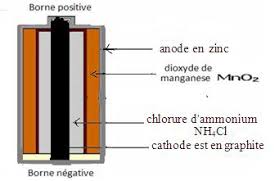 b) Fonctionnement de la pile Daniell : c) Réaction aux électrodes: d
b) Fonctionnement de la pile Daniell : c) Réaction aux électrodes: d
l'autre demi-pile qu'on appelle aussi électrode. ○ Le pont salin (ou ionique) qui relie les deux solutions il est constitué d'une solution de chlorure de
 FICHE DE PREPARATION
FICHE DE PREPARATION
15aine de ponts salins conservés dans un becher de chlorure de puis avec seringue introduire rapidement dans le pont salin tant que la solution est tiède.
 Fiche de synthèse n°4 : piles
Fiche de synthèse n°4 : piles
pont salin. Exemple : Ci-après un schéma légendé d'une pile Daniell. L'électrolyte utilisé dans le pont salin une solution de nitrate d'ammonium (NH4. + ...
 Structure et repliement des protéines - Cours 2
Structure et repliement des protéines - Cours 2
Pont salin (salt bridge ion-pairing) interaction électrostatique entre deux (ou plus) résidus chargés peut inclure des liaisons hydrogènes
 Pont salin
Pont salin
Page 1. +. - i e-. Cu(aq). 2+. SO4(aq). 2-. Zn(aq). 2+. SO4(aq). 2-. Cu(s). Zn(s). Pont salin.
 APRES EDF BDF BACTERIES DE FRANCE
APRES EDF BDF BACTERIES DE FRANCE
Des pistes futures de nouveaux paramètres : pont salin pH
 04 - Étude dune pile Ag Zn
04 - Étude dune pile Ag Zn
- dans les solutions aqueuses et dans le pont salin les porteurs de charge sont les ions : les cations se déplacent dans le sens du courant et les anions
 Piles électrochimiques
Piles électrochimiques
- Préparer un pont salin – bande de papier filtre imbibé d'une solution saline (sulfate de sodium). - Plonger les extrémités du pont salin dans les béchers et
 Electrode différentielle numérique pHD-S sc pour pH et ORP
Electrode différentielle numérique pHD-S sc pour pH et ORP
Le pont salin unique et remplaçable contient un volume considérable de solution tampon pour prolonger la durée de vie du capteur en protégeant l'électrode de
 b) Fonctionnement de la pile Daniell : c) Réaction aux électrodes: d
b) Fonctionnement de la pile Daniell : c) Réaction aux électrodes: d
Le pont salin (ou ionique) qui relie les deux solutions il est constitué d'une solution de chlorure de potassium (K++Cl-) qui.
 FICHE DE PREPARATION
FICHE DE PREPARATION
15aine de ponts salins conservés dans un becher de chlorure de potassium puis avec seringue introduire rapidement dans le pont salin tant que la ...
 Evolution spontanée dun système chimique` TP : COMPRENDRE
Evolution spontanée dun système chimique` TP : COMPRENDRE
Pont salin. Page 2. 2. 7/ Préciser la lame métallique qui est le siège d'une réaction de réduction. 8/ Sur le schéma ci-dessus indiquer la cathode et l'anode de
 Documents de Physique-Chimie – M. MORIN 1
Documents de Physique-Chimie – M. MORIN 1
Le pont salin sert à fermer le circuit grâce une migration d'ions qui viennent compenser les modifications de concentrations en d'ions dans les deux récipients.
 Chapitre 1
Chapitre 1
pont salin) la tension mesurée est égale à 1
 I. Principes de piles galvaniques
I. Principes de piles galvaniques
2) Les deux demi-piles sont reliées par un pont salin (ce pont est constitué du papier filtre de taille 1×8 cm mouillé avec une solution saturée de KNO3).
 T.4.1 T.P. N°1 Comment fabriquer une pile ?
T.4.1 T.P. N°1 Comment fabriquer une pile ?
Un pont salin (papier imbibé de nitrate d'ammonium). Un support en bois pour poser les béchers. III) Données : Les piles convertissent l'énergie chimique en
 lame de zinc lame dargent pont salin Ag Zn lame de zinc lame d
lame de zinc lame dargent pont salin Ag Zn lame de zinc lame d
document proposé sur le site « Sciences Physiques en BTS » : http://nicole.cortial.net lame de zinc lame d'argent pont salin.
 Piles électrochimiques
Piles électrochimiques
- Placer dans un bécher n° 2 un volume d'environ 40 mL de la solution de sulfate de cuivre et y plonger une lame de cuivre. - Préparer un pont salin – bande de
 TP N°10-PROF : LES PILES ELECTROCHIMIQUES
TP N°10-PROF : LES PILES ELECTROCHIMIQUES
pont salin. Conclure que la pile en fonctionnement est un système hors équilibre. b) Étude du fonctionnement d'une pile en circuit ouvert.
 [PDF] c) Réaction aux électrodes: d) Rôle du pont salin - AlloSchool
[PDF] c) Réaction aux électrodes: d) Rôle du pont salin - AlloSchool
Le pont salin (ou ionique) qui relie les deux solutions il est constitué d'une solution de chlorure de potassium (K++Cl-) qui
 [PDF] Fiche de synthèse n°4 : piles
[PDF] Fiche de synthèse n°4 : piles
Le pont salin/la membrane assure l'électroneutralité de la pile et permet de fermer le circuit électrique Dans une pile les réactifs (oxydant d'un couple et
 [PDF] tp : comprendre et modeliser le fonctionnement dune pile
[PDF] tp : comprendre et modeliser le fonctionnement dune pile
3/ Réaliser la pile sans mettre le pont salin et relever la valeur de l'intensité du courant électrique Appeler le professeur pour vérifier votre montage (
 [PDF] [PDF] Les piles - Chapitre 1
[PDF] [PDF] Les piles - Chapitre 1
Le pont salin permet de compenser les charges électriques : il y a apport d'anions vers la demi-pile dont l'électrode produit des cations (anode) et apport de
 [PDF] 10pilespdf
[PDF] 10pilespdf
La jonction entre demi-piles peut être réalisée par l'intermédiaire d'un pont salin constitué d'un tube rem- pli d'une solution gélifiée contenant des ions
 [PDF] Les piles dispositifs mettant en jeu des transformations spontanées
[PDF] Les piles dispositifs mettant en jeu des transformations spontanées
? Inversement la solution de sulfate de cuivre II s'appauvrit en ions cuivre II pour compenser ce défaut de charge positive des ions ammonium du pont salin
 Pont Salin PDF Ion Cuivre - Scribd
Pont Salin PDF Ion Cuivre - Scribd
La pile électrique chimique Il existe plusieurs types de piles électriques et la majorité d'entre elles sont des piles électriques chimiques
 [PDF] Oxydo-réduction et Piles électrochimiques SMPC2 fsr 2015
[PDF] Oxydo-réduction et Piles électrochimiques SMPC2 fsr 2015
Indiquer les sens de migration des ions dans le pont salin 5) Calculer à l'équilibre le potentiel de chacune des électrodes et la concentration des ions
 [PDF] cours-pc-2bac-sp-international-fr-27-1pdf - Moutamadrisma
[PDF] cours-pc-2bac-sp-international-fr-27-1pdf - Moutamadrisma
La pile Daniell est constituée de deux compartiments liés par un pont salin ? Le premier compartiment se compose d'une plaque de cuivre plongée dans une
 [PDF] I Principes de piles galvaniques
[PDF] I Principes de piles galvaniques
2) Les deux demi-piles sont reliées par un pont salin (ce pont est constitué du papier filtre de taille 1×8 cm mouillé avec une solution saturée de KNO3)
Chapitre
TP Objectifs bac : Pratiquer une démarche expérimentale pour : -réaliser une pile et modéliser son fonctionnement -mesurer sa f.e.mContexte du sujet:
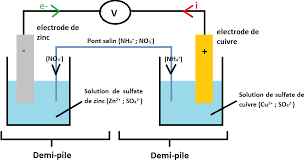
. Nous allons ici tenter de modéliser ctrodes. Nous déterminerons ensuite sa force électromotrice (f.e.m). une pile : Modélisation des réactions chimiques Une pile Daniell est constituée de deux demi-piles. La demi-pile de gauche est constituée 1 1 = 0,1 mol.L-1. Dans laquelle plonge une lame de zinc. (Voir schéma ci-dessous) La demi-pile de droite est constituée 1 entration C2 = 0,1 mol.L-1.Dans laquelle plonge une lame de cuivre. (Voir schéma ci-dessous)1/ Compléter le schéma ci-
) Coup de pouce : Vous indiquerez sur le schéma les bornes3ant électrique.
Appeler le professeur pour vérifier votre montage (Appel n°1)4/- Placer alors le pont salin+ et des ions Cl-)
-Retirer alors le pont salin. Le rincer.5/ A partir de votre réponse à la question 3, indiquer sur le schéma ci-dessus :
b/ le sens de déplacement des électrons libres dans ce même dipôlec/ le sens de déplacement des cations (ions positifs) et des anions (ions négatifs) au sein des solutions et du pont salin
d/ En déduire la borne positive et la borne négative de la pile.6/ Préciser la lame métal
Demi-pile
Electrode
Zn CuCu2+(aq) + SO42-(aq) Zn2+(aq) + SO42-(aq)
Pont salin
2 78/ Sur le schéma ci-
- ectrons)9/ Ecrire les demi-
10/11/ ǻ
Déterminer la diminution de masse, notée mc
EN RÉSUMÉ
ÎLa pile
-Une pile est constituée de deux de demi-piles séparées par un électrolyte (solution riche en ions).
Remarque
ÎLa demi-pile
- : Ox/RedRemarque
ÎLe pont salin joue deux rôles :
-fermer le circuit afin assurer le passage du courant électrique dans la pile. -assurer la neutralité électrique des solutions.II/ une pile. Notion de force électromotrice.
(f.e.m) E.La force électromotrice E modélise la capacité de la pile à mettre en marche les électrons.
: UPN = E r.IUPN : Tension aux bornes de la pile
E : Force électromotrice de la pile (ou f.e.m)
r : résistance interne de la pile I intensité du courant électrique débitée par la pile Une pile a donc pour caractéristique la courbe UPN = f(I) ci-contreLa f.e.m est donc égale à la tension aux bornes de la pile lorsque celle-ci ne débite pas. (Circuit ouvert)
Dans cette partie, on se propose de déterminer expérimentalement la f.e.m E de la pile Daniell.
-dessous. Faites-le et mesurer la valeur de E.Remarques :
-ȍeCOM. Ce dernier effectuant le calcul VV - Vcom.
-Lorsque le multimètre est en mode voltmètre, sa résistance est de lȍ voltmètre est donc nulle, on peut donc écrire que UPN = E R E N P UPN E , r N P UPN0 I Icc
E Zn Cu VVȍ COM
3CORRECTION
2/Lquasi-nulle.
4/ (voir schéma)
Les ions positifs se déplacent dans le sens du courant. En solution, le passage du courant électrique est assuré par les ions.En solution, le passage du courant électrique est assuré par une double migration des ions en sens opposé.
57/ Voir schéma.
8-) : oxydation ĺ2+(aq) + 2e-
A la cathode (borne +) : réduction : Cu2+(aq) + 2e- ĺ Equation chimique : Cu2+(aq) + Zn(s) = Cu(s) + Zn2+(aq) -Une pile redox naturelle et irréversible. -Lextérieur. Il est donc indirect. Ceci explique que la pile ne débite un courant que si elle est branchée dans un circuit. 9/ Plus le potentiel redox du couple est grand et plus Plus le potentiel redox du couple est petit et plus le réducteur est fort.Demi-pile
Electrode
Zn CuCu2+(aq) + SO42-(aq) Zn2+(aq) + SO42-(aq)
A R I e-Anode Cathode
COM mA ou 10A
VCOM V ȍ
Cu2+ Cu
Zn2 ZnE1 = + 0,34V
E2 = -0,76V
4 I/ Le courant électrique : un débit de charge électrique Lorsque vous achetez dans le commerce des piles rechargeables il est indiqué : 1300 mAhQue signifie cette information ?
Intensité du courant électrique = débit de charge électriqueQ : Qui assure le passage du courant électrique dans les métaux ? Les électrons. Il existe donc une relation entre Q et les
électrons mis en jeu.
Î Relation entre Q et n(e-)
Q = N(e-) ൈ:FA; = N(e-) ൈA
Q = n(e-)
NA ePosons F = NA.
e = 6,02.10231,60.10-19 = 9,65.104 C.mol-1
Q = n(e-)
FÎRelation entre n(e-) et nc(Zn)
Il faut raisonner sur les demi-équation redox
Exemple de la pile Danielle : ĺ2+(aq) + 2e-
sRaisonnement. On détermine Q à partir de I puis n(e-) à partir de Q puis nc(Zn) à partir de n(e-) puis mc(Zn)
10/ I = 0 soit U = E r.I = E = 0,474 V.
I = ொ
A C s 5PROFESSEUR
CONTERIO
DATE DU TP
DATE DE DEPOT
PREPARATEUR
JOUR DU TP
SALLEHORAIRE
TP (TS spé) : LES PILES
BAC ELEVE (binôme :
Pont salin (tube en U contenant un gel constitué de (K+(aq) + Cl-(aq)) 1Béchers de 100 mL 3
Eprouvette graduée de 100 mL 1
Plaque de cuivre 1
plaque de zinc 1Pince croco 2
Multimètre (Vérifier son fonctionnement en mode voltmètre et ampèremètre) 1ȍ 1
Fils de connexion 2
Plaque support 1
BAC PROF
Fiole contenant une solution de Cu2+(aq) + SO42-(aq) à 0,1 mol.L-1 (compter 60 mL par binôme) 1 Fiole contenant une solution de Zn2+(aq) + SO42-(aq) à 0,1 mol.L-1 (compter 60 mL par binôme) 1Bac de récupération 2
Entonnoir 2
quotesdbs_dbs35.pdfusesText_40[PDF] electrode 1ere espece
[PDF] électrode au chlorure d'argent
[PDF] electrode de platine
[PDF] électrode d'argent
[PDF] électrode de référence au chlorure d'argent
[PDF] montage électrochimique 3 électrodes
[PDF] comment tracer une courbe courant potentiel
[PDF] montage ? trois électrodes
[PDF] comment tracer courbe intensité potentiel
[PDF] exercice courbe intensité-potentiel
[PDF] tracé des courbes ie de fe2+/fe3+
[PDF] courbe intensité potentiel exercices corrigés
[PDF] eeg interpretation
[PDF] eeg interpretation pdf
