 Problème 1 : Titrage dune solution dacide oxalique
Problème 1 : Titrage dune solution dacide oxalique
28 avr. 2016 La réaction entre l'acide oxalique et les ions permanganate fait l'objet d'études depuis plus de. 150 ans. Cette transformation présente des ...
 FILIÈRE BCPST COMPOSITION DE CHIMIE 1 Réaction entre lacide
FILIÈRE BCPST COMPOSITION DE CHIMIE 1 Réaction entre lacide
1 janv. 2015 Afin de comprendre les différences observées on modélise la réaction d'oxydation de l'acide oxalique par les ions permanganate (notés M) à l' ...
 CORRECTION de lÉVALUATION DE SCIENCES PHYSIQUES ET
CORRECTION de lÉVALUATION DE SCIENCES PHYSIQUES ET
Les deux parties de cet exercice sont indépendantes. Partie A : la réaction chimique. Les ions permanganate de formule MnO4. - réagissent avec l'acide oxalique
 exercice chimie_f.brossard 10-03
exercice chimie_f.brossard 10-03
réaction entre l'acide oxalique. H2C2O4 et les ions permanganate MnO4. − . Dans le système étudié seul l'ion permanganate est coloré en solution. I. Réglage ...
 Réaction (55 pts) Les ions permanganate de formule MnO 4
Réaction (55 pts) Les ions permanganate de formule MnO 4
On mélange initialement un volume VA = 500 mL d'acide oxalique à la concentration CA = 2
 BACCALAURÉAT GÉNÉRAL Épreuve pratique de lenseignement
BACCALAURÉAT GÉNÉRAL Épreuve pratique de lenseignement
On se propose ici d'étudier la réaction des ions permanganate avec l'acide oxalique pour mesurant la différence entre la concentration initiale de ...
 Étude spectroscopique de la cinétique de la réaction MnO4
Étude spectroscopique de la cinétique de la réaction MnO4
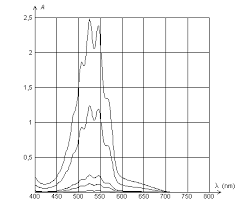
Figure 10 : Évolution du spectre au cours de la réaction entre MnO2 et l'acide oxalique. La réaction permanganate/acide oxalique présente des propriétés.
 Exercice non spécialité : cinétique chimique
Exercice non spécialité : cinétique chimique
acide oxalique ? 2.3.c. Réécrire l'équation de la réaction entre les ions permanganate et l'acide oxalique puis dresser un tableau d'avancement. Calculer l ...
 ÉTUDE CINÉTIQUE DE QUELQUES TRANSFORMATIONS
ÉTUDE CINÉTIQUE DE QUELQUES TRANSFORMATIONS
- avec de l'acide oxalique H2C2O4 . Équation de la réaction : 2MnO4. − + 5H2C2O4 On étudie est la réaction entre les ions permanganate MnO4. - et l'acide ...
 TP de chimie n°3 Facteurs influant sur la vitesse dune réaction
TP de chimie n°3 Facteurs influant sur la vitesse dune réaction
On va réaliser la réaction entre les ions permanganate et l'acide oxalique à 3 températures différentes : dans un bain de glace à température ambiante puis
 Problème 1 : Titrage dune solution dacide oxalique
Problème 1 : Titrage dune solution dacide oxalique
28 avr. 2016 Le permanganate de potassium libère en solution des ions potassium K+ et des ions permanganate MnO4. -?. La réaction entre l'acide oxalique ...
 FILIÈRE BCPST COMPOSITION DE CHIMIE 1 Réaction entre lacide
FILIÈRE BCPST COMPOSITION DE CHIMIE 1 Réaction entre lacide
Afin de comprendre les différences observées on modélise la réaction d'oxydation de l'acide oxalique par les ions permanganate (notés M) à l'aide des équations
 Etude cinétique dune réaction doxydoréduction suivie par
Etude cinétique dune réaction doxydoréduction suivie par
En ce lundi de rentrée l'étude de la réaction que nous nous proposons d'étudier
 CORRECTION de lÉVALUATION DE SCIENCES PHYSIQUES ET
CORRECTION de lÉVALUATION DE SCIENCES PHYSIQUES ET
Les deux parties de cet exercice sont indépendantes. Partie A : la réaction chimique. Les ions permanganate de formule MnO4. - réagissent avec l'acide oxalique
 Réaction (55 pts) Les ions permanganate de formule MnO 4
Réaction (55 pts) Les ions permanganate de formule MnO 4
On mélange initialement un volume VA = 500 mL d'acide oxalique à la concentration CA = 2
 1h I- Réaction entre lacide oxalique et les ions permanganate (10 +
1h I- Réaction entre lacide oxalique et les ions permanganate (10 +
16 févr. 2012 I- Réaction entre l'acide oxalique et les ions permanganate (10 + 1 points) ... permanganate de potassium en milieu acide. la seule espèce ...
 Étude spectroscopique de la cinétique de la réaction MnO4
Étude spectroscopique de la cinétique de la réaction MnO4
l'effet de la concentration initiale en acide oxalique (acide éthane- Il n'y a donc pas de réaction rapide impliquant les ions MnO4.
 Cette épreuve est constituée de trois exercices. Elle comporte
Cette épreuve est constituée de trois exercices. Elle comporte
27 févr. 2017 3.1- Ecrire l'équation de la réaction entre A et B. Nommer le produit ... 2- Oxydation de l'acide oxalique par les ions permanganate.
 Problème 1 : Titrage dune solution dacide oxalique Centrale PC
Problème 1 : Titrage dune solution dacide oxalique Centrale PC
28 avr. 2016 La réaction entre l'acide oxalique et les ions permanganate fait l'objet d'études depuis plus de. 150 ans. Cette transformation présente des ...
 Etude cinétique dune réaction doxydoréduction suivie par
Etude cinétique dune réaction doxydoréduction suivie par
L'étude de la réaction que nous nous proposons d'étudier entre les ions permanganate. MnO4. -? et l'acide oxalique H2C2O4
 [PDF] Réaction entre lacide oxalique et les ions permanganate (10 + 1 poin
[PDF] Réaction entre lacide oxalique et les ions permanganate (10 + 1 poin
16 fév 2012 · I- Réaction entre l'acide oxalique et les ions permanganate (10 + 1 points) Une solution incolore d'acide oxalique de formule H2C204(aq)
 [PDF] Réaction (55 pts) Les ions permanganate de formule MnO
[PDF] Réaction (55 pts) Les ions permanganate de formule MnO
Réaction (55 pts) Les ions permanganate de formule MnO - 4 réagissent avec l'acide oxalique de formule H2C2 O4 suivant l'équation suivante :
 [PDF] Problème 1 : Titrage dune solution dacide oxalique - Chimie en PCSI
[PDF] Problème 1 : Titrage dune solution dacide oxalique - Chimie en PCSI
28 avr 2016 · La réaction entre l'acide oxalique et les ions permanganate fait l'objet d'études depuis plus de 150 ans Cette transformation présente des
 [PDF] CORRECTION de lÉVALUATION DE SCIENCES PHYSIQUES ET
[PDF] CORRECTION de lÉVALUATION DE SCIENCES PHYSIQUES ET
Partie A : la réaction chimique Les ions permanganate de formule MnO4 - réagissent avec l'acide oxalique de formule H2C2O4 suivant l'équation suivante :
 [PDF] Etude dune cinétique par spectrophotomètrie (9 points)
[PDF] Etude dune cinétique par spectrophotomètrie (9 points)
cinétique par spectrophotométrie d'une transformation lente mettant en jeu une réaction entre l'acide oxalique H2C2O4 et les ions permanganate MnO4
 [PDF] Étude dune réaction : titrage des ions fer II par les ions permanganate
[PDF] Étude dune réaction : titrage des ions fer II par les ions permanganate
Les ions permanganate MnO4 - violet et les ions fer II Fe2+ réagissent ensemble pour donner des ions manganèse Mn2+ incolores et des ions fer III Fe3+
 [PDF] Étude spectroscopique de la cinétique de la réaction MnO4
[PDF] Étude spectroscopique de la cinétique de la réaction MnO4
participation de l'étape F de réduction directe du permanganate par l'acide oxalique moléculaire 9 ORIGINE DE L'AUTOCATALYSE L'effet autocatalytique de Mn(II)
 [PDF] Réaction lente et réaction rapide Exercices corrigés - AlloSchool
[PDF] Réaction lente et réaction rapide Exercices corrigés - AlloSchool
couple écrire l'équation de la réaction d'oxydoréduction Exercice 2 : La réaction de l'acide bilan entre les ions permanganate et l'acide oxalique
 [PDF] filière bcpst composition de chimie - Paris - ENS
[PDF] filière bcpst composition de chimie - Paris - ENS
1 jan 2015 · 1 Réaction entre l'acide oxalique et les ions permanganate 1 1 Étude cinétique La réaction entre les ions permanganate et l'acide oxalique
 [PDF] Thème : Cinétique chimique Fiche 6 - Studyrama
[PDF] Thème : Cinétique chimique Fiche 6 - Studyrama
de la réaction les proportions stoechiométriques sont obtenues si la quantité d'acide oxalique est 2 5 fois la quantité d'ions permanganate
Pourquoi l'ion permanganate est le reactif limitant ?
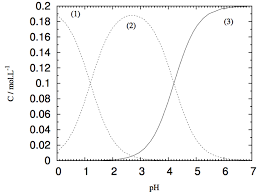
La seule esp? colorée, l'ion permanganate disparaît du milieu réactionnel à l'état final : MnO4- aq constitue le réactif limitant.Pourquoi les ions permanganate sont colorés en solution aqueuse ?
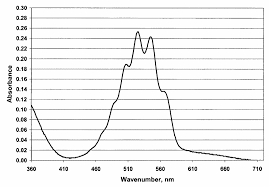
Les ions permanganate sont colorées car comme le montre le spectre d'absorption obtenu d'une solution aqueuse de permanganate de potassium, il existe une large bande de longueurs d'ondes autour de 475-575 nm que les ions permanganate absorbent.Est-ce que H2C2O4 est un acide fort ?
première acidité étant assez forte, la proportion de H2C2O4 au départ est à peine supérieure à 50%.- Il s'agit d'un acide organique que l'on trouve dans l'oseille ou dans la rhubarbe et qui ne laisse pas de résidus. 40 grammes d'A O par litre de sirop semble être le dosage adapté à notre région. Avant toute manipulation un léger enfumage est nécessaire avant d'ouvrir les ruches.
1ère- spécialité sciences physiques et chimiques - évaluation - novembre 2019 - page 1/3
CORRECTION de l'ÉVALUATION
DE SCIENCES PHYSIQUES ET CHIMIQUES1ère S
durée 45 min EXERCICE 1 (7 points) : réaction des ions permanganate avec l'acide oxalique Les deux parties de cet exercice sont indépendantes.Partie A : la réaction chimique
Les ions permanganate de formule MnO4- réagissent avec l'acide oxalique de formule H2C2O4 suivant l'équation suivante :2MnO4-(aq)+ 5 H2C2O4 (l)+ 6 H+(aq) → 2Mn2+ (aq)+ 10 CO2 (g)+ 8 H2O(l)
Les ions permanganate MnO4- colorent la solution en violet/rose. Toutes les autres espèces en solution
sont incolores.Pour que la réaction ait lieu, le milieu réactionnel doit être acidifié par ajout d'acide sulfurique en excès :
les ions H+ dans l'équation représentent cet ajout mais ne sont pas à considérer comme un réactif.
On mélange initialement un volume VA= 50,0 mL d'acide oxalique à la concentration CA=2,0×10-2mol.L-1
avec un volume VB = 20,0 mL de permanganate de potassium à la concentration CB = 5,0.10-2mol.L-1.1. Calculez les quantités initiales de réactifs (nA)0 et (nB)0.
Pour l'acide oxalique : (nA)0 = CA × VA = 2,0.10-2 × 50,0.10-3 = 1,0.10-3 mol= 1,0 mmol Pour les ions permanganate : (nB)0 = CB × VB = 5,0.10-2 × 20,0.10-3 = 1,0.10-3 mol= 1,0 mmol2. Complétez le tableau d'avancement de la réaction de manière littérale : exprimez les quantités de
matière en fonction de (nA)0 ,(nB)0 et x.Equation 2MnO4-(aq) + 5 H2C2O4 (aq) + 6 H+(aq) → 2Mn2+ (aq) + 10 CO2 (g) + 8 H2O(l)
Etat initial
(x = 0 à t = 0)(nB)0(nA)0excès00solvantEtat final
(x = xmax) (nB)0 - 2 xmax(nA)0 - 5 xmaxexcès2 xmax10 xmaxsolvant3. Déterminez quel est le réactif limitant et quelle est la valeur de l'avancement maximal xmax..
• Si MnO4 - est le réactif limitant alors (nB)0 - 2 xmax= 0 et donc xmax = 0,5 mmol • Si H2C2O4- (aq) est le réactif limitant alors (nA)0 - 5 xmax = 0 et donc xmax = 0,2 mmolL'acide oxalique H2C2O4 (aq) permet un avancement plus petit donc il est le réactif limitant et xmax vaut 0,20
mmol.1ère- spécialité sciences physiques et chimiques - évaluation - novembre 2019 - page 2/3
4. Le mélange initial était-il stoechiométrique ? Justifiez.
Un mélange stoechiométrique est un mélange pour lequel tous les réactifs s'épuisent en meme temps, c'est-à-
dire un mélange ou tous les réactifs sont " limitant ». On peut aussi écrire qu'un mélange est
stoechiométrique lorsque les réactifs se trouvent dans les memes proportions que les coefficients
stoechiométriques.Ce n'est pas le cas ici puisque l'acide oxalique est le réactif limitant et qu'il restera des ions MnO4-(aq) à la
fin de la réaction.5. Quelle quantité de matière de dioxyde de carbone la réaction a-t-elle produit ? Justifiez.xmax vaut 0,20 mmol.
A la fin de la réaction, on a une quantité de CO2 égale à n(CO2)f = 10xmax = 2 mmol.6. En fin de réaction, quelle quantité d'ions permanganate n(MnO4-)f reste-t-il en solution ?
A la fin de la réaction, il reste n(MnO4-)f = (nB)0 -2xmax = 1,0 - 2 . 0,2 = 0,6 mmol.7. Déterminez le volume total de la solution et déduisez-en la concentration finale [MnO4-] des ions
permanganate.Vtotal = VA+ VB = 70,0 mL
[MnO4-] = n(MnO4-)f /Vtotlal donc [MnO4 -] = 0,6/70 = 8,6.10-3 mmol.mL-1 ou [MnO4 -] = 0,6 .10-3/70.10-3 = 8,6.10-3 mol.L-11ère- spécialité sciences physiques et chimiques - évaluation - novembre 2019 - page 3/3
EXERCICE 2 (3 points): atomes, ions et moléculesLe dichlorométhane est un composé organique souvent utilisé comme solvant. Sa formule chimique est
CH2Cl2. Il est composé d'atomes de carboneC6
12,d'hydrogène H1
1 et de chlore Cl17
35a / Déduisez-en, pour chaque atome, le schéma de Lewis de chacun de ces 3 atomes.
b / Donnez la représentation de Lewis de la molécule de dichlorométhane. c / Comment peut-on qualifier la géométrie de cette molécule ?quotesdbs_dbs13.pdfusesText_19[PDF] de la fécondation ? la naissance 4ème exercices
[PDF] svt 4ème les étapes de l accouchement
[PDF] de la fécondation ? la naissance svt 4ème pdf
[PDF] différence de carré
[PDF] style corps de texte word
[PDF] oursin fécondation interne ou externe
[PDF] mise en forme du texte definition
[PDF] reproduction oursin wikipedia
[PDF] un document composite est
[PDF] mise en forme d'un texte word
[PDF] exercice tableau croisé dynamique excel 2010 pdf
[PDF] tableau croisé dynamique excel 2013 tutorial
[PDF] document composite
[PDF] capacitation des spermatozoide durée
